细胞分裂周期因子CDC25B在肿瘤中作用的研究进展
2022-04-15周晶晶
王 志,周晶晶,张 静
(延安大学医学院,陕西 延安 716000)
细胞分裂周期因子25(cell division cyclin 25,CDC25)属于细胞周期调控蛋白家族,Russell等[1]研究人员最早发现其在裂殖酵母中参与启动有丝分裂。在哺乳动物体内,目前研究发现的CDC25 分为3 种亚型,分别为CDC25A、CDC25B 和CDC25C。这三种亚型可参与细胞周期每个阶段,相互作用,激活CDK 激酶和Cyclin 的复合物。CDC25A 在G1/S期发挥作用,CDC25B 在G2/M/S 期均有活性,CDC25C 是在 S 期活跃。其中,CDC25B 调控细胞周期的作用最为重要,不仅在各期转换中起关键作用,还参与细胞有丝分裂等生物学过程[2](图1)。
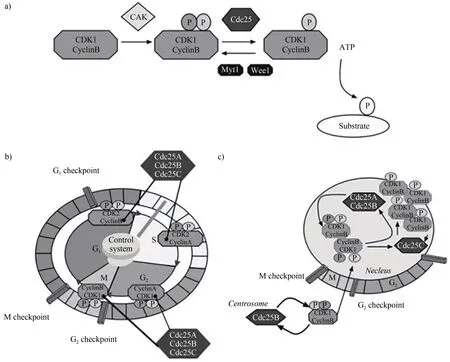
图1 CDC25磷酸酶调控细胞周期关键转换点[3]
CDC25B基因定位于常染色体20p13,全长为918 bp,编码由580 个氨基酸残基组成的蛋白质,在其结构域中包含磷酸化位点、泛素化位点和14-3-3螯合位点等修饰位点。CDC25B基因编码酪氨酸激酶,可去除CDK1中的酪氨酸残基,进而活化细胞周期蛋白依赖性蛋白激酶CDK1 和细胞周期蛋白cyclin B的复合物,促进G2/M期的转换,加快细胞分裂,正向调控细胞周期的进程[4-5]。CDC25B 还参与CDC2/CDC13 二聚体中 CDC2 的去磷酸化过程[6]。在细胞分裂间期,磷酸化CDC25B抑制其活性,并结合14-3-3 蛋白滞留在细胞质中而不能发挥其功能[7-8]。肿瘤最重要的生物学特性就是细胞的恶性增殖,然而,细胞的增殖依赖细胞分裂周期因子的参与。大量研究发现,CDC25B 磷酸酶在肿瘤的发生发展过程中起着至关重要的作用,尤其在恶性肿瘤如肺癌、胃癌、肝细胞癌、结肠癌、乳腺癌以及非霍奇金氏淋巴瘤等,CDC25B 的表达均明显高于癌旁组织。
1 CDC25B与肿瘤
1.1 消化系统肿瘤
CDC25B在胃癌中扮演着促癌基因的角色,作为下游靶分子,调控胃癌细胞的增殖、迁移、侵袭等。Bona 等[9]发现 Menadione 作为 CDC25B 的抑制剂,可降低胃癌中CDC25B表达,进而影响胃癌细胞的增殖、迁移、侵袭的速度,细胞周期受到阻滞,从而减缓肿瘤的发展。Leal 等[10]发现YWHAE沉默通过上调CDC25B 和MYC 诱导胃癌细胞增殖、侵袭和迁移。在胃癌细胞系中,YWHAE能通过降低MYC和CDC25B的表达,抑制胃癌细胞的增殖、侵袭和迁移。反之,MYC通过诱导CDC25B 和减少YWHAE而诱导胃癌细胞增殖、侵袭和迁移。由此可见,在胃癌的诊疗中,CDC25B基因是一个新颖的治疗靶点。
大量研究报道CDC25B在肝癌中作为癌基因,影响肝癌细胞的生长和运动[11-12]。CDC25B 在肝癌中可作为细胞周期关键信号分子,受上游基因调控,影响肝癌细胞的周期转换。Li 等[13]研究发现SNHG16 通过调控 let-7b-5p/CDC25B/CDK1 轴促进G2/M 转换,还可通过抑制CDC25B 磷酸酶的活性,诱导MAPK 磷酸化,抑制肝癌细胞的生长。 Kar等[14]证实氟代Cpd5 通过抑制 CDC25,激活 MAPK经典信号通路抑制人肝癌细胞的生长。
在食管癌中CDC25B 的表达明显高于癌旁组织,Sunada 等[15]对 CDC25B 和金属硫蛋白(metallo‐thionein,MT)的表达强度进行免疫组化评估,并验证其表达与化学治疗及放射治疗临床效果的相关性。发现p53 阴性、CDC25B 阳性和MT 阴性表达的食管鳞癌对化学治疗及放射治疗反应良好。Dong等[16]在随后的临床研究中发现,在食管鳞癌患者血清中的CDC25B 自身抗体水平高于健康对照者,并发现患者血清中CDC25B自身抗体的浓度与肿瘤分期明显相关(P<0.001)。尽管CDC25B 自身抗体与总生存期之间没有明显的相关性,但在晚期食管鳞癌患者中,CDC25B 血清阳性患者的5 年生存率明显低于CDC25B血清阴性患者的5年生存率。Wang等[17]报道CDC25B作为miR-214的下游基因可靶向抑制食管鳞癌细胞的增殖和侵袭。随后Jia 等[18]又进一步发现FAM83A-AS1 通过调节miR-214/CDC25B 轴促进食管鳞状细胞癌的进展,但其具体的分子机制目前仍不明确。
CDC25B 在结直肠癌中一方面依赖p53 等经典肿瘤分子破坏DNA 损伤检查点,增加自发诱变,并使细胞敏感于电离辐射和基因毒性物质。使用肿瘤细胞成球试验作为替代研究,证明CDC25B 调节结直肠癌细胞的生长抑制和凋亡[19]。另一方面同样是作为非编码RNA 的下游靶基因,起促癌作用。研究发现circRNA-102958 通过在结直肠癌中抑制miR-585 促进CDC25B 的表达,进而影响肿瘤的发生、发展[20]。
1.2 呼吸系统肿瘤
肺癌在全球的发病率和死亡率不断上升。最近Chen等[21]发现CDC25B以p53依赖的方式诱导肺癌细胞衰老并与肿瘤抑制相关,研究者还分析了癌症基因组图谱(TCGA)数据库,发现CDC25B表达高的患者预期生存率较低,高表达的CDC25B 在肺癌和其他几种癌症中具有p53 依赖的肿瘤抑制作用。这种效应不是由于特定的细胞周期阶段的改变或凋亡抑制,也不是由于诱导的DNA 损伤反应。相反,高表达CDC25B 会促进细胞的衰老进展。其中p53 蛋白在衰老过程中起重要作用,这可能解释了CDC25B 的p53 依赖性肿瘤抑制作用。进一步分析还发现,CDC25B 通过结合和去磷酸化p53 影响p53的稳定性。这项研究通过p53 依赖的衰老途径介导,确定了CDC25B的肿瘤抑制作用。
1.3 生殖系统肿瘤
乳腺癌为女性常见的恶性肿瘤之一,CDC25B可与蛋白磷酸酶2A(protein phosphatase 2A,PP2A)结合诱导AMPK 激活抑制三阴性乳腺癌。作为PP2A 的调节剂,CDC25B 除了在细胞周期调节中的作用,还与PP2A 催化亚基直接相互作用。重要的是,CDC25B 通过 PP2A 改变了 AMP 活化蛋白激酶信号的调节,通过抑制PP2A 去磷酸化AMPK 增加AMPK 活性。我们的研究证实CDC25B 是PP2A 的调节因子,并揭示了一种控制关键能量代谢标志物AMPK活性的机制[22]。
以CDC25 为切入点,IER5 是辐射后加速CDC25B表达下调的转录抑制因子。IER5作为一种潜在的放射增敏剂,在接受放化疗的患者中促进放射诱导的宫颈癌细胞凋亡。该研究发现,其分子机制为IER5 参与G2/M 转换而下调CDC25B 的表达[23]。在人子宫内膜癌中,Xie 等[24]发现,CDC25B作为miR-152靶标,通过下调CDC25B 的表达,诱导G2/M期阻滞,抑制肿瘤细胞的增殖。
研究[25]表明,CDC25B 在卵巢肿瘤中高表达,并与患者的预后密切相关。在这项研究中,WG-391D作为一种新的小分子化合物,能有效地下调CDC25B的表达而不影响其催化去磷酸化活性。WG-391D对CDC25B 的抑制是不可逆的,其诱导细胞周期进展停止在G2/M 期,并抑制多种卵巢癌细胞的增殖和迁移,这与 CDC25B 的下调和 CDC2 及 AKT 的失活有关。
1.4 泌尿系统肿瘤
Liu等[26]首先在TCGA数据库转录水平分析了72对肾透明细胞癌及其周围健康组织中MAPK14 和CDC25B的转录水平,以及66对临床标本的蛋白表达水平,发现二者在肾透明细胞癌中为高表达。敲除MAPK14后,P-MAPK14和CDC25B蛋白水平均下降。随后,Western blot 和免疫共沉淀实验证明P-MAPK14可与CDC25B 结合,维持其稳定性。siRNA 敲除MAPK14 抑制肾透明细胞癌细胞的增殖和迁移,而CDC25B 过表达则可部分逆转这一过程,提示MAPK14和P-MAPK14的下调可能通过下调CDC25B的表达抑制肾透明细胞癌细胞的增殖和迁移。
2 小结
综上所述,CDC25B作为癌基因参与了多种肿瘤的发生、发展进程,已成为新的肿瘤标志物,引起研究者的广泛注意。近年来,以CDC25B 为靶标设计的抑制剂在乳腺癌[27]、卵巢癌[28]、结肠癌[29-30]和白血病[31]等恶性肿瘤中能有效地抑制细胞增殖和集落形成,具有很好的抗癌活性,这为研究其在细胞通路中的生物学功能以及分子机制提供重要的信息,也为抗肿瘤药物的研究提供了新思路。
