斑马鱼脊髓损伤后细胞因子和再生相关分子的表达分析
2022-04-15赵丽萍黄术兵贾雪冰乔晨萌申延琴
赵丽萍,黄术兵,贾雪冰,石 芸,乔晨萌,申延琴,崔 春
(江南大学无锡医学院神经退行和损伤研究室,江苏 无锡 214122)
脊髓损伤(spinal cord injury,SCI)是由于各种原因引起的脊髓结构、功能的损害,造成损伤水平以下运动、感觉和自主神经功能障碍[1-2]。其中创伤性脊髓损伤的全球发生率高达每百万人3.6~195.4 例[3-4],目前尚无有效的治疗方法。研究发现,损伤位点微环境中的抗炎细胞因子[5-6]和再生相关分子[7-8]对神经修复和再生起重要作用。目前,哺乳动物中枢神经系统损伤中急性炎症反应的作用存在争议。一方面,研究发现,在SCI大鼠炎症表现最严重时清除外周血巨噬细胞可增强轴突再生,并促进后肢运动功能恢复[9]。另一方面,大鼠SCI 后使用消炎药米诺环素能减少少突胶质细胞死亡,减轻轴突死亡并改善运动功能[10]。研究也发现小鼠SCI 后增加单核细胞来源的巨噬细胞可提高行为学表现,表明抗炎效应也能促进再生[11]。再生相关分子的表达对于损伤后的修复也至关重要,如胸腺素4(thymosin beta 4,TBETA4)有利于脊髓损伤后神 经 元 的 存 活[12],膜 联 蛋 白 A2a(annexin A2a,ANXA2A)与斑马鱼尾鳍的再生密切相关[13]。与哺乳动物不同,斑马鱼是一种有很强再生能力的硬骨鱼类,能在脊髓完全横断后5~8 周内恢复运动能力[14-15],且在基因组水平上与人类高度相似(78%),常作为研究SCI 修复的理想模型。因此,本研究利用斑马鱼SCI 模型,探讨SCI 后不同时间、不同脊髓节段中细胞因子和再生相关分子的表达水平变化,旨在阐明这两种神经损伤修复关键影响因子在斑马鱼SCI后不同时间发挥的作用。
1 材料与方法
1.1 动物、主要试剂与仪器
野生型成年斑马鱼购于上海佳誉水族馆,斑马鱼饲料购于上海吉荧生物公司,三卡因(MS-222,A5040)购于美国Sigma公司,RNA提取试剂EZgene™Tissue RNA Kit(R6311-02)购于美国 BIOMIGA 公司,反转录试剂PrimeScript™ RT Master Mix(Perfect Real Time,RR036A)和荧光定量PCR 试剂盒SYBR Premix Ex Taq™ II(RR820A)购于日本 TAKARA 公司,荧光定量PCR 仪(Light cycler 480 Ⅱ)购于美国Roche 公司,引物购于上海Invitrogen 公司,体视显微镜(SMZ-140)购于美国Motic公司,手术器械购于美国WPI公司。
1.2 实验动物饲养
4~6 月龄野生型斑马鱼,不限雌雄。饲养环境的水温为27~29 ℃,pH 为7.2~7.4;光照时间为早8点至晚10点;每天投喂饲料2次,每次投喂的饲料量为鱼体质量的1.5%~2.0%。动物实验过程的所有操作步骤均得到江南大学实验动物伦理委员会的批准。
1.3 SCI模型制备与实验分组
将斑马鱼放入0.033%的MS-222 中麻醉后取出,在体视显微镜下,于腮盖和背鳍的连线中点处剥离皮肤和肌肉、暴露脊椎,并用精细剪刀一次性切断脊髓,术后将斑马鱼放入含抗菌剂的水杯中单独饲养,此为脊髓损伤组(spinal cord injury group,SCI 组)。假手术组(sham-operated group,Sham 组)只剪开皮肤和肌肉以暴露脊椎,但未行脊髓切断[16]。将 56 条斑马鱼随机分为 SCI 组和 Sham 组,每组各28 条,分别在SCI 后的12 h、3 d 、11 d 和25 d进行取材(25 d 组 SCI 后死亡 2 条因此只剩 5 条,其余各时间点每组7 条);脊髓组织的取材分为3 段,每段各2 mm,脊髓中段是指损伤位点上下各1 mm的脊髓组织,脊髓上段和下段指沿着中段分别向头端和尾端方向各延伸2 mm的脊髓组织。
在损伤后12 h 和3 d,轴突再生和运动功能恢复尚未开始,设置两个时间点是为了探讨脊髓损伤后短期内炎性细胞因子的表达水平;在脊髓损伤后11 d 和25 d 已经开始轴突再生,并且运动功能开始恢复,我们在这两个时间点探究轴突再生期间炎性细胞因子的表达变化。
1.4 RT-qPCR 法检测斑马鱼脊髓组织中炎症细胞因子和再生相关分子mRNA的表达
将脊髓组织分别按照试剂盒Biomiga EZgene™Tissue RNA Kit,PrimeScript ™ RT Master Mix 和SYBR Premix Ex Taq™Ⅱ的操作说明依次进行总RNA 提取,反转录获得cDNA 以及RT-qPCR 反应。PCR 反应过程中检测的分子包括:肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),白介素10(inter‐leukin-10,IL-10),TBETA4和ANXA2A,采用 2-ΔΔCt法计算以上分子在不同组别中mRNA 表达水平。所涉及的引物序列见表1。

表1 RT-qPCR引物序列表
1.5 统计学方法
统计学分析采用SPSS22.0 统计软件。数据以()表示,对于Sham和SCI组的两组间比较,符合正态分布的数据采用t检验,不符合正态分布的数据采用Mann-WhitneyU检验。将P<0.05设定为显著性阈值。
2 结果
2.1 SCI 后不同时间点损伤位点(脊髓中段)细胞因子和再生相关分子的表达变化
损伤位点处的微环境与SCI 的修复密切相关。因此,我们首先观察了SCI 后不同时间点脊髓中段(包含损伤位点)的细胞因子和再生相关分子的表达水平变化。结果显示,在斑马鱼SCI 后3 d,与Sham 组相比,SCI 组脊髓中段的细胞因子TNF-α 和IL-10的表达水平分别降低了93.5%和90%,再生相关分子TBETA4和ANXA2A的表达水平分别升高了 2.39 倍和 1.87 倍;而在 SCI 后 12 h、11 d 和 25 d,脊髓中段的上述细胞因子和再生相关分子并无显著变化(图1、图2),表明SCI 后3 d 是炎症和再生相关的微环境发生显著变化的时间点。

图1 斑马鱼SCI后不同时间脊髓中段TNF-α和IL-10的表达水平
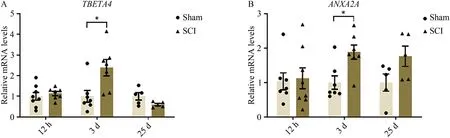
图2 斑马鱼SCI后不同时间脊髓中段TBETA4和ANXA2A的表达水平
2.2 SCI 后3 d 损伤位点及其上下游脊髓节段的细胞因子和再生相关分子的表达变化
基于上述结果,我们进一步探讨了SCI 后3d 细胞因子和再生相关分子的信号变化是否局限于损伤位点,检测并比较了损伤位点及其上、下游脊髓节段中细胞因子和再生相关分子的表达变化。结果显示,在 SCI 后 3 d,相比于 Sham 组,细胞因子TNF-α和IL-10仅在脊髓损伤位点所在的中段显著降低,分别降低了93.5%和90%,而在脊髓上段和下段均无显著差异,表明TNF-α 和IL-10炎症信号局限于损伤位点(图3);而再生相关分子TBETA4的表达水平在脊髓上段、中段和下段分别升高了1.9倍、2.39倍和3.69倍,ANXA2A的表达水平在脊髓上段、中段和下段分别升高了3.45 倍、1.87 倍和2.63 倍,提示TBETA4的信号在各脊髓节段有不同程度的升高(图4)。

图4 斑马鱼SCI后3 d各脊髓节段TBETA4和ANXA2A表达水平
3 讨论
本研究发现在SCI 后3 d,脊髓中段的细胞因子TNF-α 和IL-10的表达水平显著降低,再生相关分子TBETA4和ANXA2A的表达水平显著升高,而以上分子在 SCI 后 12 h、11 d 和 25 d 均无显著变化。进而在SCI后3 d这一重要时间节点,我们发现TNF-α和IL-10仅在损伤位点所在的脊髓中段发生改变,而在脊髓上段和下段均无显著差异;再生相关分子TBETA4和ANXA2A的表达水平在脊髓各段均显著升高。
在损伤后12 h 和3 d,轴突再生和运动功能恢复尚未开始[17],设置两个时间点是为了探讨脊髓损伤后短期内炎性细胞因子的表达水平;在脊髓损伤后11 d 和25 d 已经开始轴突再生,并且运动功能开始恢复[17],我们在这两个时间点探究轴突再生期间炎性细胞因子的表达变化。
TNF-α 是一种主要的炎性细胞因子,能促进炎症的发生。适当的TNF-α 信号也有促进再生的作用,而过度的炎症是阻碍再生的原因之一。研究发现,在斑马鱼幼鱼脊髓横断后,抑制TNF-α 的表达阻碍轴突再生[18];在小鼠和斑马鱼的脱髓鞘模型中,MyD88 表达缺陷引起TNF-α 信号降低,进而导致了少突胶质细胞减少和髓鞘修复受损[19]。本研究发现,成年斑马鱼SCI后,TNF-α的表达水平仅在SCI 后3 d 的脊髓中段降低,而其余检测时间点和脊髓节段均无显著差异。
IL-10是一种有广泛抗炎作用的细胞因子,多项研究表明其对SCI 修复起有益作用。在颈段SCI的小鼠模型中,IL-10的缺乏加重了损伤部位的血管病理,进而引起小鼠后肢功能BMS 评分降低[20];在SD大鼠的SCI模型中,髓内注射IL-10后,炎症减轻并促进了大鼠运动功能的恢复[5]。但在斑马鱼SCI 模型中,IL-10的表达水平对SCI 恢复的影响仍不清楚。在本研究中,我们发现在斑马鱼SCI 后,IL-10的表达水平仅在SCI后3 d的脊髓中段显著降低,而其他时间点和其他脊髓节段均未有显著差异,进一步提示了SCI 后3 d 损伤位点处微环境对SCI修复的重要意义。
多项研究发现TBETA4和ANXA2A与再生密切相关。在大鼠的SCI模型中,腹腔注射TBETA4提高了脊髓中存活的神经元数量和行为学评估结果[12]。另外,有研究表明在小鼠海马内灌注TBETA4的活性肽片段能提高海马的神经元再生[7]。ANXA2A参与细胞间通讯和细胞外基质生长,在成年斑马鱼尾鳍切断后,利用CRISPR/Cas9 技术敲除ANXA2A,可导致尾鳍组织在再生过程中生长迟缓[13]。我们的研究发现,在斑马鱼SCI后的急性修复期,脊髓的上段、中段和下段中TBETA4和ANXA2A的表达水平均显著升高,表明斑马鱼SCI 后的微环境可能有利于损伤后的再生修复。
大鼠SCI后腹腔注射TBETA4,降低了脊髓组织中促炎细胞因子TNF-α mRNA 的表达水平,升高了抗炎细胞因子IL-10 mRNA的表达水平[12]。另外,重组AAV 将TBETA4 导入小鼠结肠组织使AAV-Tβ4在小鼠结肠中表达,能够降低DSS 和TNBS 诱导的结肠炎小鼠结肠中 TNF-α、IL-1β 和 IL-10 的蛋白水平[21],这证实了TBETA4的抗炎作用。本研究中,在TBETA4 升高的时间点和损伤节段,TNF-α 呈现降低状态,这可能与TBETA4的抗炎效应有关,但仍需进一步验证。
综上所述,斑马鱼SCI后3 d是损伤位点处细胞因子和再生相关分子发生显著变化的时间节点,在该时间点,细胞因子(TNF-α、IL-10)的信号变化局限于损伤位点处,再生相关分子(TBETA4、ANXA2A)的信号在各脊髓节段均有不同程度的上调。本研究的结果有助于进一步了解细胞因子(TNF-α、IL-10)和再生相关分子(TBETA4、ANXA2A)在斑马鱼SCI后再生过程中的作用。
