脓毒症相关急性呼吸窘迫综合征的危险因素及预后分析
2022-04-15张书娟代晓明张永利
张书娟,王 勇,代晓明,张永利
脓毒症(sepsis)是宿主对感染的反应失调而出现危及生命的器官功能障碍[1]。脓毒症是重症患者最常见的疾病之一,对来自发达国家的27个研究进行的荟萃分析显示,脓毒症的发病率为437/10万,病死率为17%[2]。脓毒症导致的器官功能障碍比普通感染具有更复杂的病理生理状态。急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是因创伤、感染、休克等肺内和(或)肺外因素而引起的肺泡-毛细血管屏障损伤,导致肺泡-毛细血管通透性增加及富含蛋白的肺水肿,出现严重的低氧血症。ARDS是脓毒症患者的常见并发症,可导致脓毒症患者的病死率显著增加[3]。流行病学[4]研究显示,重症加强治疗病房(intensive care unit, ICU)内严重脓毒症及感染性休克合并ARDS的发病率高达54.8%,病死率为43.3%,远远超过未合并ARDS患者,ARDS是导致脓毒症患者死亡的危险因素。脓毒症引起ARDS机制复杂,目前无针对ARDS的特效治疗药物[5]。El-Haddad等[6]提出,ARDS的严重程度及引起ARDS的病因会影响ARDS的短期预后。近期美国胸科学会官方发布了脓毒症及ARDS精准医学研究议程,提出精准医学应与基因组学、生物学及环境因素相结合,对脓毒症及ARDS实施个体化治疗[7],因此有必要分析其危险因素,针对不同病因所致ARDS实施个体化治疗。本研究对大连医科大学附属第一医院ICU脓毒症患者的临床资料进行回顾性分析,旨在研究脓毒症相关ARDS的危险因素及预后,更利于临床早期识别高危患者及早期防治ARDS。
1 资料与方法
1.1病例资料 回顾性分析大连医科大学附属第一医院ICU 2019年10月至2021年1月肺内和(或)肺外因素所致脓毒症住院患者的临床资料,对于多次入住ICU的脓毒症患者,只收集首次符合条件的临床资料。所有脓毒症及脓毒症合并ARDS患者均经过抗感染、机械通气、肺复张及药物治疗等常规治疗,未给予其他干预性治疗。本研究获得大连医科大学附属第一医院伦理委员会的批准(批件号:PJ-KS-KY-2022-73)。
1.2诊断、纳入及排除标准 脓毒症患者符合2016年国际严重脓毒症及感染性休克诊疗指南中脓毒症的诊断标准[1],ARDS患者符合柏林诊断标准[8]。纳入年龄≥18岁并符合脓毒症诊断标准的患者。排除标准: ICU住院时间<24 h者;器质性心脏病导致的心力衰竭患者;慢性肺间质纤维化患者;恶性肿瘤终末期患者;病历资料不全者;放弃治疗者及孕妇。
1.3观察指标 既往史、基础疾病、生命体征、生化指标、血气分析、入ICU时急性生理学与慢性健康状况评估系统Ⅱ(APACHEⅡ)评分、序贯器官衰竭评分(SOFA),住ICU期间是否连续性肾脏替代治疗(CRRT)、是否机械通气、机械通气时间、是否休克、是否侵入性置管,住ICU时间、临床结局(生存或死亡)等。见表1。
1.4分组情况 根据脓毒症患者住ICU期间是否并发ARDS分为ARDS组和非ARDS组,并根据临床结局再将ARDS组分为生存组和死亡组两个亚组。

2 结果
2.1一般情况 符合入选标准、有完整病历资料的脓毒症患者共174例,其中男性119例(68.39%),女性55例(31.61%),年龄19~91岁。原发感染部位:呼吸道142例(81.61%),腹腔13例(7.47%),泌尿系3例(1.72%),皮肤软组织3例(1.72%),颅内7例(4.02%),其他部位6例(3.45%);2个或2个以上部位感染38例(21.84%)。ARDS组59例,非ARDS组115例,脓毒症患者ARDS的发生率为33.91%(59/174),其中轻度16例(27.12%)、中度30例(50.85%)、重度13例(22.03%);肺外原因引起的ARDS 14例(23.73%),肺内原因引起的ARDS 45例(76.27%)。ARDS组中机械通气患者54例(91.53%),非机械通气患者5例(8.47%)。
2.2脓毒症相关ARDS的危险因素
2.2.1 临床资料 ARDS组与非ARDS组之间性别、年龄、吸烟史、酗酒史、高血压病史、慢性心功能不全史、脑血管病史、冠心病病史、糖尿病史、慢性阻塞性肺疾病(COPD)病史、慢性肾脏病病史、体温(T)、心率(HR)、呼吸频率(RR)、血糖(Glu)、平均动脉压(MAP)、血白细胞计数(WBC)、血小板计数(PLT)、血红蛋白(Hb)、血肌酐(sCr)、天门冬氨酸氨基转移酶(AST)、谷氨酸氨基转移酶(ALT)、血清总胆红素(TBil)、胱抑素C(CysC)、凝血酶原时间(PT)、纤维蛋白原(Fib)、动脉血pH、钠离子(Na+)、钾离子(K+)、血乳酸(Lac)差异均无统计学意义(P>0.05),而入院时血清前白蛋白(PA)、白蛋白(ALB)、降钙素原(PCT),以及是否存在休克、是否机械通气、是否CRRT、是否侵入性置管、是否应用血管活性药物、APACHEⅡ评分、SOFA评分、住ICU时间、机械通气时间、28 d病死率及ICU内病死率差异均有统计学意义(P<0.05)。见表1。

表1 脓毒症相关ARDS组与非ARDS组临床特征比较
2.2.2 脓毒症患者是否发生ARDS的Logistic回归分析 表1中有统计学意义的ALB、机械通气、住ICU时间、机械通气时间、28 d病死率及ICU内病死率为ARDS引起的后果,故未纳入表2中进行统计,其他组间比较P<0.05的因素如休克、PA、CRRT、侵入性置管、PCT、血管活性药物、APACHEⅡ评分及SOFA评分可能是影响脓毒症发生ARDS的因素,对这些因素进行二元Logistic回归分析显示,血清PA(OR=0.998, 95%CI0.981~0.995,P=0.000)、APACHEⅡ评分(OR=1.121, 95%CI1.007~1.246,P=0.036)是脓毒症患者发生ARDS的危险因素。见表2。
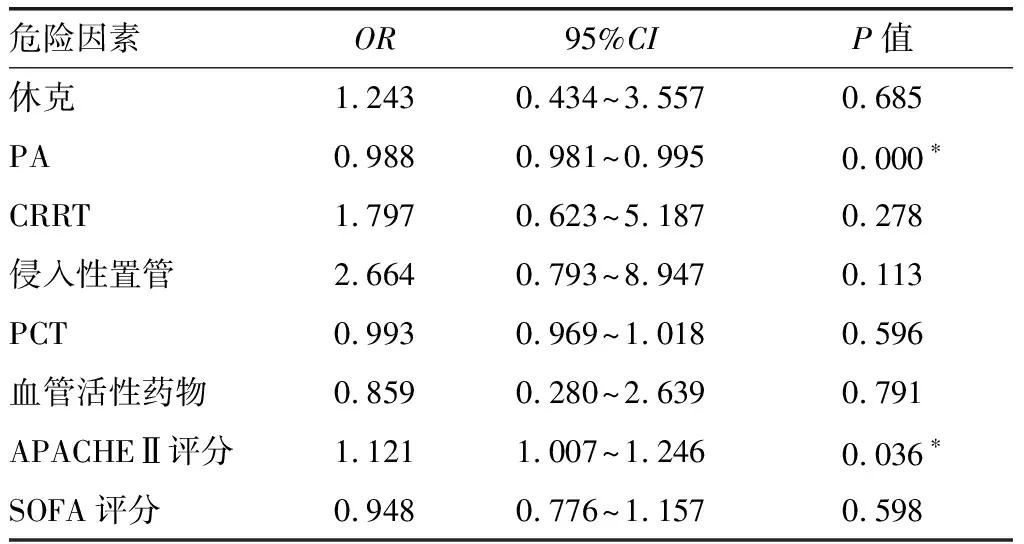
表2 脓毒症患者是否发生ARDS的Logistic回归分析
2.3ARDS患者与非ARDS患者预后情况 ARDS组患者机械通气时间及住ICU时间与非ARDS组患者比较差异均有统计学意义(P<0.05),见表1。ARDS患者与非ARDS患者ICU内病死率比较差异有统计学意义[50.85%(30/59)比19.13%(22/115),χ2=18.721,P=0.000]。ARDS组28 d病死率也明显高于非ARDS组[30.51%(18/59)比16.52%(19/115),χ2=4.556,P=0.033]。生存分析Log-rank检验结果显示,ARDS组28 d生存者明显少于非ARDS组(χ2=4.250,P=0.039),见图1。
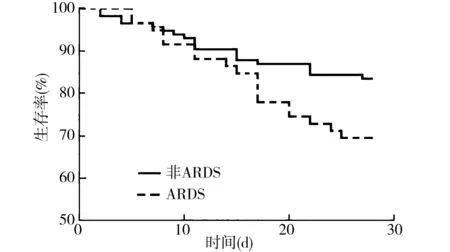
图1 脓毒症患者ARDS组非ARDS组28 d生存曲线
2.4脓毒症相关ARDS患者预后的相关因素分析 ARDS生存组及ARDS死亡组血清PA、ALB、Glu、血Lac差异有统计学意义(P<0.01),年龄、HR、PT、氧合指数(PaO2/FiO2)、是否侵入性置管、SOFA评分、APACHEⅡ评分在生存组与死亡组间比较差异有统计学意义(P<0.05),见表3。对表3中具有统计学意义的指标进行二元Logistic回归分析结果显示,血清PA(OR=0.960,95%CI0.929~0.991,P=0.000)、ALB(OR=0.800,95%CI0.620~1.033,P=0.029)及血Lac(OR=1.522,95%CI0.577~4.016,P=0.002)、SOFA评分(OR=1.315,95%CI0.860~2.010,P=0.022)、APACHEⅡ评分(OR=1.077,95%CI0.871~1.331,P=0.027)是ARDS患者死亡的危险因素。见表4。

表3 脓毒症相关ARDS生存组与死亡组临床特征比较

表4 影响脓毒症相关ARDS预后的Logistic回归分析
3 讨论
Auriemma等[9]研究表明,ICU内脓毒症患者并发ARDS后病死率明显升高。而本研究表明,脓毒症并发ARDS患者的发病率为33.91%、ARDS病死率为50.85%,本研究中ARDS患者以中重度为主,具有较高的病死率。进一步采用Kaplan-Meier生存曲线分析显示,ARDS组和非ARDS组28 d生存率差异有统计学意义(P<0.05)。本研究结果显示,脓毒症患者并发ARDS时预后差。
本研究对脓毒症患者并发ARDS的Logistic回归分析显示,低血清PA及较高的APACHEⅡ评分是脓毒症并发ARDS的危险因素;对已发生ARDS的脓毒症患者预后分析显示,低血清PA、ALB,以及高血Lac、SOFA评分、APACHEⅡ评分是影响患者预后的独立危险因素。
血清PA是由肝脏合成,半衰期约1.9 d,血清PA是评估和监测营养状态最快捷、有效的指标之一,蛋白质摄入不足时会下降,并且与患者预后紧密相关[10-11]。有研究[12-13]显示,PA是一种负急性时相反应蛋白,急性或慢性炎症反应时显著下降,对病情的诊断及监测有一定价值。脓毒症时血清PA降低可能与PA的分解加速,肝脏功能障碍及营养底物不足,合成减少有关。而在本研究中,脓毒症相关ARDS死亡组患者血清PA水平低于存活组(P<0.01),Logistic回归分析,OR值0.960,呈负相关,说明血清PA水平越低的患者病死率越高。总之,血清PA低的脓毒症患者提示炎症反应重、有并发ARDS的风险及可能预后差,在积极控制感染的同时注意营养的补充,降低脓毒症并发ARDS的风险,从而改善脓毒症患者的预后。
ALB是分子量为64 kDa的蛋白质,具有重要生理功能。ALB在结合和运输内外源性物质、维持酸碱平衡、维持血液胶体渗透压、清除自由基及维护血管壁完整性等方面发挥重要作用[14]。在严重的感染、创伤后,血中ALB水平会迅速下降,在脓毒症患者中血清ALB做为一种炎症标志物,可反映疾病的严重程度及预测患者的预后,血清ALB水平越低,脓毒症患者预后越差[15]。脓毒症是ARDS最重要的诱发因素之一,是失控的炎症反应导致的肺损伤。研究[16-17]发现,ALB水平与肺血管通透性呈负相关,脓毒症时血管内皮细胞功能障碍,内皮细胞间隙加大,血管通透性增加,血液中的白蛋白可渗漏到组织间隙中出现毛细血管渗漏综合征,血浆白蛋白降低,组织水肿,造成多器官功能障碍,在肺部表现为ARDS,病理特点是血管外肺水增加,氧交换障碍。本研究没有将变量ALB水平、机械通气纳入逻辑回归模型,因为这些潜在的风险因子可能是由 ARDS 本身引起的。本研究中ALB是影响ARDS的预后因素,且呈负相关,也有研究[18]显示,ALB可以预测、监控ARDS病程及评估ARDS的严重程度。
APACHEⅡ评分系统通过急性生理学评分、年龄评分及慢性健康评分来评估患者的病情严重程度及预后[19]。SOFA评分对呼吸、血液、肝脏、心血管、中枢神经及肾脏功能进行赋分,评估多器官功能障碍的发生及发展程度。有研究[20]显示,对于ICU患者预后的评估,APACHEⅡ评分比SOFA评分敏感性更好。本研究中APACHEⅡ评分是脓毒症患者发生ARDS的危险因素;在脓毒症相关ARDS患者中,死亡组APACHEⅡ评分及SOFA评分高于生存组,这与以前的研究[21-22]报道一致,且Logistic回归分析差异也有统计学意义(P<0.05),提示APACHEⅡ和SOFA评分是评估患者病情及预后的参考指标。
以往的文献[23]报道,PCT水平与脓毒症的严重程度相关。表2是对表1中差异有统计学意义的参数进一步筛查探索意义更大的因素,脓毒症患者是否发生ARDS的二元Logistic回归分析显示,与PCT无相关性,可能与纳入病例中脓毒症大部分为肺部感染所致有关,故ARDS组与非ARDS组均具有较高的PCT值,其他学者[24]的研究也有类似报道。
脓毒症患者的休克大部分是感染性休克与其他类型休克如低血容量休克或心源性休克等同时存在,短时间内经过补液或强心等治疗后休克有所改善,所以在本研究中虽然组间比较有统计学意义,但进一步二元Logistic回归分析显示,休克、血管活性药物差异无统计学意义(P>0.05)。在ICU中,CRRT应用的指征一方面是肾脏替代治疗,另外也用来清除炎症介质,故二元Logistic回归分析显示,CRRT的应用与是否发生ARDS也无统计学意义(P>0.05)。
本研究中,PaO2/FiO2是影响脓毒症相关ARDS患者预后的因素,经二元Logistic回归分析显示, PaO2/FiO2无统计学意义(P>0.05),分析PaO2/FiO2是患者入ICU时这个时间点的统计,不是患者在ICU住院期间整个病程的统计,脓毒症相关ARDS患者预后与引起ARDS的原发病是否及时控制密切相关,若统计ARDS患者整个病程期间的PaO2/FiO2可能会得到不一样的结果。
本研究的不足之处如下:①本研究为回顾性研究,纳入的病例数偏少,有待进一步更大样本、多中心、更严谨的前瞻性研究证实;②入住ICU患者由于感染的病原菌不同,对脓毒症ARDS患者可能存在影响,但由于本研究样本量小,且患者大部分是多种病原菌感染,无法加以区别统计,可扩大样本量或者进行多中心这方面的研究;③输入红细胞和胶体溶液对ARDS患者预后的影响未分析;④体重指数(BMI)可能对ARDS预后有影响,本研究未将BMI纳入进行分析。
综上所述,本研究对脓毒症相关ARDS的危险因素进行分析,为临床上脓毒症并发ARDS的预警及病情评估提供理论指导。如果进一步大样本、前瞻性研究及对肺内外源性ARDS等因素进行分层研究,将会得到更有力的证据。
