石墨炉原子吸收光谱法直接测定细胞中镉的研究
2022-04-13陈明丽王建华
杨 萌, 魏 星, 张 璇, 姜 泽, 陈明丽*, 王建华
(东北大学理学院化学系,辽宁沈阳 110819)
镉是一种用途较为广泛的金属,属于人体非必需元素。人体内的镉主要从外界环境中摄取,且一旦进入体内就难以代谢排出,对镉污染地区的人类与动物的健康造成了很大的威胁[1]。镉主要通过呼吸和食物链等多种方式进入人体[2],长期处于镉污染的环境中,人体会出现不同的病理反应。长期接触镉的人群中可出现急性胃肠道和呼吸道等疾病[3]。很多镉中毒引起的病理反应被相继报道,这引起许多学者研究镉的毒性机理[4]。研究结果表明:镉经消化道和呼吸道进入人体后,会对人体的器官造成不同程度的损伤。镉不仅可以影响人体的消化道,改变消化道的菌群数量并损害它们正常的代谢活动;镉附着于肠壁可能造成炎症反应,对肠道细胞造成一定的损伤[5]。镉诱导人体患癌的原因有很多,例如相关基因突变、免疫细胞的DNA损伤,以及免疫功能的改变是造成癌症最直接的原因。此外,氧化应激反应、激素水平失衡等都与镉诱导癌症的发生发展有一定的关联[6,7]。
细胞具有复杂的基质,包括高含量的有机化合物,例如蛋白质和脂质等。通常,对于血液等生物样品中痕量元素的检测,需要将样品用有氧化特性的浓酸进行消解。但处理过程繁琐、耗时耗力,还可能导致分析物损失或引入其他污染物[8,10]。文献报道[11]生物样品中金属含量测定的前处理方法包括湿法消解和微波消解。石墨炉原子吸收光谱法在痕量金属元素定量检测方面具有突出的优势[12,13]。本文提出了石墨炉原子吸收光谱法直接测定细胞中重金属镉的方法,且测定时细胞(包括血细胞)不用再进行其他的样品预处理,可直接进行测定。方法所需样品量较少,几百个细胞即可以满足测定需要。本方法还可以用于人全血血细胞中镉的直接测定,与已报道的石墨炉原子吸收光谱法检测全血中重金属的方法[14]相比,本方法所需要样品量少,几微升血液就可以满足测定要求。本研究为人体血液中镉元素的直接检测提供了方法保障和基础数据,为儿童重金属中毒和急性镉中毒人群的血液测定提供了可能性。
1 实验部分
1.1 主要仪器及试剂
GGX-200原子吸收光谱仪(北京海光仪器公司);HIRAYAMA HV-50自动高压灭菌器(日本,Hirayama);SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司);TGL-16G台式高速离心机(上海安亭科学仪器厂);单盘电子天平(北京赛多利斯仪器有限公司);37 ℃恒温CO2培养箱(美国,Thermo Electron公司)。
DMEM高糖培养基(美国Hyclone公司);链霉素(Streptomycin,美国Invitrogen公司);青霉素(Penicillin,美国Invitrogen公司);胰酶(Amresco,美国Hyclone公司);胎牛血清(FBS,美国Hyclone公司);NaCl、KCl、Na2HPO4·12H2O(国药集团化学试剂有限公司);NH4NO3(沈阳新西试剂厂);(NH4)H2PO4、Mg(NO3)2(天津博迪化工中)。所有试剂除特别说明外皆为分析纯,实验用水为去离子水(18 MΩ·cm)。实验器皿均使用5%HNO3浸泡过夜后,用去离子水清洗干净。
1.2 实验所用溶液的配制
镉储备溶液(1 g/L):取0.1000 g镉粒(高纯)用12.5 mL 8 mol/L的HNO3溶解,用1%的HNO3定容至100 mL。镉标准工作溶液由储备溶液逐级稀释得到。含FBS的DMEM高糖培养基:将5 mL的双抗与50 mL的FBS加入到500 mL DMEM高糖培养基中,缓慢摇匀。采用相同方法配制不含FBS的DMEM高糖培养基。在无菌超洁净台内,用无菌滤膜(0.22 μm)过滤除去培养基内细菌和不溶性杂质,放置4 ℃冰箱内保存,待用。含镉培养基:用过滤后的无FBS培养基将镉溶液逐级稀释到使用浓度,放置4 ℃冰箱保存,待用。
1.3 细胞的培养与孵育
本文选用HepG2(人肝癌细胞)细胞。细胞株培养于含10%FBS的DMEM培养液中,且在37 ℃、5%CO2的恒温培养箱培养。在培养过程中,每隔24 h左右需更换培养基,待细胞数密度涨至80%~90%时,用胰酶进行消化,离心清洗后,进行传代培养,取对数生长期细胞进行实验。
取两瓶对数生长期的细胞,用磷酸盐缓冲溶液(PBS)彻底清洗。其中,一瓶加入含镉(2 mg/L)的无FBS培养基,另一瓶加入FBS培养基作为对照组,孵育6 h后,经胰酶消化,离心清洗,最后加入1 mL的PBS,并用血细胞计数板进行计数,将计数后的细胞离心,移去PBS以备使用。
1.4 原子吸收光谱直接测定细胞中的镉
将计数的细胞逐级稀释后,将稀释的细胞与2 μL的Mg(NO3)2基体改进剂同时加入石墨炉内,在灰化温度为350 ℃和原子化温度为1 900 ℃的条件下,用石墨炉原子吸收光谱直接测定细胞中镉的含量。测定条件:用氘背景校正的GGX-200原子吸收光谱仪进行检测,镉空心阴极灯(中国有色金属研究院)作为光源(波长228.8 nm),工作电流为5 mA,狭缝宽度为0.4 nm。峰面积(吸光度积分)值用于定量。石墨炉原子吸收光谱测定的温度程序列表1中。

表1 石墨炉原子吸收光谱的温度程序
2 结果与讨论
2.1 肝癌细胞数量的确定
细胞中基体十分复杂,特别是有机物质,在用石墨炉原子吸收光谱测定时会对镉产生很大信号干扰,而选择合适细胞数可降低背景吸收。实验选取用两组细胞数密度为80%左右的细胞(一组经镉孵育培养的细胞,一组为正常培养的细胞作为对照),PBS清洗后进行后续条件考察。细胞孵育6 h后,用胰酶进行消化,再用PBS进行3次离心清洗,然后加入1 mL的PBS,用细胞计数板进行计数,离心去掉PBS。将计数过的细胞用去离子水逐级稀释至一定浓度。用移液枪吸取10 μL细胞溶液时,吸取的细胞数量分别为200、400、800、1 600、4 000个左右。将对照组和孵育组细胞分别用石墨炉原子吸收光谱直接测定,考察其基体条件的影响,结果如图1所示。可以看出随着细胞数的增多,细胞基本信号的吸光度越大,在进样为200个和400个细胞的情况下,未经镉孵育的细胞基体空白接近纯水,细胞个数为800、1 600和4 000时,细胞基体对检测的影响较大。因此,实验中采用的进样数为400个细胞。
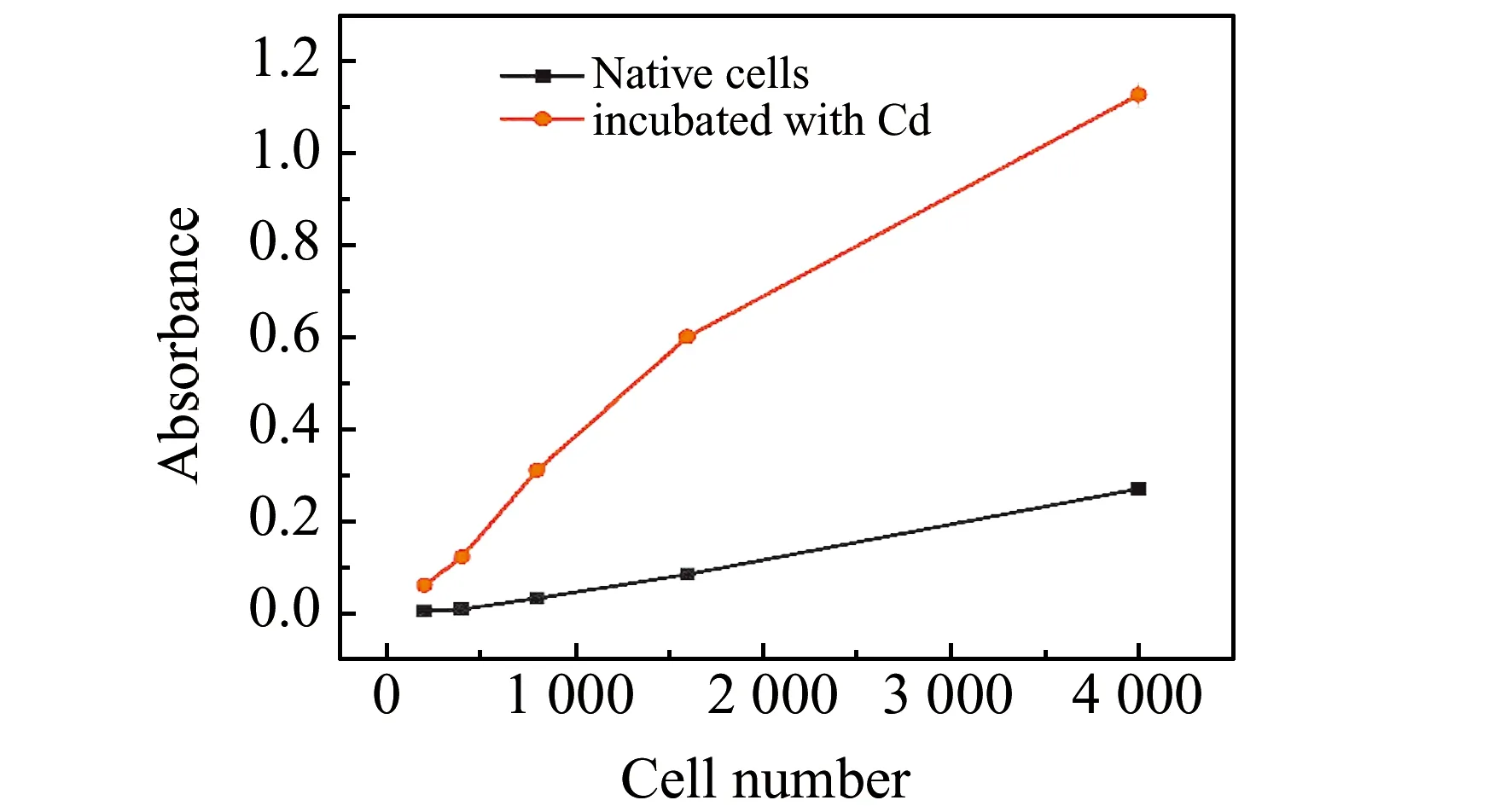
图1 细胞个数对镉测定的影响
2.2 基体改进剂及用量的选择
原子吸收测定复杂样品时,加入基体改进剂可以提高灰化温度,减少基体干扰,避免待测元素在原子化阶段损失。细胞因其具有复杂的成分,因此采用合适的基体改进剂,以消除复杂基体成分的干扰。考察了进样量为2 μL时,质量浓度为0.06%的Mg(NO3)2、1.0%的NH4NO3、1.0%的(NH4)H2PO4等基体改进剂对检测结果的影响。含镉细胞(2 mg/L隔孵育)和空白细胞按最佳状况培养,取10 μL细胞进样(含有约400个细胞),2 μL的基体改进剂,测得的不同基体改进剂与对细胞中镉的测定的影响结果,如图2所示。从图中可知,在一定条件下,适当的基体改进剂确实会改善测定细胞中镉的效果。Mg(NO3)2作为基体改进剂时,测定的吸光度信号较大,且原子吸收峰完整。故后续实验选择Mg(NO3)2作为基体改进剂。

图2 基体改性剂对镉测定的影响
在确定的细胞数与基体改进剂的情况下,对基体改进剂的用量进行了考察。实验结果表明,0.06%的Mg(NO3)2溶液从1 μL增加到2 μL的过程中,吸光度随基体改进剂体积的增加而逐渐增加,但继续增加基体改进剂体积,吸光度信号会随用量增加而逐渐降低,结果如图3所示。从图中可以看出,当0.06%的Mg(NO3)2溶液用量为2 μL时,吸光度最大。

图3 基体改进剂用量对镉测定的影响
2.3 原子化与灰化温度的选择
在进样量大约400个细胞,2 μL 0.06%的Mg(NO3)2溶液作为基体改进剂的条件下,逐渐改变原子化或灰化温度,以得到最佳的原子吸收测定条件。如图4所示,灰化温度为350 ℃、原子化温度为1 900 ℃时,吸光度最大,是最佳的原子吸收检测条件。

图4 灰化温度(a)和原子化温度(b)对镉测定的影响(进样量10 μL,2 mg/L Cd孵育的细胞约400个)
2.4 工作曲线与检出限
在最佳实验条件下,将镉标准溶液逐级稀释成质量浓度为1、2、3、4、5 μg/L的系列标准溶液,分别进样测定,并用HepG2细胞和2 μL 0.06%的Mg(NO3)2基体改进剂匹配,绘制标准曲线(图5)。对空白样品(含有大约400个细胞和2 μL 0.05%的Mg(NO3)2)进行连续9次测定,其相对标准偏差(RSD)为0.06%。用3倍空白的标准偏差计算得到方法的检出限为1.8 ng/L,方法线性范围为1.0~5.0 μg/L。

图5 细胞中镉测定的标准曲线
2.5 原子吸收光谱法直接测HepG2中的镉含量
为了验证该方法在测定细胞中痕量镉的适用性,将细胞分别与1 mg/L和2 mg/L的镉孵育6 h,在最佳实验条件下,将细胞稀释到要求浓度,对孵育后的细胞直接检测,测定结果如表2所示。从表中可以看出,经与1 mg/L镉孵育后,细胞中可以明显检出镉,大约400个细胞中镉的质量浓度为1.947±0.086 μg/L;经2 mg/L镉孵育的细胞中,镉的质量浓度为4.071±0.044 μg/L,多次测定的RSD低于6.0%,加标回收率在90%~105%之间。

表2 HepG2细胞中镉的检测结果
为了进一步验证该方法的准确性,平行取两组细胞分别直接测定和消解后测定。用含500 μg/L镉的无FBS培养基孵育培养细胞6 h,将培养后的细胞,经过胰酶消化、PBS 3次离心清洗,加入1 mL的PBS,通过血球计数板计数得大约为6.0×106(n=3),将计数后的细胞一半湿法消解后,用石墨炉原子吸收光谱检测;另一半直接进样进行石墨炉原子吸收光谱检测。用本方法直接测得的细胞中镉的总含量约为56.4±1.2 ng(400个细胞,0.7514±0.0373 μg/L),湿法消解测得细胞中镉的总含量为58.8±1.8 ng,经检验两组数据没有显著差异。
2.6 原子吸收光谱法直接测人全血中的镉的含量
用无镉的人全血样品作为基体匹配,对实验条件进行了优化,在最佳条件下对人全血细胞中痕量的镉进行了测定。取全血10 μL,加入1 mL PBS混匀并离心(3 000 r/min离心10 min,3次)。去掉上清溶液,留取血细胞,经PBS适当稀释后作为细胞空白基体。镉孵育的人全血红细胞用同样方式处理。当进样量为10 μL(约为4 000个血细胞)时,加入3 μL基体改进剂,镉的线性检测范围为1.4~5.0 μg/L,对4 μg/L的镉标准溶液与空白溶液(标准溶液包含约为40 000个血细胞与3 μL NH4NO3基体改进剂)连续测定9次得到两者的RSD分别为0.39%和0.30%,均小于2.0%,方法的检出限为0.14 μg/L。随后,对不同浓度镉孵育的人全血细胞中的镉进行了测定,并对样品进行了加标回收实验,回收率在90%~107%之间,结果如表3所示。结果表明,该方法可以用于人血液细胞样品中痕量镉的直接测定,取少量全血即可满足测定要求,能有效减免患者痛苦,尤其是对婴幼儿重金属检测提供可靠方法,有可能在临床血液重金属检测中得到应用。
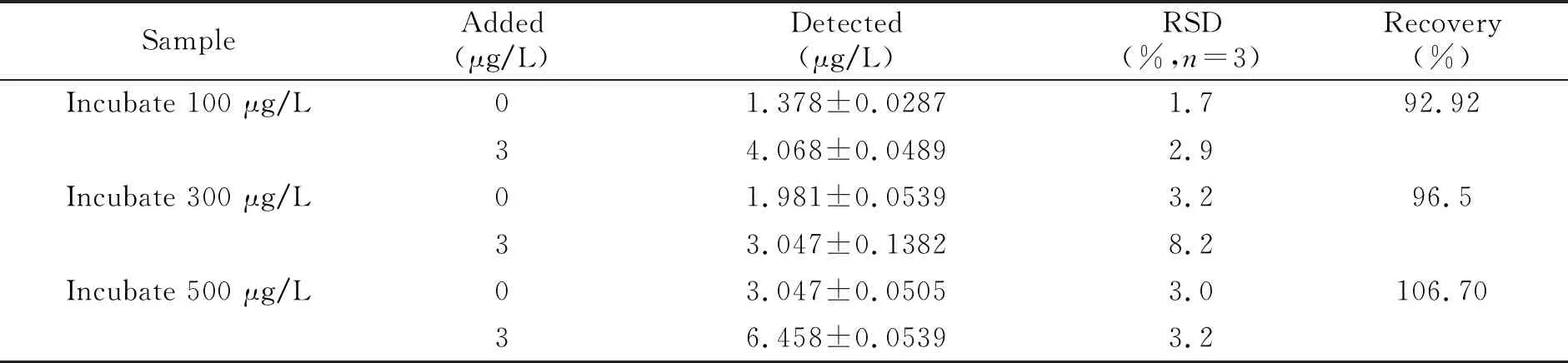
表3 人血细胞中镉的检测结果
3 结论
建立了石墨炉原子吸收光谱直接测定细胞中镉含量的方法。该方法对细胞中镉含量测定的检出限(3σ)为1.8 ng/L,相对标准偏差为0.06%(n=9)。探讨了石墨炉原子吸收光谱法直接测定人全血细胞中镉的方法,只需几微升全血样品,不必静脉抽取,对人体伤害小,能有效减免患者痛苦,尤其是对婴幼儿重金属检测提供可参考方案,有望在临床血液重金属检测中得到应用。
