基于磁性功能复合材料的新型比色法检测Cu2+
2022-04-13刘冰倩李君荭苏丽霞
张 涛, 刘冰倩*, 李君荭, 吴 念, 苏丽霞
(贵州省合成药物工程实验室,贵州大学药学院,贵州贵阳 550025)
Cu是人体必需的微量元素,也是多种酶,如细胞色素氧化酶、硝酸还原酶和超氧化物歧化酶的辅基和结构成分[1]。但Cu2+在人类和动物肝脏中积累会产生一定的毒性,导致DNA损伤[2],从而引发严重疾病,如:神经退行性疾病、肝炎、肺炎、皮肤疾病等[3]。世界卫生组织(WHO)、美国环境保护署(EPA)以及中国卫生部规定饮用水中Cu2+的最大允许量分别为2 mg/L[4]、20 μmol/L[5]和1 mg/L[6]。目前,检测Cu2+的方法主要有溶出伏安法[7]、原子吸收光谱法[8]、电化学方法[9]、光电化学方法[10]和荧光分析法[11]等。上述方法有较好的选择性和较高的灵敏度,但仪器昂贵、预处理复杂、检测成本高。因此,亟待开发一种快速、灵敏且操作简单,并能进行实时高通量筛选的检测方法。
比色传感技术可以通过肉眼辨别颜色变化,由于其简单、低廉且无需高昂设备,已被广泛应用于临床及环境检测中[12,13]。比色检测法常用氧化显色剂4,3,3,5,5-四甲基联苯胺(TMB)体系,利用过氧化物酶催化TMB-H2O2体系生成有色产物[14]。基于纳米材料的模拟酶即纳米酶,由于其较天然酶相比具有成本低、合成容易、在极端环境下稳定性好、易于调制等独特优势,已被广泛应用于多个研究领域,如污染物去除、干细胞生长、神经保护、癌症治疗和传感器/生物传感器应用[15 - 21]。近年来,MnO2因其低成本、高活性/稳定性、无毒性和丰富的可用性而受到人们的广泛关注[22 - 24]。2012年,Zhang等发现MnO2纳米材料具有类似氧化酶的活性[25,26]。聚苯胺(PANI)因为具有导电性、化学和热稳定性、无毒和容易获得等优良性能,从而引起了人们广泛的研究兴趣[27]。Au和PANI可以包覆在磁珠表面,以负载更多的MnO2,目的在于放大信号。
本研究旨在开发了一种磁性功能化磁珠/金/聚苯胺/MnO2复合材料(MB/Au/PANI/MnO2),在不需要额外的氧化剂的情况下就可以直接氧化TMB显蓝色。在半胱氨酸(L-Cys)的作用下,该磁性复合材料无法实现其氧化性能。但当Cu2+存在时,L-Cys与Cu2+相互作用生成硫醇盐,从而恢复磁性复合材料直接氧化TMB显色,可间接检测Cu2+的浓度。该复合材料的使用较大程度上减少了反应所需的材料用量,如Yang等[26]所用的MnO2的体积为180 μL,而本方法中只需10 μL。发展的方法提高了反应的灵敏度和稳定性,对Cu2+有较好的选择性,且具有便捷,操作简单,抗干扰能力强的优点,可以实现实际样品实时高通量筛选。
1 实验部分
1.1 仪器与试剂
ΜV-5500PC紫外-可见分光光度计(上海元析仪器有限公司);ST3100 pH计(奥豪斯仪器有限公司);BSA224电子天平(赛利多斯科学仪器有限公司)。
FeCl3(分析纯,国药集团有限公司);聚乙烯吡咯烷酮K-30(PVP)(分析纯,上海强顺公司);(NH4)2S2O8(分析纯,天津科密欧公司);聚苯胺(PANI)(分析纯,成都金山公司);HAuCl4(凯马生化有限公司)。其它试剂均为国产分析纯;实验用水为去离子水。
1.2 实验方法
1.2.1 MB/Au/PANI/MnO2的合成Fe3O4磁珠(MB)合成方法参照本课题组以往研究[27]。取1 mL MB加入PVP溶液中(0.1 g PVP+10 mL去离子水),孵育1 h;再加入2 mL 1%HAuCl4溶液,超声5 min;随后加入0.3 mL苯胺和10 mL 1 mol/L HCl(1 mol/L)的混合液,同时加入0.18 g (NH4)2S2O8,在室温条件下反应2 h。最后用乙醇清洗2次进行磁性分离,得到的产物在60 ℃的条件下烘干,称量备用。
取5 mg上述制品分散于5 mL去离子水中,超声均匀,加入5 mg KMnO4,室温条件下振荡反应1 h,用去离子水洗涤2次后进行磁性分离,即得磁性复合材料MB/Au/PANI/MnO2。
1.2.2 比色法检测Cu2+室温下,在520 μL的NaAc-HAc缓冲溶液(pH=4)中加入100 μL不同浓度Cu2+,90 μL 400 μmol/L L-Cys和10 μL MB/Au/PANI/MnO2,反应10 min后,加入100 μL 6 mmol/L TMB,混匀后立即检测其200~800 nm波长之间的吸光度值。所有相关测试均在室温下进行,且所有实验结果均为3次实验结果的平均值。
2 结果与讨论
2.1 检测原理
本实验采用比色法,以TMB溶液为显色体系,MB/Au/PANI/MnO2为直接氧化材料,在L-Cys介导下实现对Cu2+的快速检测。如图1所示,MB/Au/PANI/MnO2可以直接氧化TMB生成蓝色阳离子自由基(oxTMB),而L-Cys可有效抑制oxTMB的生成,抑制TMB被氧化显色。但L-Cys与Cu2+可形成不溶性的硫醇盐,即R-S -M′、R-S -M″-S -R(M′、M″为1价、2价金属离子)。在Cu2+存在时,L-Cys与Cu2+反应,导致TMB反应体系中L-Cys减少,使MB/Au/PANI/MnO2材料氧化的oxTMB离子增多,反应体系发生从浅到深的颜色变化。在652 nm的波长下,反应体系的吸光度值随着Cu2+浓度的增加而逐渐增大,且呈线性变化。

图1 基于磁性功能复合材料的比色法检测Cu2+的示意图
2.2 MB/Au/PANI/MnO2的表征
MB/Au/PANI/MnO2复合材料的合成是本实验方案顺利进行的先决条件。如图2A和2B所示,合成的MB/Au/PANI/MnO2复合材料为类球形,分散较好。我们进一步利用紫外-可见吸收光谱(图2C)和红外光谱(图2D)对材料进行表征。由图2C中可见,MB无明显的吸收峰[27],合成的MB/Au/PANI在350 nm、700 nm处有明显的PANI的吸收峰[28]。如图2D,MB/Au/PANI在804 cm-1、1 310 cm-1、1 480 cm-1和1 580 cm-1处有PANI的特征峰[29],而MB/Au/PANI/MnO2在578 cm-1、1 126 cm-1、1 636 cm-1和3 415 cm-1处有MnO2的特征峰,这与文献报道[30]一致。实验结果证明,MB/Au/PANI/MnO2复合材料成功合成。

图2 (A)MB/Au/PANI/MnO2扫描电镜图(2 μm);(B)MB/Au/PANI/MnO2扫描电镜图(500 nm);(C)不同样品的紫外-可见吸收光谱图;(D)不同样品的傅里叶红外光谱图
2.3 可行性分析
如图3A所示,MB/Au/PANI/MnO2和TMB无明显特征吸收峰。其中,TMB与H2O2无催化显色反应(652 nm波长处无特征吸收峰),且MB/Au/PANI/MnO2与H2O2亦无催化显色反应。由图3B可见,MB/Au/PANI/MnO2与TMB和H2O2反应后,在652 nm波长处有明显特征吸收峰,但较MB/Au/PANI/MnO2与TMB的反应特征吸收峰小。结果表明MB/Au/PANI/MnO2复合纳米材料可单独直接氧化TMB显色。为进一步证明MB/Au/PANI/MnO2复合材料的不可替代性,我们将MB、MB/Au和MB/Au/PANI这3种材料分别与TMB反应。如图3C所示,MB和MB/Au/PANI都无法氧化TMB显色,而MB/Au能催化TMB显色。表明MB/Au亦能直接氧化TMB显色,但较MB/Au/PANI/MnO2的氧化性能弱。
复合材料合成过程中用到Mn2+,但Mn2+无法直接氧化TMB显色。由图3D可见,当L-Cys单独存在时,MB/Au/PANI/MnO2氧化性能明显减弱。而Cu2+(100 nmol/L)和L-Cys同时存在,MB/Au/PANI/MnO2催化性能恢复。如果增加Cu2+浓度到1 mmol/L,在652 nm波长处的吸光度值明显较低浓度Cu2+(100 nmol/L)时增大。结果说明本方案可用于Cu2+的检测。
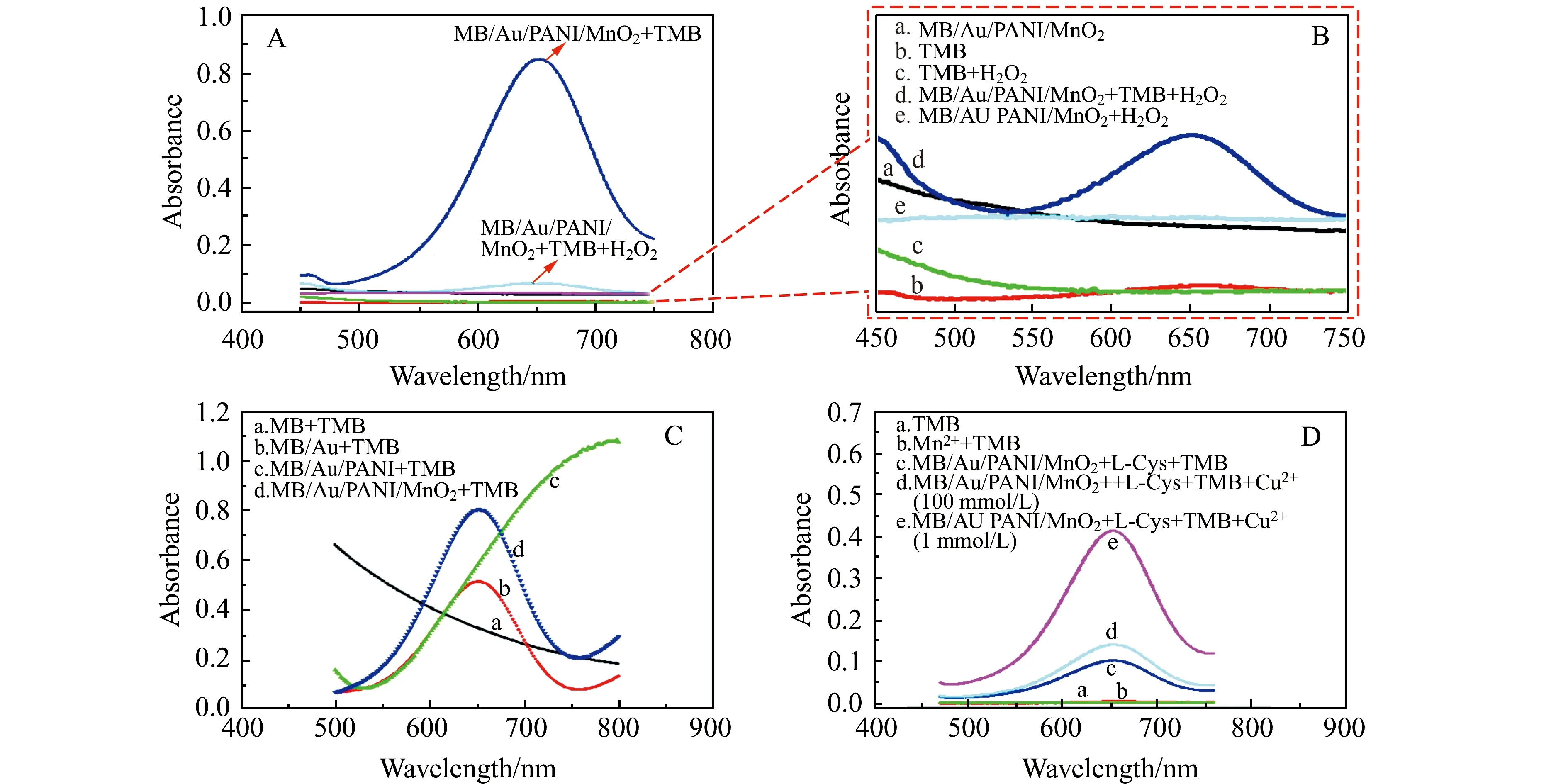
图3 (A)MB/Au/PANI/MnO2+TMB+H2O2、MB/Au/PANI/MnO2+TMB紫外-可见吸收光谱图;(B)MB/Au/PANI/MnO2、TMB、TMB+H2O2、MB/Au/PANI/MnO2+TMB+H2O2、MB/Au/PANI/MnO2+H2O2紫外-可见吸收光谱图;(C)MB+TMB、MB/Au+TMB、MB/PANI/Au+TMB、MB/Au/PANI/MnO2+TMB紫外-可见吸收光谱图;(D)TMB、Mn2++TMB、MB/Au/PANI/MnO2+L-Cys+TMB、MB/Au/PANI/MnO2+L-Cys+TMB+100 nmol/L Cu2+、MB/Au/PANI/MnO2+L-Cys+TMB+1 mmol/L Cu2+紫外-可见吸收光谱图
2.4 实验条件的优化
2.4.1 NaAc-HAc缓冲溶液pH值缓冲液pH值可影响反应体系吸光度值的大小,因此考察了不同pH值(pH=2、3、4、5、6、7)缓冲液对吸光度的影响,如图4(A)所示,当缓冲液pH为5时体系吸光度值最大。
2.4.2 MB/Au/PANI/MnO2与TMB反应时间MB/Au/PANI/MnO2与TMB反应显色时间长短会影响吸光度值大小。如图4A,MB/Au/PANI/MnO2与TMB反应2 min后吸光度值不再明显增加,趋于平稳。因此,本实验选用2 min为MB/Au/PANI/MnO2与TMB最佳反应时间。
2.4.3 MB/Au/PANI/MnO2与L-Cys反应时间MB/Au/PANI/MnO2与L-Cys反应使得复合材料氧化显色性能减弱,充足的反应时间保障检测条件的同一性。如图4B所示,MB/Au/PANI/MnO2与L-Cys反应20 min后吸光度值(652 nm)趋向平稳。因此,选用20 min为MB/Au/PANI/MnO2与L-Cys的反应时间。
2.4.4 Cu2+与L-Cys反应时间Cu2+与L-Cys反应生成不溶性硫醇盐,从而释放复合材料的氧化显色性能。如图4B,L-Cys与Cu2+反应10 min时吸光度值最高。因此本实验选择10 min作为Cu2+与L-Cys最优反应时间。
2.4.5 MB/Au/PANI/MnO2和L-Cys反应用量基于本实验,MB/Au/PANI/MnO2直接氧化显色响应值达到较高水平,而L-Cys与MB/Au/PANI/MnO2反应后使得响应值回到较低水平,这有利于目标物检测。如图4C、4D所示,10 μL MB/Au/PANI/MnO2的吸光度值适中;而90 μL L-Cys与10 μL MB/Au/PANI/MnO2反应后吸光度值最小。因此,本实验选择10 μL MB/Au/PANI/MnO2和90 μL L-Cys进行Cu2+的检测。
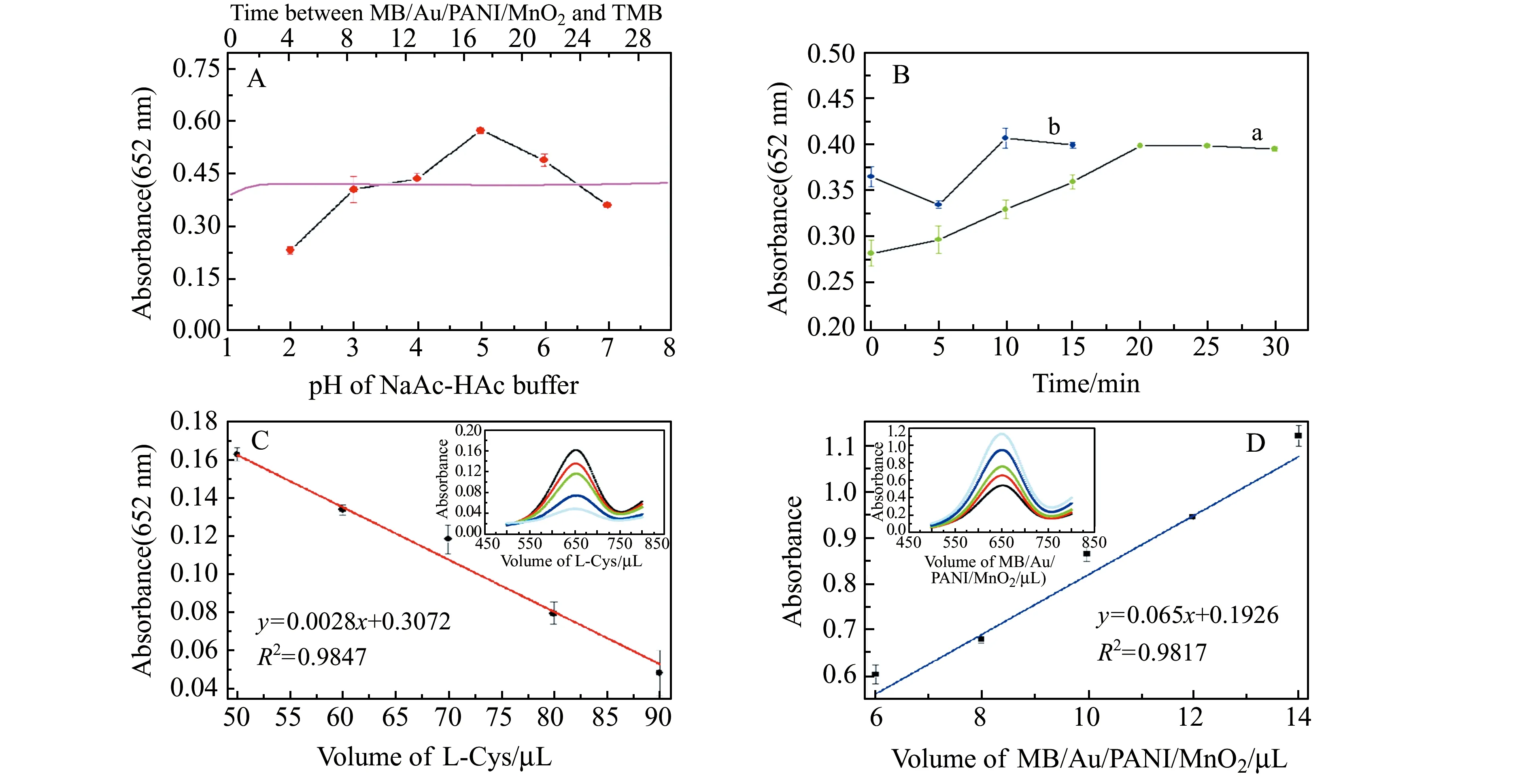
图4 (A) NaAc-HAc缓冲溶液pH值的优化和MB/Au/PANI/MnO2与TMB反应时间的优化(粉色);(B)MB/Au/PANI/MnO2与L-Cys反应时间的优化(a)和Cu2+与L-Cys反应时间的优化(b);(C)L-Cys反应体积优化;(D)MB/Au/PANI/MnO2反应体积优化
2.5 比色法检测Cu2+的分析性能
在最优实验条件下,利用L-Cys介导MB/Au/PANI/MnO2氧化TMB显色体系,测定不同浓度Cu2+的响应信号。如图5A所示,随着Cu2+浓度的递增,吸光度值亦逐渐增大,吸光度值与Cu2+浓度在1.0×102~1.0×107nmol/L范围内,其浓度的对数和对应的吸光度值呈现良好线性关系,线性方程为:y=0.0714x-0.1096,相关系数R2=0.9980,检出限(3σ)为1.54 nmol/L。与文献报道的Cu2+检测方法相比,本方法具有操作简便、反应灵敏迅速等优点(表1)。

表1 不同Cu2+传感器检测性能比较
2.6 检测Cu2+的选择性和重现性
我们选择自来水中8种常见离子(K+、Mg2+、Ca2+、Na+、Fe3+、Mn2+、Cd2+、Zn2+)作为干扰物,考察本方法对Cu2+检测的选择性,干扰离子浓度与Cu2+浓度比为10∶1。如图5B所示,唯有Cu2+能引起较明显吸光度值增大,表明此比色传感器对Cu2+有较好的选择性。为了进一步考察本方法对Cu2+检测的重现性,选择了102nmol/L、104nmol/L、106nmol/L 3个不同水平的Cu2+进行检测。其批内相对标准偏差(RSD)分别为4.9%、4.5%、3.5%;批间RSD分别为3.5%、2.7%、0.9%。结果表明本方法对Cu2+的检测具有较好的重现性。
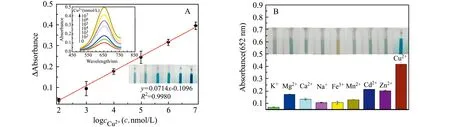
图5 (A)检测Cu2+浓度的校正曲线;(B)特异性实验结果(Cu2+浓度为1 mmol/L,K+、Mg2+、Ca2+、Na+、Fe3+、Mn2+、Cd2+、Zn2+浓度为10 mmol/L)
MB/Au/PANI/MnO2催化材料于相同温度条件(4 ℃)放置不同时间(7 d、14 d、30 d)后,分别对同一浓度Cu2+(0.1 mmol/L)进行检测。结果显示7 d、14 d、30 d后,吸光度值分别为初始值的85.04%、75.36%、75.49%。因此,MB/Au/PANI/MnO2复合材料具有一定的稳定性。
2.7 基于比色法对自来水样品中Cu2+的检测
为考察本方法用于实际样品中Cu2+的检测性能,选取自来水样品进行加标回收实验,加入Cu2+浓度分别为0.1、1.0和10 mmol/L。如表2所示,自来水样中Cu2+的加入回收率在85.03%~106.90%之间,相对标准偏差(RSD)为1.07%~5.04%。
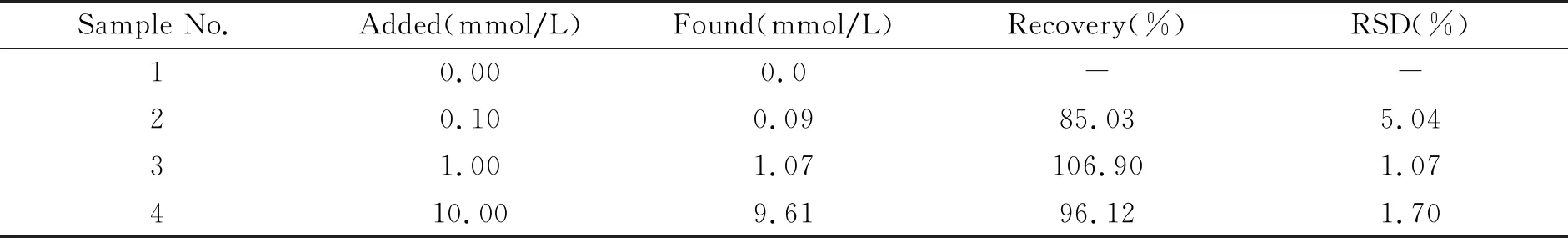
表2 自来水样中Cu2+的测定(n=3)
3 结论
利用Cu2+与L-Cys反应生成不溶性硫醇盐,进而削弱L-Cys抑制MB/Au/PANI/MnO2氧化TMB生成蓝色阳离子自由基(oxTMB)的过程,构建一种比色检测Cu2+的方法。本方法操作简便,成本低廉,具有较好灵敏度和特异性,且能满足实际样品中Cu2+的检测。此外,利用磁性复合材料作为反应载体,利于分离和纯化检测环境,便于进行样品的高通量初步筛选。
