糖尿病周围神经病变患者小腿运动神经及其支配肌肉病变的超声测值变化及相关性研究
2022-04-12霍中元赵红艳程辰田卫宋欢欢
霍中元 赵红艳 程辰 田卫 宋欢欢
1南京医科大学康达学院附属连云港中医院超声科,连云港 222004;2南京医科大学康达学院附属连云港中医院糖尿病科,连云港 222004;3南京医科大学康达学院附属连云港中医院脑电图诊断科,连云港 222004
2型糖尿病是中老年人较为常见的代谢疾病,易并发周围神经功能障碍,临床表现远端多发性、对称性、感觉运动神经病变[1]。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)伤累及小腿运动神经,小腿肌肉可能引起生物力学特性改变,导致小腿运动功能障碍[2]。高频灰阶超声具有无创性、准确性、可靠性、适用性等特点,能够较好地显示神经内部及周边形态结构,便于测量神经截面形态学变化。肌肉硬度指标可以反映肌肉的活动功能状态以及肌肉的生理功能。剪切波弹性成像技术所测量的杨氏模量可以量化组织硬度,提示肌肉收缩力方面的力学生理特性。目前,国内外对糖尿病周围神经病变患者小腿腓肠肌病变剪切波检测有所报道,但对其胫骨前肌及腓骨肌病变后剪切波测值变化报道较少。本研究涵盖腓神经、胫神经两支运动神经及小腿前、侧、后3组肌群,全面评估DPN患者小腿神经肌肉病变后超声测值变化及相关性,有助于临床早期发现小腿各神经肌肉功能障碍,早期预防干预,降低临床风险。
资料与方法
1、一般资料
选取2020年8月至2021年11月南京医科大学康达学院附属连云港中医院糖尿病科住院病例80 例对照研究。DPN 患者40 例中男18 例,女22 例,年龄(58.95±7.08)岁;不伴周围神经病变的糖尿病患者(NDPN 组)40 例中男18 例,女22 例,年龄(59.03±8.03)岁。同期正常对照组(ZC 组)30 例,年龄(58.40±6.26)岁。(1)纳入标准:糖尿病两组受检均要求符合1999年世界卫生组织2 型糖尿病诊断标准,并除外1型糖尿病[1];所有糖尿病组患者均已进行临床医师密歇根神经病变筛查量表评估,将评分结果值累计大于2,纳入周围神经病变组[2];糖尿病受检者通过神经电生理检查,其中周围神经病变组小腿腓神经和胫神经运动神经传导速度<40 cm∕s,肌电图波形改变出现波幅降低、潜伏期延长现象。(2)排除标准:恶性肿瘤、酒精药物中毒、颅脑及脊髓病变、肾功能不全、心肺功能不全、类风湿关节炎、痛风关节炎、甲减、腰椎病变、重症肌无力、小腿肌营养不良、小腿骨化性肌炎、髋关节及足踝部损伤的外伤史及手术史、踝关节骨质增生退变、小腿动脉硬化闭塞性疾病、急慢性或陈旧性小腿静脉血栓、肢体运动障碍等。参与研究的所有受检者均已知情同意,并签字,且超声检查过程中依从性较好。本研究通过南京医科大学康达学院附属连云港中医院医学伦理委员会批准。
2、仪器与方法
采用美国GE 公司制造型号为E9 系列的彩色超声诊断仪,支持弹性剪切波成像软件包,配置探头:4~9 MHz 及6~15 MHz 的线阵探头。在超声检查过程中,将仪器调至骨骼肌肉MskGen 条件下二维及剪切波模式。检查中保持室温在26~28 ℃,避免温度对肌肉弹性张力影响。3 组受检者下肢均双侧检测。首先嘱受检者都取平卧位,踝关节自然位时,肌骨条件二维模式,在其内踝上方5 cm处横切测量胫神经截面积;受检者俯卧位,在其小腿腓骨头旁上方处横切测量腓神经截面积;启动肌骨条件MskGen,剪切波模式时,标尺范围0~150 kPa,弹性取样框9 mm×5 mm,测值感兴趣区(ROI)圆形直径2 mm。于踝关节最大跖屈位时,纵切探头,测量在小腿中段1∕2处胫骨前肌杨氏模量值。同样模式检测,于踝关节最大跖屈位及最大背屈位,在胫骨内踝至腘窝折痕之间约上1∕3 处测量腓肠肌内侧头部分杨氏模量值;于足内翻状态下,在小腿中段1∕2 处测量外侧测量腓骨肌杨氏模量值。研究中所有超声测值均由同一医师检测,且该医师具有5年肌骨超声检查经验。同一受检部位检测5次,并取其平均值,每次测量应间隔5 s以上。在探查过程中,探头与体表间需涂足够多耦合剂,使探头充分接触皮肤。探查手法需轻柔适当,避免挤压受检处皮肤肌肉,防止影响肌肉的超声参数测值。
3、统计学方法
应用SPSS 22.0 统计软件。本研究运用Levene 检验法对计量数据方差齐性检验。符合正态分布的计量资料以均数±标准差(±s)表示,采用独立t检验与单因素方差分析。计数资料组间比较采用卡方检验。研究中两支运动神经截面积测值与其对应支配的小腿前后骨骼肌剪切波杨氏模量值,运用Kendall W 检验进行一致性检验,并采用Pearson 相关性分析。应用GraphPad Prism8 软件可视化相关性散点图。P<0.05为差异有统计学意义。
结果
1、一般临床资料分析
汇总两组糖尿病患者及ZC 组的一般临床资料,各项资料组间比较差异均无统计学意义(均P>0.05),详见表1。

表1 3组受检者一般临床资料指标比较
2、3组受检者小腿超声参数测值比较
3 组受检者下肢均双侧检测,共220 份检测结果。所有测值均已通过方差齐性检验。对小腿运动神经及其支配肌肉的各超声参数测值,进行单因素方差分析,3 组间比较差异均有统计学意义(均P<0.05),其中DPN 组的腓总神经横截面积与胫神经横截面积的检测值较NDPN 组和ZC 组增大,而腓肠肌、胫骨前肌、腓骨肌的杨氏模量检测值较NDPN组和ZC组减小,详见表2。
表2 3组受检者小腿超声参数测值比较(±s)
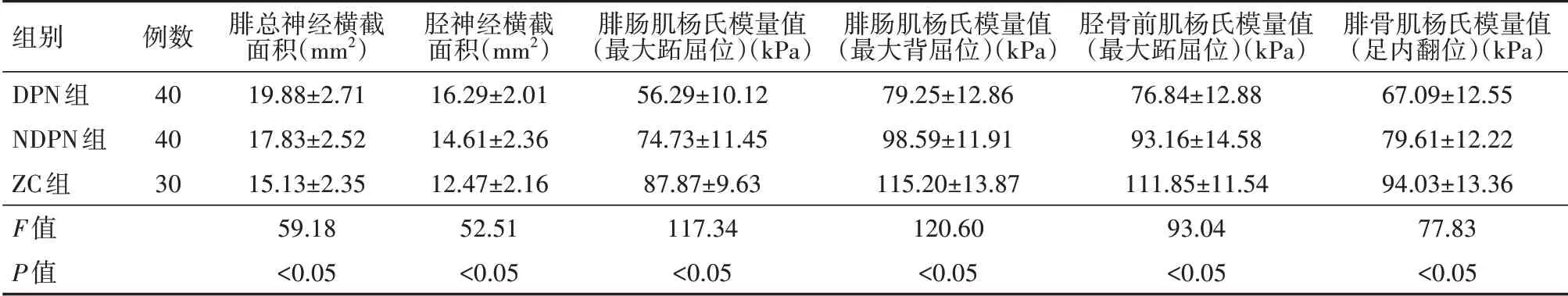
表2 3组受检者小腿超声参数测值比较(±s)
注:DPN组为糖尿病周围神经病变患者,NDPN为不伴周围神经病变的糖尿病患者,ZC组为非糖尿病健康志愿者;所有受检者均双侧下肢检测
组别DPN组NDPN组ZC组F值P值例数404030腓总神经横截面积(mm2)19.88±2.7117.83±2.5215.13±2.3559.18<0.05胫神经横截面积(mm2)16.29±2.0114.61±2.3612.47±2.1652.51<0.05腓肠肌杨氏模量值(最大跖屈位)(kPa)56.29±10.1274.73±11.4587.87±9.63117.34<0.05腓肠肌杨氏模量值(最大背屈位)(kPa)79.25±12.8698.59±11.91115.20±13.87120.60<0.05胫骨前肌杨氏模量值(最大跖屈位)(kPa)76.84±12.8893.16±14.58111.85±11.5493.04<0.05腓骨肌杨氏模量值(足内翻位)(kPa)67.09±12.5579.61±12.2294.03±13.3677.83<0.05
3、3组受检者超声测量结果一致性分析
左右侧腓总神经及胫神经截面积检测,左右侧胫骨前肌、腓肠肌、腓骨肌弹性模量值检测均Kendall W 检验系数>0.80,均P<0.05,表明小腿左右侧各超声参数5 次检测数值均具有较好的一致性。
4、两组糖尿病患者神经截面积与肌肉弹性杨氏模量值相关性
两组受检糖尿病患者均双侧小腿受检,两组均为80 份样本量。受检胫神经、腓总神经的截面积与其对应支配的小腿前后骨骼肌的剪切波杨氏模量参数值均呈负相关,其中伴DPN 组小腿运动神经对应支配肌肉相关性程度稍强,而NDPN 组对应的相关性程度偏低,呈弱相关,神经与对应肌肉参数相关性分析均P<0.01,并散点图呈现。详见表3、图1、图2、图3、图4。
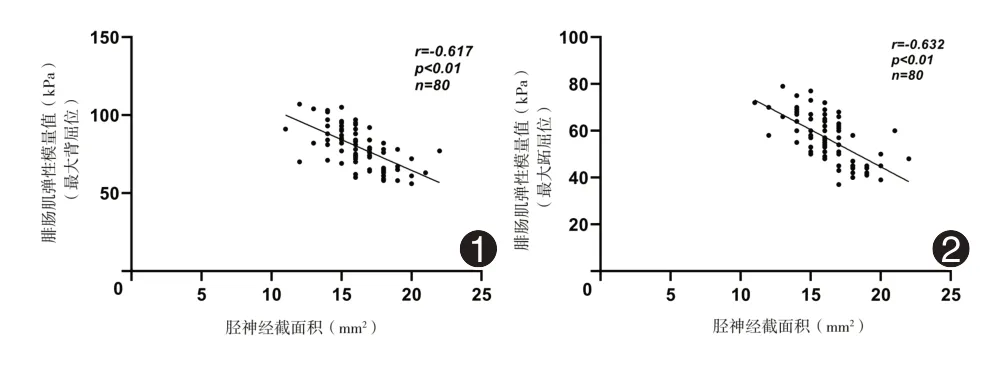
图1 40例糖尿病周围神经病变患者双侧(80份样本量)胫神经截面积与腓肠肌杨氏模量值(最大背屈位)相关性 图240 例糖尿病周围神经病变患者双侧(80 份样本量)胫神经截面积与腓肠肌杨氏模量值(最大跖屈位)相关性

图3 40例糖尿病周围神经病变患者双侧(80份样本量)腓总神经截面积与胫骨前肌杨氏模量值相关性 图440 例糖尿病周围神经病变患者双侧(80 份样本量)腓总神经截面积与腓骨肌杨氏模量值相关性

表3 两组糖尿病患者神经截面积与肌肉弹性杨氏模量值相关性r值
讨论
DPN 是糖尿病病程进展至出现周围神经功能障碍的并发症,神经损伤较多累及下肢远端感觉运动神经。下肢小腿部运动神经主要包括腓总神经、胫神经,腓总神经分出的肌支支配小腿肌外侧腓骨肌群和前侧胫前肌群,胫神经则支配小腿后侧肌群。当小腿运动神经病变,累及前后不同肌肉群时,出现前后肌力不平衡,常见病损“勾状足”畸形、足下垂、跨越步态,甚至出现跌倒骨折的风险。有关报道,在糖耐量异常阶段,患者肢体就可出现肌肉质量的减少[3]。当糖尿病病程发展至伴周围神经病变时,肢体骨骼肌失神经支配,致使肌肉出现肌力减弱,运动系统功能障碍。患者活动能力下降,独立性方面也会受到很大的威胁[4]。因此,在DPN的临床诊疗中,如何方便、快捷、早期评估诊断DPN,对于改善DPN患者的预后和生活质量至关重要。
高频超声所配备探头频率高,图像分辨率高,在肌骨模式下,能对浅表肌肉神经组织清晰显示,便于评估浅表肌肉以及神经的组织形态和功能[5]。剪切波弹性成像是一种快速无创的用于组织硬度定量评估的超声检查技术,可帮助获得更多的客观影像信息[6]。目前,剪切波技术在肌肉骨骼系统中的应用日益广泛。剪切波弹性成像可以通过测量肌肉僵硬度来评估健康衰老或者病理状况时肌肉生物力学特性变化,以及肌肉病损时的功能缺陷[7-8]。剪切波弹性检测骨骼肌的僵硬度下降,可与肌肉无力减低呈正相关[9]。DPN 患者周围神经病变可较早影响肢体远端固有骨骼肌。超声剪切波弹性成像可以用来检测DPN患者肌肉病变[10]。
2 型糖尿病患者在中老年龄期,小腿肌肉病损明显[11]。本研究中糖尿病两组受检患者的年龄比较无明显差异。研究针对糖尿病患者小腿主要运动神经及其支配的骨骼肌病变,高频超声可以评估小腿运动神经有无病损肿胀,剪切波弹性模式测杨氏模量值可以评估病变肌肉僵硬度变化。DPN 组的腓总神经横截面积超声值与胫神经超声值较NDPN 组和非糖尿病健康组增大。DPN 患者下肢小腿多支周围神经同时病变,神经细胞变性肿胀,神经束水肿增粗,截面积增大,其可能与DPN 的发病机制对神经系统毒性损伤有关[12]。DPN的发病机制如糖代谢紊乱、氧化应激损伤、免疫学说损伤等。研究中DPN组的小腿腓肠肌、胫骨前肌、腓骨肌的杨氏模量测值等指标值较NDPN 组和非糖尿病组减小,3组间比较差异均有统计学意义(均P<0.05)。即DPN病患者的肌肉僵硬度杨氏模量值小于NDPN 患者,也小于非糖尿病组。因DPN患者胰岛素抵抗和肌肉质量流失可经常同时发生,骨骼肌脂质增加也会影响组织胰岛素敏感性和肌肉质量变化[13-14]。DPN 患者胰岛素抵抗,机体长期处于高血糖状态,下肢远端出现多发感觉、运动神经受损,肌肉失神经支配呈营养废用性萎缩,肌肉单位肌纤维数量减少、体积变小,致使肌肉受损、剪切波硬度减低,生物力学特性降低[15-16]。本研究中受检DPN 患者与NDPN 患者小腿胫神经、腓神经截面积,与其对应支配的小腿前后骨骼肌的剪切波杨氏模量参数值均呈负相关,其中DPN 患者对应的相关性程度稍强,而NDPN 患者对应相关性程度偏低,呈弱相关。当糖尿病病程进展存在周围神经病变损伤后,小腿骨骼肌失去神经支配,可加重肌肉营养废用性萎缩,致剪切波弹性值随糖尿病周围神经病变进展而减低。因剪切波弹性检测骨骼肌的僵硬度下降,可与肌力减低呈正相关[9]。DPN累及骨骼肌病变时,可产生一些临床风险及危险性。Sarodnik 等[17]报道,2 型糖尿病患者的肌肉减少,肌力下降,增加了跌倒和骨折的风险。此外有关报道,小腿肌肉萎缩可造成小腿肌肉泵功能下降,小腿后方肌间静脉扩张淤滞,易诱发血栓形成,增加肺栓塞发生率[18]。鉴于DPN 患者小腿运动神经与其支配肌肉病变具有一定程度相关性和较多的临床风险,临床应重视DPN 患者小腿肌肉综合的评估。可制定2 种检查模式联合方案,运用高频超声评估DPN 小腿运动神经病损,同时运用弹性剪切波模式检测小腿肌肉弹性值变化,有助于早期发现小腿肌肉功能障碍。
本研究尚存在不足,受检样本量相对稍小,寄希望大样本量,明确DPN 患者小腿各运动神经及其支配肌肉病变超声诊断临界值。
综上所述,DPN 患者存在小腿肌肉硬度减低,常规灰阶超声与剪切波弹性成像可联合评估小腿运动神经及其支配肌肉病变,可以更好地评估DPN患者的病情,具有潜在的临床应用价值。
利益冲突所有作者均声明不存在利益冲突
