太子参参须多糖促进小鼠脾淋巴细胞体外增殖及细胞因子分泌的研究
2022-04-11闵思明李若南于丛爽张炎达黄一帆马玉芳
乔 石,闵思明,李若南,于丛爽,张炎达,黄一帆,马玉芳*
(1.福建农林大学 中西兽医结合与动物保健福建省高等学校重点实验室,福建福州 350002; 2.福建农林大学 福建省兽医中药与动物保健重点实验室,福建福州 350002;3.福建贝迪药业有限公司,福建宁德 355399)
脾脏中含有大量的T、B淋巴细胞,淋巴细胞是机体发挥特异性免疫应答功能的主要细胞,受抗原物质刺激后能增殖、分化形成效应细胞,产生抗体或淋巴因子发挥免疫效应。淋巴细胞增殖是反映细胞免疫功能的最直接指标[1],脾淋巴细胞的活化与机体免疫力密切相关[2]。大量研究表明,植物多糖具有免疫药理活性,体外能促进脾淋巴细胞增殖[3],促进细胞因子分泌[4-5],上调细胞因子mRNA表达[5]等。太子参为石竹科孩儿参[Pseudostellariaheterophylla(Miq.) Pax ex Pax Hoffm.]的干燥块根[6],属补益中药。太子参参须是太子参的不定根和根尖,占太子参总质量的10%~15%[7]。近年仅有太子参参须提取物的药理作用研究[8],但太子参参须多糖(RadixPseudostellariafibrous root polysaccharide,RPFRP)对体外细胞的药理活性少有研究,本文通过检测RPFRP对体外小鼠脾淋巴细胞的增殖、凋亡以及细胞因子分泌等,探究RPFRP对小鼠脾淋巴细胞活性的促进作用,为太子参参须的进一步开发研究提供参考。
1 材料与方法
1.1 材料
1.1.1 药品和实验动物 太子参参须多糖(RPFRP,纯度63.5%)经福建省兽医中药与动物保健重点实验室制备并保存。清洁级雄性昆明小鼠,体重16 g~20 g,购自福建医科大学实验动物中心。
1.1.2 主要试剂 磷酸盐缓冲液(PBS),博士德生物工程有限公司产品;红细胞裂解液、刀豆蛋白(ConA)、脂多糖(LPS),Sigma公司产品;四甲基偶氮唑盐(MTT),Merck公司产品;细胞因子试剂盒,上海邦奕生物科技有限公司产品;RPMI 1640培养基,HyClone公司产品;凋亡试剂盒,江苏凯基生物技术股份有限公司产品。
1.1.3 主要仪器 CO2培养箱,美国Thermo公司产品;倒置显微镜,日本Nikon公司产品;Infinite M200 Pro多功能酶标仪,瑞士Tecan公司产品;ACEA NovoCyteTM流式细胞仪,美国艾森公司产品。
1.2 方法
1.2.1 小鼠脾淋巴细胞悬液的制备 断颈脱臼法剖杀小鼠,750 mL/L乙醇浸润,无菌操作取脾,灭菌研钵中研碎脾脏,加入PBS后混匀,过滤得脾细胞悬液,离心留沉淀,加入2 mL红细胞裂解液,离心(1 500 r/min,10 min),PBS冲洗3次,再以1 500 r/min 离心5 min;加入2 mL RPMI-1640完全培养液,涡旋混匀,台盼兰染色计数,活细胞应不低于95%,调整细胞浓度至2×106个/mL备用[9]。
1.2.2 RPFRP对小鼠脾淋巴细胞的安全质量浓度 96孔板中加入100 μL脾细胞悬液(1.5×106个/mL),另分别加100 μL不同质量浓度RPFRP的RPMI 1640培养液(RPFRP的终质量浓度分别为0、3.125、6.25、12.5、25、50、100、200、400、800、1 600、3 200 μg/mL),共200 μL,每组4个重复。于37℃体积分数为5%的CO2培养箱中培养44 h,随后向各孔加入50 μL MTT液(2 mg/mL),37℃体积分数为5% CO2条件下继续培养4 h;取出96孔板,离心,弃上清,每孔加入150 μL DMSO,于细胞板振荡器上避光振荡混匀,酶标仪测定各孔OD492nm值[10]。
1.2.3 MTT法检测小鼠脾淋巴细胞增殖 96孔板(除空白孔)中加入100 μL脾细胞悬液(1.5×106个/mL),空白孔(100 μL RPMI-1640完全培养液),RPFRP协同ConA或LPS的试验孔分别加50 μL ConA(终质量浓度为4 μg/mL)或50 μL LPS(终质量浓度为10 μg/mL),再加50 μL含不同质量浓度RPFRP的培养液(RPFRP的终质量浓度分别为0、12.5、25、50、100、200、400 μg/mL)[11],共200 μL,每个RPFRP浓度设4个重复。于37℃体积分数为5% CO2条件下培养44 h,随后各孔加入50 μL MTT液(2 mg/mL),再置37℃体积分数为5% CO2条件下培养4 h;取出96孔板,离心,弃上清,各孔加入150 μL DMSO,于细胞板振荡器上避光振荡混匀,酶标仪测定各孔OD492nm值。
1.2.4 流式细胞术检测小鼠脾淋巴细胞的凋亡 96孔板中加入1 mL脾细胞悬液(1.5×106个/mL),另加入1 mL含不同质量浓度RPFRP的RPMI 1640培养液(RPFRP的终质量浓度分别为0、25、50、100、200、400 μg/mL),每组3个复板。24 h后收集脾细胞悬液,离心回收沉淀;PBS洗涤2次,再离心,收集(1~5)×105个细胞;分别加入500 μL的Binding buffer悬浮细胞和5 μL Annexin V-FITC混匀后[7],再加入5 μL Propidium Iodide,室温避光反应5 min~15 min;1 h内上流式细胞仪检测各组小鼠脾细胞的凋亡[11]。
1.2.5 小鼠脾淋巴细胞上清液中IL-6、IL-2、IL-4和IFN-γ含量测定 6孔板中分别加入1 mL脾细胞悬液(1.5×106个/mL);RPFRP单独作用组依次加1 mL含不同质量浓度RPFRP的RPMI 1640培养液(RPFRP的终质量浓度分别为0、25、50、100、200、400 μg/mL);RPFRP协同 ConA作用组依次加1 mL含ConA和不同质量浓度RPFRP的RPMI 1640培养液(ConA终质量浓度为4 μg/mL,RPFRP的终质量浓度分别为0、25、50、100、200、400 μg/mL)。于37℃、体积分数为5% CO2条件下培养44 h,离心收集上清,根据ELISA试剂盒说明进行细胞因子含量测定[3]。
1.2.6 数据分析 所有数据均采用SPSS Statistics 23.0软件进行单因素方差分析,LSD法进行多重比较,P<0.05为差异显著。
2 结果
2.1 RPFRP对小鼠脾淋巴细胞安全浓度的筛选
以含有不同质量浓度RPFRP的RPMI 1640培养液培养小鼠脾淋巴细胞,经分光光度法检测(图1),图中不同字母表示差异显著(P<0.05)。结果RPFRP为3.125 μg/mL~3 200 μg/mL时,OD492 nm值均显著高于空白组(P<0.05),且当RPFRP为3.125 μg/mL~1 600 μg/mL范围内时,OD492nm值随着RPFRP质量浓度的增大而增大,当达到3 200 μg/mL时OD492nm值才出现拐点,但仍然高于空白组。表明RPFRP在3.125 μg/mL~3 200 μg/mL范围内对脾淋巴细胞均无毒副作用,并能显著促进小鼠淋巴细胞的增殖。

图1 RPFRP对小鼠脾淋巴细胞安全质量浓度的筛选结果
2.2 RPFRP对小鼠脾淋巴细胞增殖的影响
2.2.1 RPFRP对小鼠T淋巴细胞增殖的影响 MTT法检测各组小鼠T淋巴细胞比例以确定RPFRP对小鼠T淋巴细胞增殖的影响(图2),图中不同字母表示差异显著(P<0.05)。当RPFRP为12.5 μg/mL~400 μg/mL时,RPFRP协同ConA组T淋巴细胞增殖较空白组显著升高(P<0.05),增殖作用随RPFRP质量浓度的增大而增强。说明RPFRP协同ConA能显著促进小鼠T淋巴细胞的增殖,且呈一定的剂量依赖性。
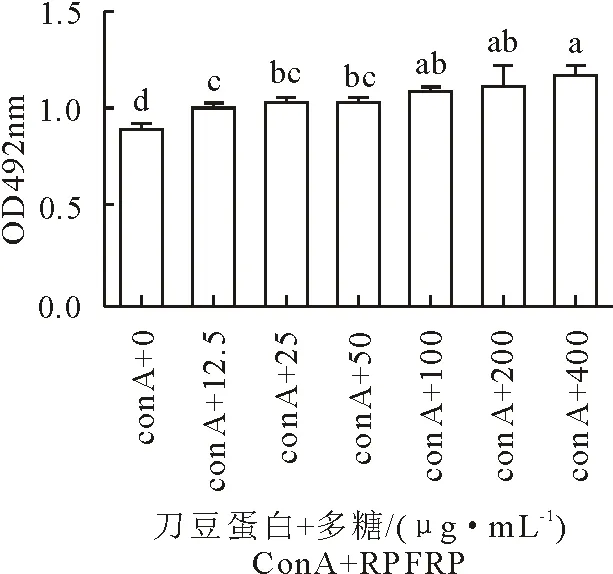
图2 RPFRP对小鼠T淋巴细胞增殖影响的检测结果
2.2.2 RPFRP对小鼠B淋巴细胞增殖检测结果 MTT法检测各组小鼠B淋巴细胞比例以确定RPFRP对小鼠B淋巴细胞增殖的影响(图3),图中不同字母表示差异显著(P<0.05)。当RPFRP为50 μg/mL~400 μg/mL时,RPFRP协同LPS组B淋巴细胞增殖较空白组显著升高(P<0.05),细胞增殖作用随RPFRP的质量浓度增大而增强。表明RPFRP协同LPS能够显著促进小鼠B淋巴细胞的增殖,且呈一定的剂量依赖性。
2.3 RPFRP对小鼠脾淋巴细胞凋亡的影响
用流式细胞术检测各组小鼠脾淋巴细胞以确定RPFRP对细胞凋亡的影响(图4),图4中FITC+/PI-为早期凋亡率,FITC-/PI+为晚期凋亡率,TOTAL为总凋亡率。RPFRP为25 μg/mL~100 μg/mL时,给药组细胞总凋亡率均显著低于空白组(P<0.05),表明RPFRP可显著抑制小鼠脾淋巴细胞的凋亡,并随着RPFRP质量浓度增大,细胞凋亡率逐渐下降。RPFRP为200 μg/mL~400 μg/mL时,细胞晚期凋亡率较空白组显著下降(P<0.05),表明RPFRP可显著抑制小鼠脾淋巴细胞的晚期凋亡。
2.4 RPFRP对小鼠脾淋巴细胞分泌因子的影响
ELISA法检测各组小鼠脾淋巴细胞上清液中IL-6、IL-2、IL-4和IFN-γ 的含量(图5)。RPFRP为100 μg/mL~400 μg/mL且单独作用时,上清液中IL-2含量较空白组显著升高(P<0.05);RPFRP为400 μg/mL协同ConA作用,IL-2含量较空白组显著升高(P<0.05)。RPFRP单独或协同ConA作用时,IL-4含量较空白组均有上升,但差异不显著(P>0.05)。RPFRP为200 μg/mL~400 μg/mL且单独作用时,其IL-6含量较空白组显著升高(P<0.05);RPFRP为100 μg/mL~400 μg/mL协同ConA作用时,IL-6含量较空白组显著升高(P<0.05)。当RPFRP为200 μg/mL时,与空白组相比,无论是RPFRP单独或协同ConA作用,都对IFN-γ 含量有显著升高作用(P<0.05)。

图3 RPFRP对小鼠B淋巴细胞增殖影响的检测结果
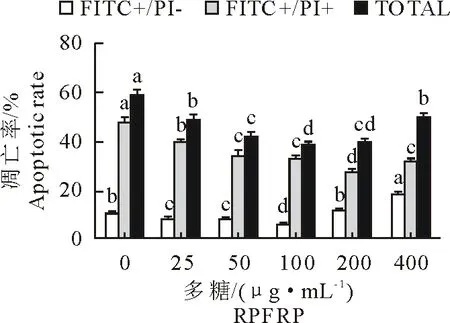
图4 RPFRP对小鼠脾淋巴细胞凋亡影响的检测结果
3 讨论
本研究用RPFRP体外作用小鼠脾淋巴细胞,RPFRP质量浓度在3.125 μg/mL~3200 μg/mL范围内对细胞增殖均有显著的促进作用,联合ConA和LPS的效果也比ConA或LPS单独使用更明显。说明RPFRP对脾淋巴细胞有较好的刺激作用。当RPFRP质量浓度在25 μg/mL~100 μg/mL时,各给药组细胞的早期凋亡、晚期凋亡和总凋亡率均显著低于空白组,且随着浓度增大各凋亡率下降。表明RPFRP具有抑制小鼠脾淋巴细胞凋亡的作用。
细胞因子是一类小分子物质,能够参与机体的免疫调节[12]。IL-2是由活化的T细胞产生且可调控免疫应答的关键细胞因子。IFN-γ 能增强NK细胞活性,激活巨噬细胞,从而增强其吞噬能力[13]。IL-4能提高小鼠B细胞分泌IgG1和IgE的能力,被称为B细胞刺激因子和生长因子[14]。IL-6是由成纤维细胞、淋巴细胞、单核-巨噬细胞及内皮细胞等多种细胞产生的细胞因子,可以刺激B细胞分化,并同集落刺激因子一起刺激原始骨髓源细胞的生长和分化,增强NK细胞的裂解功能[15]。在急性期蛋白表达阶段,IL-6的急性表达可以刺激多种细胞群体在机体内产生防御性非特异性应答;此外,它还有提升IL-2的作用,从而增强机体的免疫功能[16]。本试验检测细胞因子含量发现,RPFRP对IL-2、IL-6和IFN-γ 的分泌都有一定的促进作用,能够在一定程度上调脾淋巴细胞分泌细胞因子。RPFRP可以促进脾淋巴细胞的增殖,从而进一步调节脾淋巴细胞分泌细胞因子的水平。
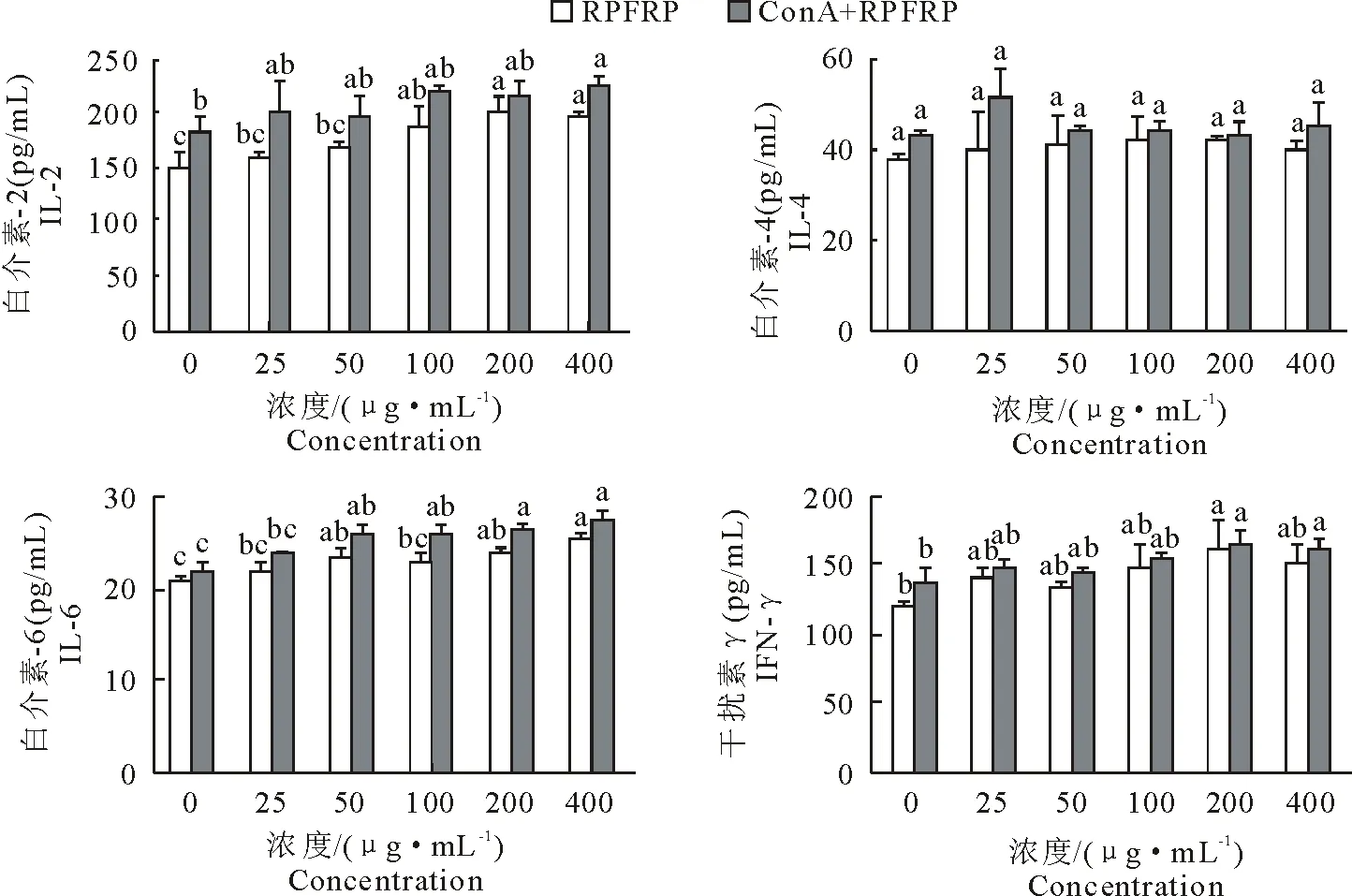
图5 RPFRP单独或协同ConA对小鼠脾淋巴细胞细胞因子含量影响的检测结果
