猪流行性腹泻病毒COE蛋白的原核表达及免疫原性分析
2022-04-11李雅心胡瑞瑞王小奎米桃桃胡圣伟
李雅心,郭 涛,胡瑞瑞,王小奎,米桃桃,倪 伟,胡圣伟
(石河子大学生命科学学院,新疆石河子 832000)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)是引起猪流行性腹泻(Porcine epidemic diarrhea,PED)的病原体,PED以仔猪发热、消化道黏膜发炎、剧烈腹泻、呕吐、严重脱水等为特征,易引起空肠和回肠内绒毛破坏及萎缩[1],是目前严重危害养猪业发展的传染性疾病之一。PEDV侵袭世界各地猪群,给世界养猪业造成巨大经济损失[2]。与经典株及疫苗株的基因序列相比,全球PEDV流行株发生了很大程度的变异,其S基因序列与2010年前的毒株及经典疫苗株的同源性仅为93.3%~95.7%和93.8%~93.9%[3]。由此可见,用经典毒株制备的PED弱毒疫苗可能对新的PEDV变异毒株感染无完全保护力[4]。选择当前流行株制备PED疫苗成为防控PED发生的关键。本研究通过分析2010年后国内PEDV流行毒株COE区氨基酸序列,得到COE区相对保守序列,用pET-32a原核表达系统表达COE融合蛋白,并进行目的蛋白的免疫原性分析,为后续PED亚单位疫苗的研制及抗体检测方法的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种、载体和试验用动物 感受态细胞E.coliDH5α、TransB(DE3),原核表达载体pET-32a(+)均为石河子大学动物基因工程实验室保存;3月龄外三元猪购自新疆石河子市某规模化养殖场。
1.1.2 主要试剂 限制性内切酶EcoR、XhoⅠ和SolutionⅠ,TaKaRa公司产品;Protein Marker,北京全式金生物技术有限公司产品;质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒,北京天根生化科技有限公司产品;酵母提取物和胰蛋白胨,OXOID公司产品;His标签蛋白纯化预装柱HisTrapTMFF Crude,美国GE公司产品;异丙基-β-D-硫代半乳糖苷(IPTG)和羊抗猪IgG-HRP抗体,北京Solarbio科技有限公司产品;基因合成由上海生工生物工程有限公司完成。
1.1.3 主要仪器 微量移液器和PCR仪,德国Eppendorf公司产品;超净工作台,苏州安泰空气技术有限公司产品;高速台式离心机,上海安亭科学仪器厂生产;凝胶成像系统,美国伯乐公司产品;电泳仪,北京六一生物科技有限公司产品;普通细菌摇床,广州艾卡仪器设备有限公司产品;酶标仪,美国Thermo Fisher Scientific公司产品。
1.2 方法
1.2.1 PEDV S蛋白COE基因设计与合成 用生物学软件DNAman 7.0对自2010年以后国内PEDV流行株COE(499aa-638aa)氨基酸序列进行同源性分析,选取相对保守毒株(GenBank登录号:KU237224),根据大肠埃希氏菌对密码子的偏好性优化稀有密码子,交由上海生工生物工程有限公司合成编码CEO区的基因片段,并插入到pET-28a(+)质粒中,5′末端引入EcoRⅠ酶切位点和起始密码子ATG,3′末端引入XhoⅠ酶切位点,该质粒命名为pET-28a-COE。
1.2.2 COE区生物信息学分析 COE蛋白的理化性质及蛋白结构由ProtParam、ProtScale等生物信息分析工具进行预测分析(表1)。

表1 生物信息分析工具
1.2.3 重组表达载体的构建 提取pET-28a-COE质粒与pET-32a(+)质粒,用限制性内切酶EcoRⅠ和XhoⅠ在37℃条件下酶切2 h,酶切体系(总体积为20 μL):2 μL 10×Q buffer,1 μLEcoRⅠ,1 μLXhoⅠ,6 μL pET-28a-COE(pET-32a(+)),用ddH2O补足至20 μL。酶切产物经10 g/L琼脂糖凝胶电泳检测后,用琼脂糖凝胶DNA回收试剂盒回收。将回收的COE基因片段和pET-32a(+)载体在16℃连接4 h,连接体系(总体积为10 μL):5 μL Solution Ⅰ,2.5 μLCOE,2.5 μL pET-32a(+)。连接产物转化大肠埃希氏菌DH5α感受态细胞,涂布于含100 μg/mL氨苄青霉素(Amp)的LB平板,37℃培养过夜。次日,挑取单菌落,接种于10 mL LB培养基中,扩大培养后小提质粒,进行双酶切鉴定,将初步鉴定正确的质粒所对应的克隆菌株交由北京睿博兴科生物技术有限公司测序。测序鉴定正确的重组质粒命名为pET-32a-COE。
1.2.4 重组COE蛋白的原核表达与纯化 将测序正确的重组质粒pET-32a-COE转化至大肠埃希氏菌TransB(DE3)感受态细胞,涂布于含有Amp的LB平板过夜培养,挑取单菌落,扩大培养后小提质粒,进行双酶切鉴定,将鉴定正确的重组菌株命名为pET-32a-COE-TransB(DE3)。取鉴定正确的阳性菌株于37℃振荡过夜培养进行活化,次日按1∶100的比例转接至50 mL含100 μg/mL Amp的LB液体培养基扩大培养,37℃、180 r/min培养至菌液OD600 nm值为0.4~0.6时,添加诱导剂IPTG至终浓度为1 mmol/L,37℃诱导8 h后,8 000 r/min离心5 min收集菌体。加入裂解缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L 咪唑,pH 7.4),重悬菌体并于4℃过夜裂解,次日反复冻融3次后,冰水状态下超声破碎,超声5 s,间隔5 s,破碎至液体澄清。12 000 r/min离心30 min,分别取上清和沉淀进行SDS-PAGE(12%)分析重组COE蛋白的表达形式。采用GE公司His标签蛋白纯化预装柱HisTrapTMFF Crude纯化蛋白,经过透析和浓缩处理后,利用BCA蛋白定量试剂盒测定纯化的COE蛋白浓度,置-80℃保存备用。
1.2.5 动物分组及免疫 挑选体重相近的3月龄外三元猪4头,随机分为2组,COE蛋白免疫组(P1、P2)和PBS免疫对照组(D1、D2)。蛋白经BCA法测定蛋白浓度后,与等体积的弗氏不完全佐剂乳化后于猪颈部皮下多点注射免疫,免疫剂量为1 mg/头,PBS免疫对照组以同样方式注射等体积PBS溶液。免疫前及免疫后第14、21、28、35、42天于前腔静脉采血3 mL,分离血清置-20℃保存。
1.2.6 ELISA检测血清IgG抗体水平 以纯化的重组COE蛋白为抗原,每孔加入100 μL(0.5 μg/L)包被ELISA板,4℃孵育过夜,次日弃去孔内液体,PBS′T洗涤3次,每孔加入200 μL封闭液(含50 g/L BSA的PBS′T),37℃孵育2 h后洗涤3次,每孔加入100 μL经8 000倍稀释的血清,37℃孵育1 h后洗涤5次,每孔加入100 μL经2 000倍稀释的HRP标记的羊抗猪IgG,37℃孵育1 h后洗涤5次。每孔加入100 μL TMB底物缓冲液,37℃避光孵育15 min,每孔再加入50 μL终止液。在酶标仪450 nm波长处测定各孔OD值。评价COE蛋白免疫原性标准为免疫后血清样品OD450(P)/免疫前血清样品OD450 nm值(N)≥2且免疫前血清样品OD450 nm值<1[5]。
2 结果
2.1 PEDV编码S蛋白COE区基因的合成
参考GenBank中的PEDV S蛋白氨基酸序列,选择499-638aa片段序列,优化稀有密码子后进行全基因合成(图1) 。
2.2 COE区生物信息学分析
COE基因编码的蛋白含有140个氨基酸,分子式为C686H1022N164O215S4,分子质量约15 ku,等电点理论值为4.78。运用ExPASy protparam计算得出平均疏水指数为0.111,预测该蛋白是疏水性蛋白。利用SignalP-3.0中的神经网络法(Neural Network,NN)进行信号肽分析,结果表明COE蛋白无信号肽序列。经SOPMA预测COE蛋白二级结构,结果显示COE蛋白含有5% α螺旋,2.86% β转角,45%延伸链和47.14%无规则卷曲。TMHMM工具分析提示COE蛋白无跨膜卷曲,属于非跨膜蛋白。使用Abcpred软件对该蛋白的B细胞抗原表位进行预测,将阈值设置为0.85,氨基酸长度为16个,结果显示COE蛋白的B细胞抗原表位不小于0.85的共有5个(表2)。

图1 合成序列
2.3 pET-32a-COE表达载体的构建与鉴定
pET-28a-COE与pET-32a(+)质粒经EcoRⅠ/XhoⅠ双酶切后,成功获得420 bp的目的基因与载体片段(图2)。回收酶切产物并连接,将连接后的重组质粒转化至E.coliDH5α感受态细胞中,提取质粒酶切验证(图3),在420 bp处可见与预期相符的目的基因条带,经测序比对发现与合成序列完全一致,表明pET-32a-COE载体构建成功。

表2 B细胞抗原表位预测结果
2.4 重组COE蛋白的表达及纯化
重组表达菌株pET-32a-COE-TransB(DE3)经过IPTG诱导后,超声破碎裂解菌体,离心所得上清和沉淀通过SDS-PAGE鉴定,结果显示沉淀样品在预期35 ku处有目的条带,说明COE蛋白主要以包涵体形式表达。用HisTrapTMFF Crude纯化后获得了相应大小的一条COE蛋白条带,且纯化效果较好(图4)。BCA法测得纯化浓缩后COE蛋白的浓度为1.85 mg/mL。
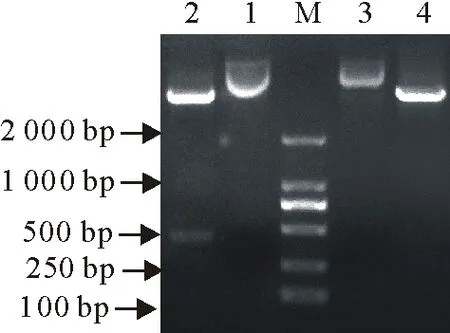
M.DNA 标准DL 2 000;1.pET-28a-COE质粒;2.pET-28a-COE质粒酶切;3.pET-32a(+)质粒;4.pET-32a(+)质粒酶切
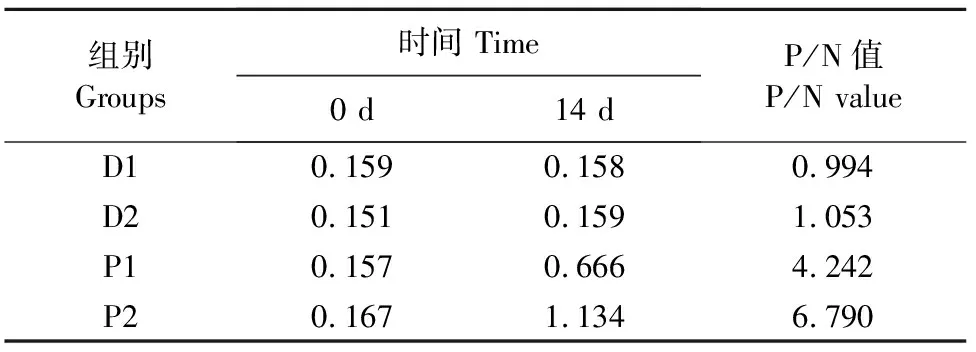
图2 pET-28a-COE与pET-32a(+)酶切结果
2.5 血清IgG抗体水平检测
用ELISA方法检测COE蛋白免疫后血清COE特异性IgG抗体含量水平,结果显示,免疫后14 d对照组OD450 nm值无明显变化,而COE蛋白免疫组OD450 nm值均显著升高(P<0.01),且P/N≥2(表3)。免疫后42 d内抗体监测结果显示(图5),COE蛋白免疫组与对照组相比,抗体水平明显增加,表明COE重组蛋白免疫猪能够刺激猪产生COE特异性IgG抗体,具有良好的免疫原性。

M.DNA标准DL 2 000;1.Plasmid pET-32a-COE;2.EcoRⅠ/XhoⅠ

M.蛋白分子质量标准;1.重组菌诱导前;2.重组菌诱导后;3.重组菌诱导后沉淀;4.纯化后的COE重组蛋白

图5 不同时间COE蛋白免疫组(P1、P2)和 PBS对照组(D1、D2)血清IgG检测结果
3 讨论
基于经典毒株CV777和DR13制备的疫苗不能很好地对仔猪起到免疫保护作用,用变异毒株YC2014制备的灭活疫苗保护效果较好[6]。说明PED的发生是PEDV进化和变异为不同的基因型引起的,所以对于多样化的PEDV毒株,传统疫苗无法保护仔猪免受感染。S蛋白是影响PEDV毒力的关键蛋白,其遗传变异往往造成毒株毒力的改变,但其COE区在不同基因型的PEDV毒株间相对保守[7],因此,COE蛋白是较好的PED疫苗候选抗原。
大肠埃希氏菌原核表达系统具有遗传背景清晰、表达量高、成本低、表达周期短等优点,是外源病毒蛋白表达的首选表达系统[8]。本研究选择可诱导机体产生中和抗体的最小片段COE区,采用原核表达载体pET-32a(+),成功在体外表达并纯化得到了PEDV变异毒株的COE蛋白,一方面可以作为制备PEDV变异毒株亚单位疫苗的候选,另一方面可以利用表达的蛋白建立检测PEDV抗体的方法,为预防和控制该病提供技术支撑。
用原核表达得到的PEDV相关蛋白免疫小鼠后,检测到融合蛋白均显示良好免疫原性[9-10]。将PEDV Brl/87株的COE基因在烟草中表达,并通过动物试验证实其具有良好的抗原性[11]。表达PEDVCOE基因的重组枯草芽孢杆菌口服后可以刺激猪高水平的局部及全身免疫反应,有可能成为对抗猪PEDV感染的候选疫苗[12]。有研究成功构建了表达PEDV N基因和中和抗原表位COE基因的重组干酪乳杆菌表达系统[13],用两组重组菌分别免疫小鼠,检测抗体水平发现,既可刺激小鼠产生高效的全身免疫反应,还能引起局部黏膜免疫应答,具备研发成新型口服疫苗的优势。
本研究用生物信息学分析工具对PEDV COE蛋白亲水性、空间结构预测等综合分析,发现该蛋白序列中存在多个抗原表位,为后期筛选抗原表位区域提供了方向。通过基因工程技术,获得纯化COE蛋白,免疫猪后检测到血清中IgG抗体效价显著升高,说明表达出的蛋白可以进一步研究以开发亚单位疫苗,为生产实践中PED预防奠定基础。
