猪源植生拉乌尔菌的鉴定及生物学特性
2022-04-11丁俊仁袁定胜
邢 柳,王 利,魏 勇,丁俊仁,袁定胜
(1.西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041;2.西南民族大学动物科学 国家民委重点实验室,四川成都 610041;3.四川省畜牧科学研究院,四川成都 610066;4.四川省畜牧总站,四川成都 610100)
植生拉乌尔菌(Raoultellaplanticola)属于肠杆菌科、拉乌尔菌属。植生拉乌尔菌是一种需氧、无动力的革兰氏阴性肠杆菌。该菌多存在于水、土壤和植物等自然环境中[1],也可存在于动物黏膜和人体内,在免疫力低下的人群中也可发生感染[2]。拉乌尔菌属与克雷伯菌属亲缘性较为密切,其先归为克雷伯菌属成员[3]。拉乌尔菌是一种条件致病菌,其致病特点和感染引起疾病的临床症状与克雷伯菌类似,并与克雷伯菌属生化反应极其相似[4]。该菌可引起人类的严重感染甚至休克,还可导致胆囊炎、肺炎、菌血症、泌尿道感染等疾病[5]。植生拉乌尔菌某些菌株有较强毒力,抗菌药物治疗效果不佳[6]。从新生儿呼吸道、人泌尿道、外科手术感染和败血症感染中均有报道,鸭粪便样本中也分离到该菌[7]。本研究从四川地区某规模化猪场采集的样品中分离到1株猪源植生拉乌尔菌,将分离菌株进行鉴定和致病性试验,为该病的临床诊断和治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 病料和实验动物 样品来源于四川省成都市某猪场内患病猪的组织病料,无菌采取病死猪的肝脏、心脏和肺脏等脏器。SPF级小鼠20只,购自四川省成都市中医药研究所。
1.1.2 主要试剂和仪器 LB和Mueller-Hinton Agar培养基,青岛高科技工业园海博生物技术有限公司产品;药敏纸片,杭州微生物试剂有限公司产品;PCR聚合酶细菌基因组DNA提取试剂盒,天根生物有限公司产品;细菌生化鉴定管和药敏纸片,杭州微生物试剂有限公司产品;标准革兰氏染色试剂盒,北京雷根生物技术有限公司产品。PCR仪,德国Eppendorf公司产品;电泳仪和凝胶成像系统,美国Bio-Rad公司产品。
1.2 方法
1.2.1 细菌分离培养 无菌操作台从患病猪样品中取样,划线接种于LB培养基,置37℃恒温培养箱培养18 h,在培养基上挑取单一的菌落进行纯化培养,并进行革兰氏染色,光学显微镜下观察,记录纯化菌落的形态特征,并将获得的菌株命名为XL-01。
1.2.2 生化鉴定 参照生化管使用说明书,将已纯培养的菌液,用接种环分别穿刺接种于细菌生化鉴定管中,37℃恒温培养24 h,观察结果。参照《伯杰细菌鉴定手册》和杭州微生物试剂有限公司提供的《非发酵细菌生化鉴定编码册》进行结果判断。
1.2.3 16S rRNA扩增及进化树分析 将纯化细菌接种于LB液体培养基中进行扩增培养,置37℃恒温培养箱中振荡培养16 h,离心菌液收集沉淀,根据细菌基因组DNA提取试剂盒说明书,提取细菌总DNA。用16S rRNA通用引物(F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-CTACGGCTACCTTGTTACGA-3′)对其扩增。PCR反应体系25 μL:1.1×T3 Super PCR Mix 22 μL,DNA模板1 μL,上、下游引物各1 μL。PCR反应条件:98℃ 2 min;98℃ 10 s,55℃ 10 s,72℃ 30 s,共35个循环;72℃再延伸2 min。对PCR产物进行10 g/L琼脂糖凝胶电泳,检测为阳性PCR产物,送生工生物工程(上海)股份有限公司测序。测序完成后,将得到的序列在NCBI的Blast系统进行序列比对,提交至GenBank获取登录号。在ClustalX2.1软件中进行同源性比对,并使用MEGA5.0软件中的N-J法构建系统进化树[8]。
1.2.4 毒力基因的检测 根据文献[9-10]设计毒力基因,设计ompX、cpa、hly、sip、fimH、papC和papA共7种毒力基因,用提取的DNA模板进行扩增,PCR扩增条件依据参考文献,对PCR产物进行10 g/L琼脂糖凝胶电泳后观察结果。
1.2.5 小鼠致病性试验 将20只小鼠随机分为试验组和对照组,每组10只。试验前小鼠禁食、禁水24 h,试验组每只小鼠腹腔注射活菌液0.15 mL,调整菌液浓度为1×109CFU/mL;对照组每只小鼠腹腔注射无菌生理盐水,剂量和方法同试验组。两组分开正常饲养,连续观察7 d并对各组小鼠的发病和死亡情况进行统计。
1.2.6 病理组织切片制作 剖检死亡小鼠,取肠道、肺脏、肝脏和脾脏等组织,浸泡在40 mg/mL多聚甲醛溶液中,脱水、HE染色,光学显微镜下观察[11-12]。
1.2.7 药敏试验 用美国临床实验室标准化委员会(NCCLS)推荐的纸片扩散法(KB)测定,用药敏试剂盒的抗菌药物对细菌作药敏性和耐药表型测定。
1.2.8 耐药基因检测 按文献[13-14]设计磺胺类抗菌药物耐药基因Sul1、Sul2、Sul3,氨基糖苷类抗生素基因ant(3″) -Ⅰa、aac(6′) -Ⅰb和aph(3′) -Ⅱa,β-内酰胺类抗生素基因TEM的引物对其DNA进行扩增,PCR扩增条件依据参考文献,对PCR产物进行10 g/L琼脂糖凝胶电泳后观察结果。
2 结果
2.1 细菌分离鉴定及生化鉴定结果
菌株XL-01在LB培养基上培养18 h后,形成较小的单一菌落,革兰氏染色后为红色(图1),呈现单个或成对排列,形态为短杆状,表明XL-01菌株为革兰氏阴性菌。生化结果显示,分离菌株XL-01对蜜二糖、鸟氨酸、鼠李糖、赖氨酸和山梨醇反应为阳性,对苦杏仁苷、精氨酸双水解酶、枸橼酸钠、蔗糖和氧化酶反应为阴性。菌株XL-01与肠杆菌具有相似的表型特征,符合革兰氏阴性菌的特征。
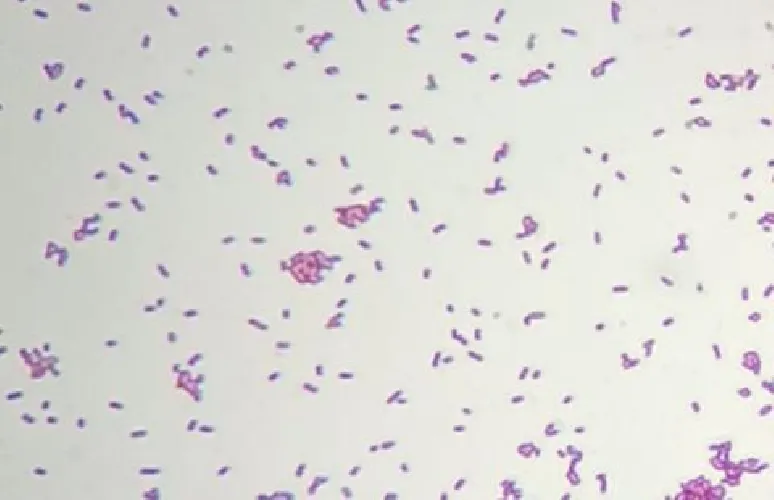
图1 XL-01菌株革兰氏染色结果(1 000×)
2.2 16S rRNA基因序列分析
分离XL-01菌株的16SrRNA基因,经PCR扩增结果见图2,将得到获得的16SrRNA基因正反测序拼接结果,获得1 458 bp的片段,提交NCBI后获得GenBank登录号为MW433720。用得到的菌株XL-01序列在NCBI中采用Blast进行分析,构建系统进化树(图3),菌株XL-01(图中“●”标记)的16S rRNA序列与植生拉乌尔菌聚为一个分支,相似性高达100%。菌株XL-01与植生拉乌尔菌(GenBank登录号:NR112011.1)同源性达95.9%。综合判断菌株XL-01为植生拉乌尔菌。
2.3 毒力基因检测结果
PCR扩增检出ompX和fimH两种毒力基因,cpa、hly、sip、papC和papA的基因并未检出。表明植生拉乌尔菌菌株携带这2种毒力基因(图4)。
2.4 临床症状及死亡情况
第1天试验组小鼠表现精神沉郁,被毛粗乱,饮食下降,眼角有分泌物,眼睛迷离、弓腰,对照组小鼠健康存活。试验组小鼠第2天开始陆续死亡,共死亡7只,发病率为100%,病死率为70%。表明该菌株致病性较强。剖检死亡小鼠,采集病样再次进行细菌分离鉴定,结果判定为植生拉乌尔菌感染。
2.5 病理组织学结果
剖检试验组死亡小鼠,可见小鼠腹腔皮下出血,脑水肿,肠道内容物呈现淡黄色液体,肝脏肿大。病理组织学观察可见心脏和脾脏无明显病变,肺脏间质充血、肺泡壁增厚、断裂(图5A);肝细胞肿胀、变性,肝窦隙扩张充血(图5B);肠道绒毛脱落、毛细血管扩张充血(图5C);肾脏中肾小管管腔狭窄,上皮细胞肿胀变性、有脱落现象(图5D和图5E);脑部可见淋巴细胞和中性粒细胞弥散性浸润(图5F)。从临床症状与病理变化的结果发现,XL-01菌株为致病菌,且对动物具有较强的致病性。
2.6 药敏试验结果
对菌株XL-01进行抗菌药物敏感性检测,菌株XL-01对诺氟沙星、阿米卡星、磷霉素、妥布霉素、环丙沙星、氧氟沙星和拉氧头孢敏感,菌株XL-01对阿莫西林、氨苄西林、头孢克肟、青霉素、链霉素和甲氧苄氨嘧啶耐药。
2.7 耐药基因检测结果
对植生拉乌尔菌的DNA进行PCR扩增,耐药基因扩增结果见图6,扩增出耐药基因TEM、Sul1、Sul2、Sul3、aac(6′)-Ⅰb和ant(3″)-Ⅰa与预期相符,耐药基因aph(3′)-Ⅱa未检出。

M.DNA 标准DL 2 000;1.菌株 XL-01;2.阴性对照 M.DNA Marker DL 2 000;1.Strain XL-01;2.Negative control
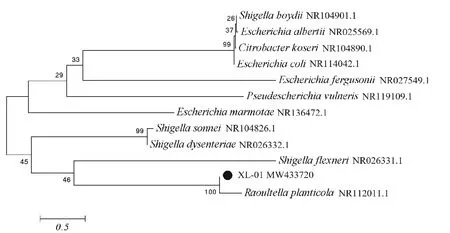
图3 基于16S rRNA基因序列的系统发育树

M.DNA 标准DL 2 000;1.ompX1;2.fimH M.DNA Marker DL 2 000;1.ompX;2.fimH
3 讨论
植生拉乌尔菌作为一种罕见的机会性病原体,常侵袭免疫功能低下的患者,有时甚至引起致命感染[15]。与克雷伯菌属相似,可感染人的各种器官,如胰腺、皮肤、肝脏、前列腺、结膜和胆囊[16]。由于植物拉乌尔菌与严重的胃肠道感染有关,肠移位是一种可能的感染方式[17]。已有报道医院环境中的非细菌液体洗手液被植生拉乌尔菌污染[18],其临床特征和结果仍有待调查。本试验腹腔攻毒死亡小鼠均出现腹腔皮下出血、脑水肿、肠道内容物呈淡黄色液体和肝脏肿大等病变,表明该植生拉乌尔菌具有较强的致病性。本试验病理组织学观察可见,肝脏中肝细胞肿胀、变性,肝窦隙扩张充血,肺脏中肺间质充血、肺泡壁增厚、断裂,与相关报道类似[1,3],但考虑到菌株的致病性强弱可能与分离地点和分离宿主等不同而异。
从腹腔壁坏死性筋膜炎患者分离的植生拉乌尔菌对氨苄西林和阿莫西林耐药[19],从中国台湾地区的肺炎和菌血症患者中分离的植生拉乌尔菌对氟喹诺酮类和氨基糖苷类敏感[20],从重症膀胱炎患者分离得到的植生拉乌尔菌对氨苄西林、环丙沙星、氨基糖苷类、碳青霉素类和磺胺类抗生物敏感[21]。2017年报道有2例心外科术后病人感染植生拉乌尔菌而休克[22]。本研究中植生拉乌尔菌对13种抗菌药物有不同程度的耐药。对7种耐药基因进行检测,该菌的氨基糖苷类和磺胺类耐药表型与耐药基因型结果大体一致,而与β-内酰胺类不一致。这可能是检测到的耐药基因未能表达转化为具有生物活性的蛋白质分子,也可能存在其他耐药机制或该菌对试验未测试β-内酰胺类有耐药表型。

A.肺脏,肺间质充血、肺泡壁增厚、断裂;B.肝脏,肝细胞肿胀、变性,肝窦扩张充血;C.肠,肠绒毛脱落、毛细血管扩张充血;D~E.肾脏,肾小管管腔狭窄,上皮细胞肿胀变性、有脱落现象;F.脑,可见淋巴细胞和中性粒细胞弥散性浸润
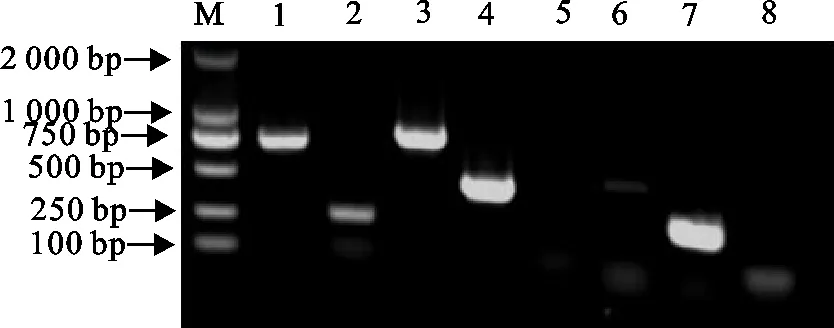
M.DNA 标准DL 2 000;1.TEMS;2.ul1;3.Sul2;4.Sul3;5.aph(3′)-Ⅱa;6.aac(6′)-Ⅰb;7.ant(3″)-Ⅰa;8.阴性对照
本研究从猪肺脏中分离出1株有较强的致病性植生拉乌尔菌,对常见的抗菌药物具有较强耐药性,为今后开展植生拉乌尔菌的致病机制和耐药性研究提供参考。
