大肠埃希菌密度感应调节子qseC基因失活突变株构建及其生物学特性
2022-04-08周青帅赵行行李冬梅崔古贞陈峥宏任玮齐晓岚洪伟
周青帅 赵行行 李冬梅 崔古贞 陈峥宏 任玮 齐晓岚 洪伟
贵州医科大学1地方病与少数民族疾病教育部重点实验室&贵州省医学分子生物学重点实验室,2贵州省普通高等学校病原生物学特色重点实验室,3免疫学教研室(贵阳550004)
大肠埃希菌是世界范围内造成炎症性肠病高发病率的重要病原体,炎症性肠病(Inflammatory bowel disease,IBD)是一种容易复发的慢性炎症性疾病,在IBD 相关的肠道黏膜活检和粪便标本中可分离出大量致病性大肠埃希菌[1-2]。病原微生物进入血液可引发血流感染(blood strean infection,BSI),BSI中儿童患者高比例检测出大肠埃希菌,在相关报道中对头孢曲松耐药率达到了32.65%,对头孢他啶耐药率为8.33%[3]。此外,植入手术后的大肠埃希菌感染成为了常见的医院内感染,由于大肠埃希菌容易在植入材料上形成生物膜,使得此类感染难以治疗[4-5]。部分外科手术中大肠埃希菌成为主要的感染源,且相应出现高耐药率[6]。
群体感应系统(quorum sensing system,QS)在诱导物作用下调节种群数量和基因表达,使其更好的适应生存环境[7]。QS 在诱导信号分子产生、释放达到一定的阈值后,细菌受体蛋白感知信号后调节自身基因的表达,改变细菌的表型,包括细菌的毒力、生物膜的形成、运动能力的改变,以及对药物的抗性等[8-10]。大肠埃希菌密度调节子C(quorum sensingE.coliregulator C,qseC)是典型的革兰阴性菌中的QS,属于大肠埃希菌qseBC 双组分系统,qseC 基因大小约为1.3 kb,编码组氨酸蛋白激酶,是该双组分系统中负责感应识别外部信号分子的受体部分[11-12],有研究人员发现qseC的缺失会干扰qseB的去磷酸化,从而释放出一个不受控制的正反馈回路,下调毒力基因的表达[13]。在体外,使用qseC抑制剂能阻断qseBC 的信号传递,使用抑制剂LED209 能降低肠出血性大肠埃希菌的毒力[14]。qseC基因在大肠埃希菌毒力扮演着重要的地位,但qseC基因对大肠埃希菌其他表型影响尚未清楚。
二型内含子(Group ⅡIntron)是由核酶活性的RNA 和IEP 蛋白(Intron encoded protein)组成,是可以在基因组中移动的核糖核蛋白复合物(RNPs),被开发为基因靶向失活工具[15-16]。课题组利用嗜热聚球藻(Thermosynechococcus elongatus)中的TeI3c∕4c 二型内含子,开发了受温度诱导的基因打靶系统(Thermotargetron 系统)[17],可在42℃~48℃工作,高效失活靶基因。本研究首先利用Thmotargetron系统,靶向失活大肠埃希菌HMS174 菌株qseC基因,构建其突变株。接下来,测定ΔqesC突变株的生长速率、溶血、生物膜形成、运动能力的变化,以及对酸碱和抗生素抗性等表型变化,加深对qseC基因功能的认识。
1 材料与方法
1.1 培养基及培养条件 大肠埃希菌HMS174 和NEBExpres 感受态细胞均在LB 培养基37 ℃培养,LB 液体培养基配制:酵母提取物(Yeast extract)0.5%,胰蛋白胨(Tryptone)1%,氯化钠(NaCl)1%,固体培养基中加入1.5%的琼脂粉(Agar Powder)。用浓度10 μg∕mL的氯霉素筛选大肠埃希菌转化子。
1.2 主要试剂 高保真DNA 聚合酶和1 kb plus DNA Maker 购自诺唯赞生物科技股份有限公司(Vazyme Biotech,南京),限制性内切酶SpeⅠ-HF和BsiWⅠ-HF 购自New England Biolabs(NEB,北京),PCR 产物回收试剂盒及质粒提取试剂盒购自天根生化科技有限公司(TIANGEN,北京)。氯霉素、氨苄青霉素、四环素、阿莫西林、甲硝唑、诺氟沙星等抗生素购自北京索莱宝公司(Solarbio,北京)。琼脂糖凝胶回收试剂盒和质粒小提试剂盒购自北京天根公司,所有引物由生工生物工程股份有限公司合成(Sangon Biotech,上海)。
1.3 打靶引物设计及质粒和菌株 首先获取目的基因序列,从NCBI 数据库中下载大肠埃希菌HMS174 的基因组数据,找到打靶的目的基因qseC序列信息。然后根据嗜热二型内含子TeI3c∕4c Intron识别插入位点的规律(5′-AAnnnnnnnnnnnnnA-3′,n 为ATGC 任意4 种碱基)[17],设计四条打靶引物。qseC 基因正义链第627 位点符合该规律。根据该位点设计4 条打靶引物,分别为qseC627s-IBS12、qseC627s-IBS2s、qseC627s-IBS1a、TeI3c-UNV,详细的序列信息见表1。本研究所用的菌株和质粒见表2。

表1 本研究所需引物Tab.1 Primers used in this study

表2 本研究所需要的质粒和菌株Tab.2 Plasmids and strains used in this study
1.4 Thermotargetron 打靶载体构建 以pHKTT1A 载体为模版[17],qseC627s-IBS12∕TeI3c-UNV 和qseC627s-EBS12∕qseC627s-EBS1a 引物对扩增获得突变的TeI3c∕4c Ⅱ型内含子,该内含子中的IBS12,EBS1 和EBS2 识别序列突变为可特异性识别qseC基因627s 位点的序列。胶回收上一轮PCR 产物,以其为模板、qseC627s-IBS12∕qseC627s-EBS1a 为引物进行PCR 反应,使用T5 exonuclease-dependent assembly(TEDA)将打靶片段与双酶切回收产物连接将两个打靶片段连接为完整打靶片段qseC627s-Intron。SpeⅠ-BsiWⅠ双酶切pHK-TT1A 载体,胶回收5887 bp 片段后与qseC27s-Intron 连接获得qseC-627s 打靶载体pHK-TT1A-qseC627s。
1.5 突变株筛选和计算打靶效率 将打靶质粒pHK-TT1A-qseC627s 转化进入HMS174,涂布于LB氯霉素抗性平板(LB-CHL),长出转化子后将转化子接种至LB-CHL 液体培养基,培养菌液OD600=0.6时,取1 mL 菌液经48℃培养1 h 后吸取10 μL 稀释100 倍涂布于氯霉素抗性平板,37℃培养过夜。待长出菌落后使用检测引物DPqseC-F 和DPqseC-R进行菌落PCR 检测qseC 基因是否打靶成功(插入失活突变株PCR 条带比野生性菌株大839 bp)。使用引物为DPjunction-U 和DPjunction-D 将检测成功的菌株送至上海生工公司进行基因测序。将测序正确的菌株使用阴影平板法进行质粒丢失。
1.6 生长速率测定 将50 μL 野生型HMS174 菌液和ΔqseC突变株菌液接种至5 mL LB 培养基中,220 r∕min,37℃震荡培养。每隔3 h 测定一次野生型和突变株菌液OD600值,连续测定24 h。此实验做三次独立重复,根据测定的数值绘制野生型和突变株的生长曲线。
1.7 溶血能力测定 将野生型HMS174和ΔqseC突变株的单菌落接种至5 mL TSB培养基中,220 r∕min,37 ℃培养24 h,然后12 000 r∕min 离心1 min 收集菌液,用新鲜的TSB 培养基重悬菌液,OD 仪调整OD600至0.1,然后取5 μL 菌液滴在BTSB 平板上(含有5%(V∕V)脱脂绵羊血),37 ℃正置培养24 h 观察并测量溶血斑的大小。
1.8 生物膜形成测定 将野生型HMS174和ΔqesC突变株单菌落接种至5 mL LB培养基中,220 r∕min,37℃培养过夜,取500 μL 菌液稀释到4.5 mL 新鲜LB中,220 r∕min,37 ℃培养至OD600为0.8。取200 μL上一步培养菌液至96 孔板中,37 ℃培养24 h,另外以空白的M9培养基作为对照组。小心吸取96孔板中的培养基,用PBS 清洗3 次,用4%的多聚甲醛固定15 mim,结晶紫染色10 min,然后用双蒸水清洗3 次,室温干燥后加上200 μL 33%的冰醋酸将结晶紫溶解,用酶标仪测定其OD600值。参照对生物膜判定原则[18],即空白对照组的平均值加上三倍标准差的值为临界值(Cut-Off value,DC),D<DC不黏附,DC<D<2DC 为弱黏附,2DC<D<3DC 为中等黏附,D>3DC 为强黏附。
1.9 运动能力测定 参考文献中的方法[19],用无菌的牙签将野生型HMS174 和ΔqesC突变株菌液穿刺至0.4%琼脂浓度的(W∕V)半固体LB 培养基中,37 ℃培养12 h,观察菌圈的大小并测量其直径。形成的菌圈越大,表示该菌的运动越强,形成的菌圈越小则表示该菌的运动能力越弱,以此比较野生型菌株和qseC突变株的运动能力。
1.10 pH 敏感性测定 在玻璃试管中加入5 mL无菌的LB 培养基,使用3 mol∕L 的盐酸(HCl)和氢氧化钠(NaOH)调节pH 值。得到pH 值为:1、2、3、4、5、6、7、8、9、10、11、12 的LB 培养基,分别将野生型菌株和qseC 突变株接种上述培养基,220 r∕min,37 ℃震荡培养6 h,测量OD600值[20]。
1.11 抗生素敏感性测定 使用连续稀释法[21]测定野生型菌株和qseC突变株对氯霉素(Chloramphenicol)、氨苄青霉素(Ampicillin)、四环素(Tetracycline)、阿莫西林(Amoxicillin)、甲硝唑(Metronidazole)、诺氟沙星(Norfloxacin)等抗生素的耐药性。微量琼脂稀释法的步骤为:在96 孔板中加入150 μL 的LB 培养基,然后在第一孔设置抗生素浓度为128 μg∕mL,然后连续2 倍稀释10 次至浓度为0.25 μg∕mL,依次得到的抗生素浓度为128、64、32、16、8、4、2、1、0.5、0.25 μg∕mL,每孔接种10 μL野生型菌液或qseC 突变株菌液。野生型菌株和qseC突变株分别设置3 个重复组,同时添加阴性对照组(只有LB 培养基)和阳性对照组(菌液接种至无抗生素的LB 培养基中)。将96孔板置于37 ℃培养12 h 后,使用酶标仪测定OD600值,统计数据后使用prism 8.0 作抗生素敏感性图。
1.12 统计学方法 使用prism 8.0 制作统计学图表,使用独立样本t检验方法分析是否具有统计学差异,P<0.05 表示差异有统计学意义。
2 结果
2.1 突变株筛选和计算打靶效率 在48 ℃诱导基因打靶后,随机挑取的23 个菌落,菌落PCR 检测后计算打靶效率为100%(图1A,野生型vs.失活突变株=1 350 bpvs.2 189 bp)。ΔqseC627s 测序结果,与野生型HMS174 基因组中qseC基因进行序列比对后,表明TeI3c∕4c 内含子(839 bp)成功插入大肠埃希菌基因组qseC627s 位点,测序结果表明qseC基因成功失活(图1B)。

图1 突变株筛选及打靶位点测序验证Fig.1 Mutants screening and verification
2.2 大肠埃希菌HMS174 和ΔqseC627s 生物学特性比较
2.2.1 生长速率变化 如图2 所示,测定了野生型菌株和qseC627s 的生长动力学差异。野生型菌株和ΔqseC627s 在接种3 h 前生长速率差异不大,在3 h 后野生型的生长速度明显快于ΔqseC627s。ΔqseC627s 在15 h 后生长进入平稳期,最大OD600值为3.0,野生型菌株在15 h 后仍然继续生长,OD600达到了4.0 以上,表明了qseC基因失活后菌株的生长速度减慢,且菌株生长达到的最大生物量降低。
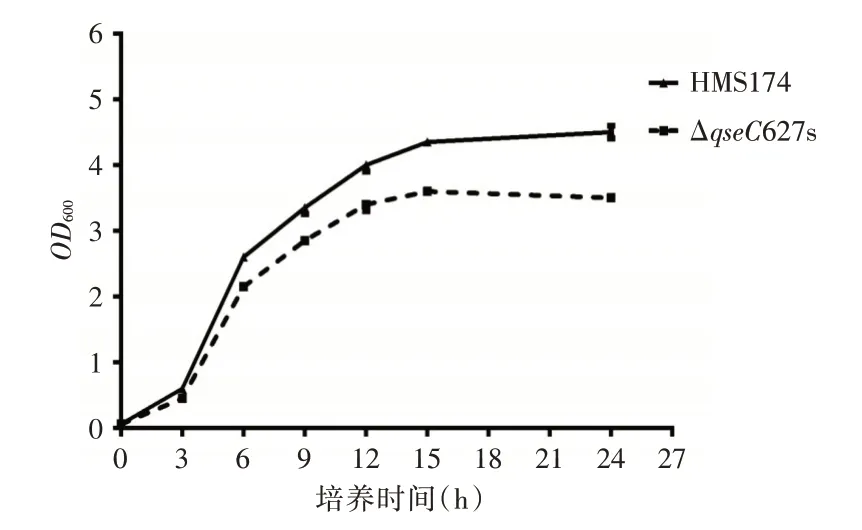
图2 野生型HMS174 和ΔqseC627s 生长速率比较eFig.2 Growth rate of wild-type HMS174 and ΔqseC627s strains
2.2.2 溶血能力变化 如图3所示,在BTSB平板上野生型HMS174 和ΔqseC627s 溶血能力有差异性。图3A 黄色箭头所示,野生型大肠埃希菌HMS174产生了一层颜色略浅的溶血圈,而ΔqseC627s 没有出现颜色略浅的溶血圈(图3B)。表明大肠埃希菌HMS174qseC基因与其溶血能力相关,当qseC基因失活后其溶血能力消失。

图3 野生型HMS174 和ΔqseC627s 溶血能力Fig.3 Hemolytic ability of wild-type HMS174 and ΔqseC627s
2.2.3 生物膜形成能力变化 如图4 所示,野生型HMS174 的生物膜黏附性为强黏附,ΔqseC627s 的生物膜黏附性也为强黏附,但是ΔqseC627s 和野生型HMS174 相比,生物膜形成减少明显(P<0.01),表明qseC基因参与了大肠埃希菌生物膜形成过程,对其生物膜的形成具有正向调节作用。
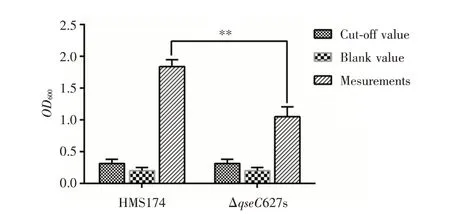
图4 野生型HMS174 和ΔqseC627s 生物膜形成能力Fig.4 Biofilm formation of wild-type HMS174 and ΔqseC627s strain
2.2.4 运动能力变化 37 ℃培养12 h 后,野生型大肠埃希菌HMS174 和ΔqseC627s 突变株在平板形成了圆形菌落圈,通过测量两者菌落圈的直径,野生型HMS174 和ΔqseC627 突变株直径分别为(36.67±1.15)mm 和(11±1.0)mm(图5A),统计学分析野生型大肠埃希菌HMS174 和ΔqseC627s 突变株菌落大小差异极显著(P<0.01)。表明qseC可以影响大肠埃希菌HMS174的运动能力(图5B)。

图5 野生型HMS174 和ΔqseC627s 运动能力比较Fig.5 Motility of wild-type HMS174 and ΔqseC627s strain
2.2.5 野生型HMS174 和ΔqseC627s 不同pH 耐受能力变化 野生型HMS174 和ΔqseC627s 在pH 值为5 ~8 之间均能生长(图6),但是ΔqseC627s 的耐受能力较HMS174 降低显著(P<0.01)。

图6 野生型HMS174 和ΔqseC627s pH 耐受性Fig.6 pH tolerance of HMS174 and ΔqseC627s strain
2.2.6 抗生素耐药性变化 图7A-图7F 依次为HMS174 和ΔqseC627s 对于氯霉素等抗生素的耐受性结果。ΔqseC627s 较野生型对氯霉素、氨苄青霉素、四环素、阿莫西林、甲硝唑等抗生素耐受性降低,对诺氟沙星敏感性无明显变化。

图7 野生型HMS174 和ΔqseC627s 对6 种抗生素的耐受性测定Fig.7 Resistance of HMS174 and ΔqseC627s to 6 antibiotics
3 讨论
大肠埃希菌感染已成为常见的病原微生物感染类型,在腹泻患者中检测到大量的腹泻性大肠埃希菌,该菌已成为主要的腹泻病原菌[22]。碳青霉烯类抗生素作为治疗大肠埃希菌感染首选药物之一,近年来广泛的使用,导致大肠埃希菌对此类抗生素耐药性持续增加[23]。密度感应系统参与微生物发光、产孢、耐药性、生物膜和毒力因子分泌等生命过程,受到研究者的广泛关注[24-25]。密度感应系统是一种细菌细胞间的通信机制,包括细胞外诱导剂信号分子的产生、检测和响应。本研究使用Thermotagetron 系统,成功构建了大肠埃希菌HMS174 密度调节子(qseC)基因失活突变株,通过对比研究野生型菌株与ΔqseC627s 的表型差异,鉴定qseC 基因的生理功能。
我们发现,与野生型菌株相比,ΔqseC627s 突变株的生长能力变弱,溶血能力丧失,运动能力与生物膜形成能力显著降低,以上表型与大肠埃希菌致病力密切相关,可见qseC基因对大肠埃希菌的致病力具有重要贡献。革兰阴性菌的溶血能力受到细菌第六型分泌系统(Type ⅥSecretion Systems,T6SS)的调控,并反馈调节T6SS 系统[26],qseC基因的缺失可能使T6SS 系统无法分泌溶血蛋白,造成ΔqseC627s 溶血能力消失。在哈维支弧菌(Vibrio harveyi)中群体感应系统影响其鞭蛋白合成[27],大肠埃希菌的鞭毛是其运动器官和宿主黏附因子,qseC 基因的缺失,可能造成鞭毛蛋白合成受阻,导致其运动能力降低。ΔqseC627s 突变株生物膜形成能力显著降低,由于生物膜是大肠埃希菌对抗外界环境的保护性结构。生物膜合成受阻,可能是大肠埃希菌对酸碱的耐受性和对抗生素耐受性降低的原因。例如在金黄色葡萄球菌(Staphylococcus aureus)中,生物膜与其毒力和耐药性密切相关[28]。综上所述,qseC基因失活后,大肠埃希菌致病相关表型减弱、致病力降低,因此qseC基因可作为治疗大肠埃希菌感染的潜在靶点。
