补充维生素A对缺铁性贫血大鼠妊娠后贫血情况和子代的影响▲
2022-04-08崔丽娟彭志美
崔丽娟 薛 洁 彭志美
(河北省邯郸市第一医院产科,邯郸市 056000,电子邮箱:gapah_310112845@163.com)
铁是人体重要的微量元素之一,是合成血红蛋白的重要成分,所以铁缺乏极易造成缺铁性贫血(iron deficiency anemia,IDA)。IDA是妊娠期女性最常见的营养缺乏性疾病,会造成早产、新生儿低出生体重等不良后果[1]。有研究显示,妊娠期铁缺乏会严重影响子代的生长发育和神经功能,而及时外源性补充铁可以有效地改善妊娠结局[2]。
维生素A在维持机体生长发育、铁代谢平衡等方面均发挥重要作用[3]。生长激素(growth hormone,GH)由垂体分泌,受生长激素释放激素和生长抑素的调节,可通过促进肝脏分泌胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)调控生长和发育[4]。此外,GH/IGF-1轴还对贫血的发生有一定的影响[5]。因此,本研究观察补充维生素A对IDA雌鼠妊娠期贫血状况和子代生长、发育与铁代谢的影响。
1 材料与方法
1.1 实验动物 健康清洁级Wistar雌性大鼠30只,6周龄,体重140~160 g;雄性大鼠15只,6周龄,体重150~170 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2018-0001。本实验经邯郸市第一医院医学伦理委员会审批(审批号:HDSDYYY20190152)。
1.2 试剂和仪器 维生素A购自美国Sigma公司(批号:5.00849);标准饲料和低铁饲料购自南通特洛菲饲料科技有限公司(货号:TP0306C、TP0306);RNA提取试剂盒和反转录试剂盒购自美国Thermo公司(批号:10296010、K1622);RIPA裂解液和二喹啉甲酸试剂盒购自上海碧云天生物科技有限公司(批号:P0013;P0011);可溶性转铁蛋白受体(soluble transferrin receptor,sTfR)、血清铁蛋白酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海仁捷生物科技有限公司(批号:RJ13215、RJ-16112);转铁蛋白受体1(transferrin receptor 1,TfR1)、铁蛋白轻链(ferritin light chain,FTL)、铁调素及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Abcam公司(批号:ab269513、ab69090、ab187778、ab8245);辣根过氧化物酶标记的山羊抗兔二抗购自北京索莱宝生物科技有限公司(批号:SE132)。全自动血细胞分析仪购自广东省深圳迈瑞生物公司(型号:BC-5390CRP);实时定量PCR仪购自北京六一生物科技有限公司(型号:WD-9402A);多功能酶标仪购自美国Bio-Rad公司(型号:1681130A)。
1.3 IDA孕鼠模型制备及维生素A补充治疗 适应性饲养1周后,将30只雌性大鼠随机分为对照组(10只)和缺铁组(20只)。分别给予对照组、缺铁组标准饲料、低铁饲料喂养,其中低铁饲料的主要成分为全脂奶粉(68.0%)、葡萄糖(22.0%)、酪蛋白(6.0%)、混合盐(4.0%)、混合维生素(0.3 g/kg)(包括维生素A、维生素C、维生素D、维生素E、维生素K、维生素B1、维生素B2、维生素B6、维生素B12和烟酸、泛酸、叶酸,其中维生素A含量≥14 000 IU/kg,维生素D和维生素E分别≥1 500 IU/kg和120 IU/kg)。4周后,将30只雌性大鼠与15只雄性大鼠以2 ∶1的比例合笼饲养;次日清晨观察雌鼠阴道口,若出现阴栓,则为成功受孕,记为孕第0天。本研究中所有雌鼠均成功受孕。将受孕后的雌鼠分笼饲养,缺铁组孕鼠仍用低铁饲料喂养,对照组孕鼠仍用标准饲料喂养,直至分娩。在孕第0天将缺铁组20只雌性大鼠随机分为模型组和治疗组,每组10只。从孕第1天开始,治疗组大鼠灌胃维生素A[200 μg/(kg·d),溶于油溶液]5 mL/(kg·d),对照组和模型组仅灌胃油溶液5 mL/(kg·d),均1次/d,直至分娩。
1.4 血液学指标的检测 分别在分组喂养前和分组喂养4周后及孕末期(孕17 d)3个时间点,采集各组雌鼠眼内眦静脉血2 mL,使用全自动血细胞分析仪检测血红蛋白、血细胞比容(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞分布宽度(red blood cell distribution width,RDW)。
1.5 仔鼠一般资料的收集 统计各组存活仔鼠出生体重、活胎数、死胎数,计算仔鼠存活率。
1.6 雌鼠和仔鼠血清铁蛋白和sTfR水平的测定 分组喂养前、分组喂养4周后及孕末期3个时间点,采集雌鼠眼内眦静脉血2 mL;根据随机数字表法,从每组存活的仔鼠中取10只,出生后颈椎脱臼法处死(本研究全部用此方法处死),采集主动脉血2 mL。常温环境下,将血标本离心10 min(3 000 r/min,离心半径为8 cm),收集上清液。ELISA法检测血清铁蛋白和sTfR含量。分别设置空白孔、标准孔和样品孔。经酶标包被的96孔板空白孔加50 μL 磷酸缓冲盐溶液,标准孔加50 μL标准品,样品孔加40 μL样品稀释液,再加10 μL待测样品。锡纸封板后37℃孵育30 min,洗涤液洗板5次,30 s/次。除空白孔外,其余孔加50 μL酶标试剂,37℃孵育30 min,洗涤液洗板5次,30 s/次。各孔先加A显色剂50 μL,再加B显色剂50 μL,振荡混匀后封板,37℃避光孵育10 min。加入50 μL终止液终止反应,5 min后置于酶标仪上测定波长450 nm处吸光度值。
1.7 雌鼠垂体中GH和肝脏中IGF-1 mRNA相对表达水平的检测 雌鼠自然分娩后,各取10只处死,无菌条件下取雌鼠垂体和部分肝组织,采用实时定量PCR法检测垂体中GH和肝脏中IGF-1 的mRNA相对表达水平。根据RNA提取试剂盒说明书步骤,提取垂体和肝组织中总RNA,以500 ng总RNA作为模板,利用反转录试剂盒将RNA逆转录成cDNA。配制PCR反应体系,包括10 μL SYBR GreenⅠ、正反向引物各1.4 μL、2 μL cDNA模板、6.6 μL无酶水。反应条件:95℃预变性2 min,95℃变性30 s,60℃延伸10 s,共40个循环,所有样品均重复操作3次。以GAPDH为内参,采用2-△△CT法计算GH和IGF-1 mRNA相对表达水平。GH和IGF-1的引物序列见表1。

表1 引物序列
1.8 仔鼠肝组织中TfR1、FTL、铁调素的蛋白相对表达水平的检测 无菌条件下取仔鼠10只处死后取部分肝组织,液氮中研磨,加入RIPA裂解液1 mL冰上静置30 min。根据二喹啉甲酸试剂盒说明书测定蛋白浓度,加入蛋白上样缓冲液,100℃煮沸10 min使蛋白质变性。配制浓缩胶和分离胶,蛋白上样20 μL,120 V恒压电泳2 h,0.3 A恒流湿转2 h,结束湿转。室温封闭1 h,TfR1、FTL、铁调素和GAPDH一抗(1 ∶1 000)4℃孵育过夜,TBST洗膜3次,5 min/次,辣根过氧化物酶标记的山羊抗兔二抗(1 ∶5 000)室温孵育2 h,TBST洗膜3次,5 min/次。采用化学发光法显色,Image J软件分析蛋白条带灰度值,目的蛋白条带灰度值与GAPDH蛋白条带灰度值的比值为目的蛋白相对表达水平。
1.9 统计学分析 用SPSS 21.0软件进行统计学分析。计量资料均以(x±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间比较采用独立样本t检验,组内前后对比采用配对t检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组雌鼠的血液学指标的比较 分组喂养前,对照组和缺铁组大鼠血液学指标差异均无统计学意义(均P>0.05);分组喂养4周后,对照组各个指标与分组喂养前比较,差异均无统计学意义(均P>0.05),但缺铁组血红蛋白、HCT、MCV、MCH和MCHC均低于分组喂养前和对照组,RDW高于分组喂养前和对照组(均P<0.05)。见表2。
在孕末期,对照组、模型组和治疗组大鼠血液学指标差异均有统计学意义(均P<0.05)。对照组、治疗组、模型组血红蛋白、HCT、MCV、MCH和MCHC均依次降低,RDW依次升高(均P<0.05)。见表3。

表2 分组喂养前后对照组和缺铁组大鼠血液学指标的比较 (x±s)
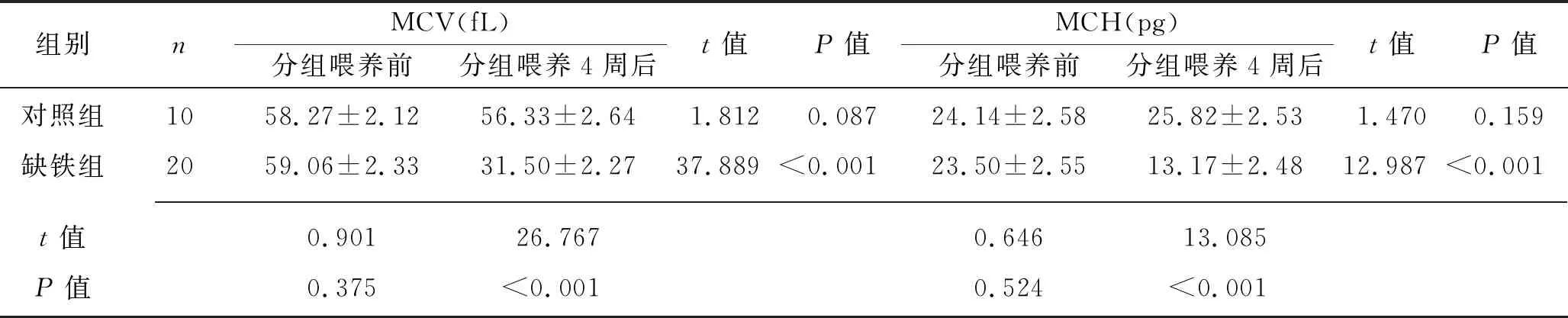
组别nMCV(fL)分组喂养前分组喂养4周后t值P值MCH(pg)分组喂养前分组喂养4周后t值P值对照组1058.27±2.1256.33±2.641.8120.08724.14±2.5825.82±2.531.4700.159缺铁组2059.06±2.3331.50±2.2737.889<0.00123.50±2.5513.17±2.4812.987<0.001 t值0.90126.7670.64613.085P值0.375<0.0010.524<0.001

组别nMCHC(g/L)分组喂养前分组喂养4周后t值P值RDW(%)分组喂养前分组喂养4周后t值P值对照组10326.17±15.80331.64±15.400.7840.44314.22±1.5315.30±2.041.3390.197缺铁组20325.44±16.69301.47±16.384.584<0.00114.15±2.0228.70±3.1117.546<0.001 t值0.1154.8470.09612.309P值0.909<0.0010.924<0.001
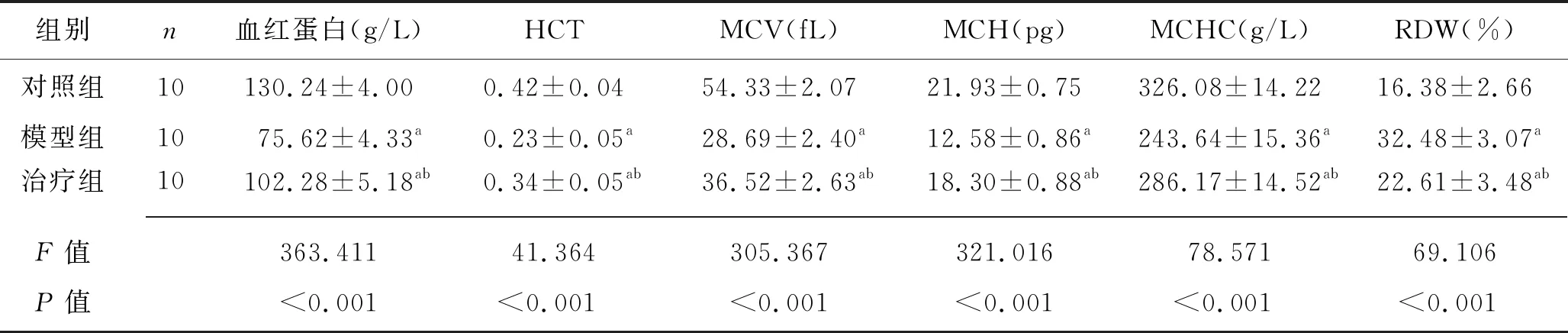
表3 孕末期对照组、模型组和治疗组大鼠血液学指标的比较 (x±s)
2.2 各组雌鼠血清铁蛋白和sTfR水平的比较 分组喂养前,对照组和缺铁组大鼠血清铁蛋白和sTfR水平差异均无统计学意义(均P>0.05);分组喂养4周后,对照组大鼠血清铁蛋白和sTfR水平与分组喂养前比较,差异均无统计学意义(均P>0.05),但缺铁组大鼠血清铁蛋白水平低于分组喂养前和对照组,sTfR水平高于分组喂养前和对照组(均P<0.05)。见表4。
孕末期,3组大鼠血清铁蛋白和sTfR水平差异均有统计学意义(均P<0.05)。对照组、治疗组、模型组血清铁蛋白水平依次降低,而血清sTfR水平依次升高(均P<0.05)。见表5。

表4 分组喂养前后对照组和缺铁组大鼠血清铁蛋白和sTfR水平的比较 (x±s)

表5 孕末期对照组、模型组和治疗组大鼠血清铁蛋白和sTfR水平的比较(x±s)
2.3 对照组、模型组和治疗组仔鼠一般情况的比较 对照组、治疗组、模型组仔鼠的存活率、存活仔鼠出生体重均依次降低(均P<0.05),见表6。

表6 对照组、模型组和治疗组仔鼠一般情况的比较
2.4 对照组、模型组和治疗组仔鼠的血清铁蛋白和sTfR水平的比较 对照组、治疗组、模型组仔鼠的血清铁蛋白水平依次降低,而sTfR水平依次升高(均P<0.05),见表7。

表7 对照组、模型组和治疗组仔鼠血清铁蛋白和sTfR含量的比较 (x±s)
2.5 对照组、模型组和治疗组雌鼠GH和IGF-1的mRNA相对表达水平的比较 对照组、治疗组、模型组雌鼠垂体组织中GH和肝组织中IGF-1的mRNA相对表达水平均依次降低(均P<0.05),见表8。

表8 对照组、模型组和治疗组雌鼠GH和IGF-1的mRNA相对表达水平的比较(x±s)
2.6 对照组、模型组和治疗组仔鼠肝组织中TfR1、FTL和铁调素的蛋白相对表达水平的比较 对照组、治疗组、模型组仔鼠肝组织中FTL、铁调素的蛋白相对表达水平依次降低,而TfR1的蛋白相对表达量依次升高(均P<0.05),见表9和图1。

表9 对照组、模型组和治疗组仔鼠肝脏组织中TfR1、FTL、铁调素的蛋白相对表达水平的比较(x±s)
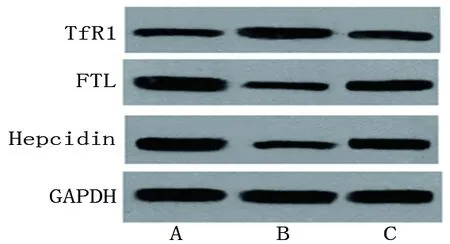
图1 肝脏中各蛋白表达
3 讨 论
IDA是目前发病率最高的微量元素缺乏症之一[6],是造成不良妊娠结局的重要原因之一,同时可严重影响子代的生长发育。维生素A是一种脂溶性维生素,是促进机体生长发育必需的微量营养物质,其可影响机体的铁代谢平衡[3]。一项涉及488对母亲-新生儿的调查研究显示,维生素A缺乏可导致孕妇血红蛋白水平降低,增加孕妇发生贫血的风险,而且新生儿出生体重偏低[7]。由此可见,维生素A缺乏可影响铁代谢,导致孕妇出现贫血,并影响子代的生长发育。临床研究表明,补充维生素A还可调节孕妇和哺乳期妇女的铁代谢平衡[8]。而动物实验表明,在饲料中添加维生素A可增加幼鹅肝组织中维生素A的水平,促进其生长与发育[9];在妊娠后期补充维生素A可以增加子代牛的出生体重和促进子代牛肌肉的发育[10]。但是补充维生素A对IDA患者妊娠期贫血状况和对其子代的影响仍需进一步探讨。
血红蛋白、HCT、MCV、MCH、MCHC、RDW是检测贫血的常用指标,血清铁蛋白和sTfR常用于评价机体铁营养状况。本研究分组喂养雌鼠4周后,缺铁组雌鼠血液中血红蛋白、HCT、MCV、MCH、MCHC和血清铁蛋白水平均低于分组喂养前和对照组,RDW和血清sTfR含量高于分组喂养前水平和对照组(P<0.05),说明成功建立IDA雌鼠模型。在雌鼠受孕后,给予部分IDA雌鼠灌胃维生素A治疗,结果显示,治疗组雌鼠的血红蛋白、HCT、MCV、MCH、MCHC和血清铁蛋白水平均高于模型组,RDW和血清sTfR水平低于模型组(P<0.05),提示外源性补充维生素A可提高IDA雌鼠妊娠期机体的铁含量,从而改善其贫血状况。
GH是一种具有多种生理功能的生长调节激素。研究表明,母体或新生儿暴露于二噁英环境时GH分泌降低,导致生长迟缓,引起生长发育障碍,而补充GH可以改善二噁英造成的毒性反应[11]。IGF-1是一种肽类激素,主要在肝脏合成,受垂体分泌的GH调节;IGF-1通过与其受体结合,调控细胞的增殖、分化和机体的生长、发育。因此,GH/IGF-1轴在促进机体生长与发育方面具有重要作用。此外,还有研究表明,GH水平的降低与红细胞、血红蛋白和HCT的降低密切相关,GH缺乏严重影响儿童造血功能[12]。IGF-1水平也与血红蛋白水平呈正相关[13]。由此可见,GH、IGF-1水平降低还与贫血密切相关。有学者发现,与使用标准饲料喂养的大鼠比较,使用维生素A缺乏的饲料喂养生长期大鼠10周后血清GH和IGF-1水平明显降低,认为维生素A可显著地影响血清GH和IGF-1的表达[14]。因此,我们推测维生素A改善IDA的作用可能与调控GH/IGF-1轴有关。基于此,本研究检测雌鼠垂体和肝脏组织中GH和IGF-1的mRNA相对表达水平,结果显示,模型组雌鼠垂体和肝脏组织中GH和肝脏组织中IGF-1的mRNA相对表达水平与治疗组和对照组相比降低,而补充维生素A的治疗组雌鼠GH和IGF-1的mRNA相对表达水平与模型组相比升高(P<0.05),这表明维生素A可能通过调节GH/IGF-1轴促进机体造血,改善妊娠雌鼠的IDA。
本研究中,我们还观察了各组仔鼠存活率,以及存活仔鼠的出生体重、血清铁蛋白和sTfR含量,结果显示,与对照组和治疗组相比,模型组仔鼠存活率、出生体重降低,血清铁蛋白水平降低而sTfR水平升高(均P<0.05),这说明雌鼠发生IDA可导致子代的低存活率和低出生体重;而与模型组相比,补充维生素A的治疗组仔鼠存活率、出生体重均升高,血清铁蛋白水平升高、sTfR水平降低(均P<0.05),这提示补充维生素A可以提高IDA孕鼠的子代存活率,调节子代机体的铁平衡,保证其正常的生长发育。
铁调素是调节肠道铁吸收的重要因子;转铁蛋白受体在铁的运输、转化和利用过程中起关键作用;铁蛋白有重链和轻链两种亚基,重链发挥氧化铁离子的作用,具有亚铁氧化酶活性,轻链在铁离子核化中具有重要作用,可以维持铁蛋白稳定性。研究显示,TfR1通过介导不同转铁蛋白的内吞作用转运铁,而且TfR1特异性敲除小鼠的死亡率明显增高,TfR1缺陷会阻碍造血前体细胞的增殖和分化,降低造血干细胞的再生潜能[15]。肝细胞中TfR1缺乏会降低肝细胞从转铁蛋白中对铁的吸收率,同时TfR1通过微调铁调素,调节肝细胞铁负荷,维持机体铁稳定[16]。铁调素可以降低铁转运蛋白的表达,抑制脑出血后铁积累介导的神经毒性,还可以降低2型糖尿病大鼠海马铁沉积,从而改善大鼠认知功能障碍[17-18]。由此可见,TfR1、FTL和铁调素是调节机体和细胞铁代谢的重要因子,可以维持铁元素处于稳定状态。本研究取仔鼠肝脏,采用蛋白质印迹法检测TfR1、FTL和铁调素的蛋白相对表达水平,结果显示模型组FTL和铁调素的蛋白相对表达水平降低,TfR1的蛋白相对表达水平较对照组和治疗组升高,而治疗组FTL和铁调素的蛋白相对表达水平较模型组升高,TfR1的蛋白相对表达水平降低(均P<0.05)。这提示给予IDA雌鼠补充维生素A,有利于调节仔鼠体内铁代谢相关蛋白的表达,从而维持仔鼠的铁代谢平衡,以促进其正常的生长发育。
综上所述,补充维生素A可改善IDA大鼠妊娠期的贫血状况,这可能与其通过调节GH/IGF-1轴改善机体造血功能有关;同时,给予孕鼠补充外源性维生素A还可通过调节子代体内铁代谢相关蛋白的表达维持铁代谢平衡,从而促进子代生长发育。这或可为IDA孕妇或妊娠期IDA的临床干预提供一定的依据。
