IL-8在人肺上皮细胞的MUC5B表达及调控通路*
2022-04-08蒋海燕肖玉蓉谭小武
蒋海燕 陈 林 邵 春 肖玉蓉 谭小武
南华大学衡阳医学院附属第二医院呼吸与危重症医学科,湖南省衡阳市 421001
慢性阻塞性肺疾病(COPD)是一种气流受限不完全可逆、进行性发展的疾病,气道炎症和黏液高分泌相互影响加速了气流受限的发展,加重疾病的进程[1]。其气道黏液的主要成分是黏蛋白5B(MUC5B), MUC5B表达上调是COPD气道区别于哮喘的特征性表现[2]。白细胞介素8(IL-8)是一种重要的趋化因子,趋化COPD气道局部的炎性细胞加重气道炎症,在一定程度上反映COPD气道炎症的严重程度[3]。然而IL-8是否对气道黏液高分泌有作用,是通过什么信号途径调节MUC5B的表达参与COPD发病目前尚未明确[4-5]。本实验拟IL-8干预、JAK2/STAT6阻断剂、MUC5B抑制剂预处理的人气道上皮细胞,分别检测IL-8、STAT6、JAK2、MUC5B的表达水平,以明确IL-8对MUC5B的表达调控通路,为筛选COPD黏液高分泌的治疗靶点提供新思路。
1 材料及方法
1.1 主要实验仪器及试剂 KM培养基购自Sciencell;AG490试剂购自APExBIO;NAC溶液(乙酰半胱氨酸)购自美国Sigamags公司;MUC5B-ELISA试剂盒购自武汉华美生物工程有限公司(E16039046);HRP标记的抗鼠IgG、HRP标记的抗兔IgG购自美国proteintech(SA00001-1);IL-8(ab259397)、兔抗人JAK2(ab108509)、p-JAK2(ab3210)、STAT6(ab32520)、p-STAT6(ab263947)多克隆抗体购自英国Abcam公司;β-actin多克隆抗体购自美国proteintech(66009-1-Ig)。
1.2 细胞培养 支气管黏膜上皮细胞(HBE135-E6E7上海富衡)用 KM 培养液置于37℃、5% CO2及饱和湿度条件下培养,细胞融合至 80%传代,细胞融合至约70%时进行实验。
1.3 ELISA(酶联免疫吸附测定法)测不同浓度和时间组中MUC5B蛋白含量的表达 参照文献报告和厂家说明书,6皿按照不同IL-8浓度分组,分别分为:A组:空白对照组、B组:IL-8 20ng/ml组、C组:IL-8 40ng/ml组、D组IL-8 60ng/ml组、E组IL-8 80ng/ml组、F组IL-8 160ng/ml组;另5皿按照不同处理时间分组,分别分为A组:空白对照组,B组:IL-8 6h组、C组:IL-8 12h组、D组:IL-8 24h组、E组IL-8 48h组(IL-8取最适浓度)。在反应终止后5min内用酶标仪在450nm波长测量各孔的光密度值,并计算MUC5B相对表达含量。
1.4 PT-PCR(实时定量 PCR 法)测MUC5B mRNA的表达 参照文献报告和厂家说明书略作改进,取对数生长的细胞进行如下分组:A组:空白对照、B组:IL-8最适浓度组(由上述实验推断)、C组:IL8+AG490组(加入50μmol/L AG490预处理1h)、D组:AG490组(50μmol/L预处理1h)、E组:IL-8+NAC组(10mmol/L)、F组:NAC组(10mmol/L),处理48h后再进行后续步骤(E、F组只进行PCR检测)。TRIzol法提取细胞中的总RNA,以总mRNA为模板,逆转录cDNA,H-actin上游引物:ACCCTGAAGTACCCCATCGAG,下游引物:AGCACAGCCTGGATAGCAAC(224bp);H-muc5B上游引物:GCCCACATCTCCACCTATGAT,下游引物:GCAGTTCTCGTTGTCCGTCA(141bp)在260nm与280nm处测其吸光度值并计算其浓度跟纯度。
1.5 WB(蛋白免疫印迹法)测JAK2、STAT6、p-JAK2、p-STAT6的蛋白含量 参照文献报告[6]和厂家说明书,一抗1∶5 000比例稀释与膜孵育,4℃过夜,次日室温放置30min。二抗孵育同一抗稀释步骤及比例相同,稀释后的二抗与膜室温孵育90min。设置β-actin为内参,quantity one灰度软件分析,以目的条带和β-actin 条带积分光密度值的比值代表目的蛋白的相对表达量。

2 结果
2.1 IL-8刺激后各组MUC5B蛋白表达的变化 不同浓度的IL-8刺激HBE135-E6E7细胞48h后,各组MUC5B蛋白的表达水平显著升高,且刺激效应同IL-8的浓度呈正相关。其中F组MUC5B蛋白相对表达量(16.633 4±1.127 7)最高,且具有统计学意义(P<0.05),见表1。IL-8刺激MUC5B蛋白的表达同处理时间相关,随着时间的延长,MUC5B的表达逐渐升高,IL-8刺激6h后,MUC5B蛋白的表达水平开始升高,其中E组表达量(16.633 4±1.127 7)最高,且均有统计学差异(P<0.05),见表2。

表1 不同IL-8浓度刺激下MUC5B蛋白相对表达量

表2 IL-8刺激不同处理时间下MUC5B蛋白相对表达量
2.2 阻断JAK2/STAT6通道后MUC5B mRNA表达的变化 由上述实验结果,可推断IL-8刺激黏蛋白MUC5B分泌可能与处理时间、IL-8浓度均相关,因此后续实验中IL-8浓度设为160ng/ml,处理时间为48h。为了进一步研究IL-8刺激黏蛋白MUC5B分泌的机制,以AG490和NAC为处理因素,通过PCR检测各组MUC5B mRNA的表达变化,AG490为JAK2抑制剂,能够阻断其表达及下游信号转导,NAC为MUC5B抑制剂,能够抑制其表达。与E组相比,B组增高, C组降低(P<0.05),提示与NAC类似IL-8可调控MUC5B表达。与A组相比,B组、C组表达均升高且B组升高更明显(P<0.05),提示IL-8调控MUC5B表达可被JAK2/STAT6抑制剂AG490阻断,见表3。

表3 AG490、NAC干预后各组MUC5B mRNA相对表达量
2.3 JAK2/STAT6介导IL-8调控MUC5B蛋白表达 与A组相比,B组p-STAT6、p-JAK2的表达明显增加。与B组相比,C组p-JAK2、p-STAT6的蛋白表达明显下降。而非磷酸化的JAK2、STAT6在各组表达未见明显变化,见图1。通过ELISA检测加入AG490后各组MUC5B蛋白表达的变化,与A组相比,B组、C组的MUC5B蛋白表达增高,其中B组表达最高,且具有统计学意义(P<0.05)。与B组相比,C组MUC5B蛋白表达降低,有统计学意义(P<0.05)。提示IL-8可通过JAK2/STAT6通道调控MUC5B分泌,且可被STAT6抑制剂AG490阻断,见表4。
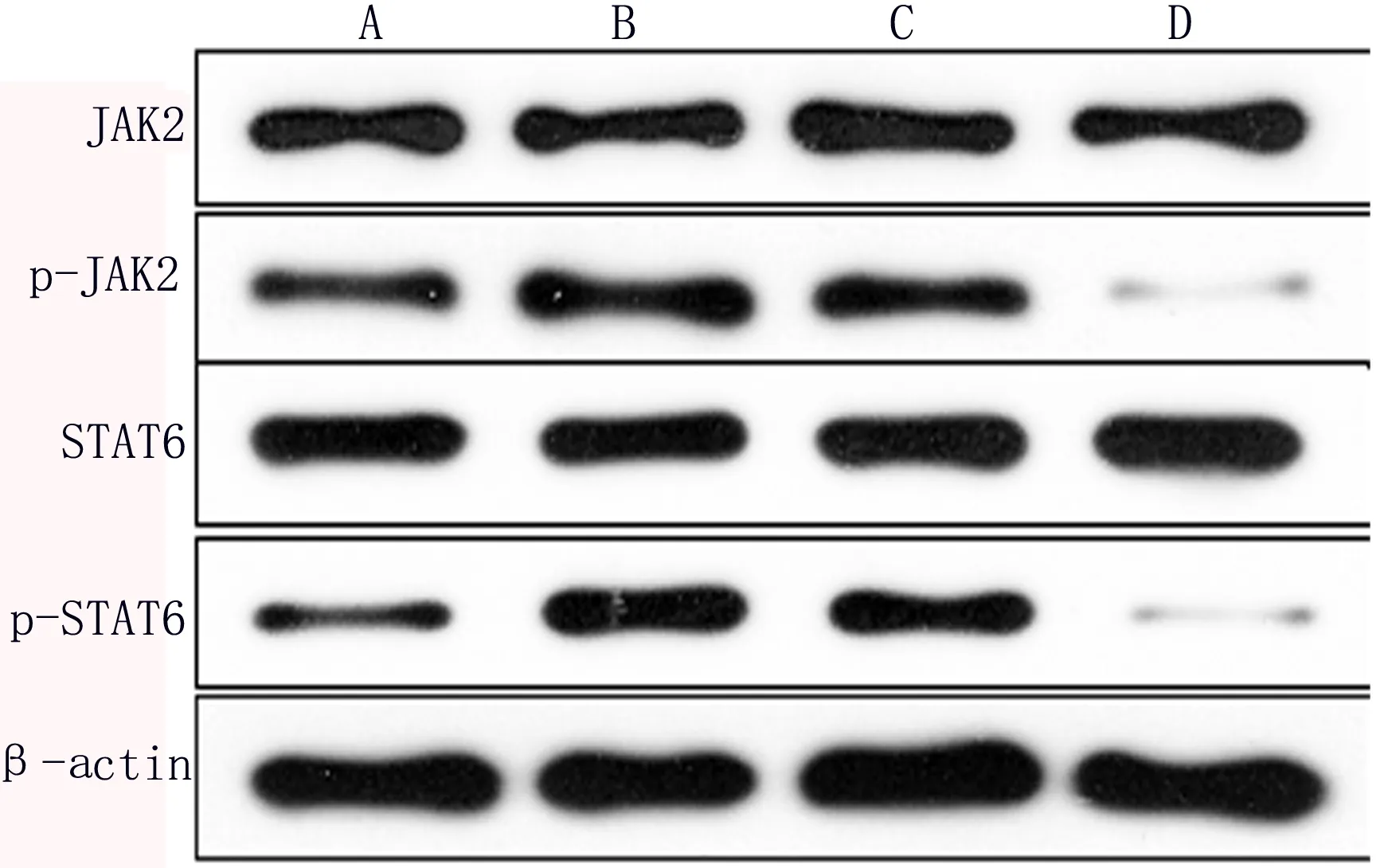
图1 IL-8刺激下各组JAK2、p-JAK2、STAT6、p-STAT6蛋白表达变化
3 讨论
本实验发现,相同处理时间下,随着IL-8的浓度增加,MUC5B蛋白表达明显升高,在相同IL-8浓度刺激下,随着处理时间的延长,MUC5B蛋白表达亦升高。IL-8主要由肺成纤维细胞产生,作为一种中性粒细胞趋化剂和黏蛋白诱导剂[7],在多种常见气道慢性疾病患者的肺泡灌洗液及气管分泌物中表达明显升高,被认为是慢性气道疾病的促炎标志物[8]。与本研究类似在研究LPS刺激杯状细胞黏液分泌体外研究时发现,IL-8的分泌和黏蛋白的分泌具有相关性且两者成正比,Chen L等研究表明IL-8可刺激呼吸道上皮细胞的黏蛋白MUC基因表达[9]。黏蛋白是黏液的主要大分子成分,目前有21种MUC在人类基因组中被识别,其中4种凝胶形成黏蛋白MUC5AC、MUC5B等表达于气道中,由气道上皮细胞的杯状细胞和黏膜下腺的黏液细胞分泌[10],综上所述,IL-8参与了调节气道上皮细胞MUC5B表达,其是气道炎症和黏液高分泌的桥梁因子,明确IL介导MUC5B表达的信号转导通路对于阻断COPD气道炎症和黏液高分泌的恶性循环至关重要,然而目前的报道均以哮喘气道MUC5AC为主,MUC5B及COPD气道上皮的研究相对较少。

表4 加AG490后各组MUC5B蛋白相对表达量
IL介导MUC5B表达的信号转导途径在不同的刺激物和不同的细胞系中不同,多数报道JAK/STAT6通路可能起重要作用,JAK/STAT家族不但转导细胞正常分化、增殖的信号,其激活及终止还受到包括炎症介质在内的多种因素的调控。本实验发现,在IL-8组中,NAC抑制MUC5B表达的作用减轻,MUC5B mRNA表达及蛋白表达明显升高,同时p-STAT6、p-JAK2较对照组也明显升高,提示IL-8可能通过JAK2/STAT6途径调控MUC5B转录及蛋白表达。进一步使用AG490阻断JAK2的表达,IL-8对MUC5B的刺激作用明显减弱,MUC5B转录及蛋白表达均受抑制。提示JAK2可能是转导IL信号途径的关键因子,IL与其受体结合,启动下游JAK2/STAT6/FoxA2相关信号传导通路,从而介导黏液细胞增生、黏液高分泌[11]。Wu SZ等人指出巨噬细胞来源的IL-8主要刺激JAK2的自磷酸化,Saco TV等发现在香烟烟雾刺激的人气道上皮中,IL-13通过STAT6/HIF-1途径上调MUC5AC的表达[12];Sim JH等发现在哮喘患者和正常人体上皮细胞系中,IL-1β通过核因子B通路上调MUC5AC表达水平升高[13];MALAT1通过NF-κB通路促进IL刺激MUC8表达[14];人气道上皮细胞系中,抵抗素可能通过ERK1/2/P38通路上调MUC5B的表达,该通路是否STAT6介导尚不明确[15];Saco TV等发现肺孢子虫、肺炎支原体感染的NHBECs,IL4/6等介导激活STAT6通路上调MUC5B表达[11]。因此,JAK/STAT6通路在IL介导气道上皮MUC5B高分泌中的机制可能为:IL8和受体结合形成异二聚体,激活了其受体上的JAK2,进一步使受体胞浆段的酪氨酸残基磷酸化,STAT6因此聚集到受体区域,并通过SH2结构域与其结合,STAT6蛋白上的Y641位点酪氨酸残基磷酸化,磷酸化的STAT6蛋白形成二聚体并易位至细胞核,结合特异的DNA元件,并启动下游相关基因包括MUC5B的转录和表达。
本研究首次发现IL-8调控气道黏蛋白MUC5B分泌通过JAK2/STAT6信号通路途径,但相关机制研究存在不足之处:(1)在本研究中,MUC5B表达与其处理时间、IL-8浓度相关,但未明确相关处理时间及浓度下细胞活力情况,无法确定本实验选用的时间及浓度为最佳时间及浓度。(2)但实验结果表明阻断该信号通路后并不能完全抑制黏蛋白MUC5B的表达,因此,其是否合并其他信号通路(如EGFR通道、NOTCH通道)共同调节,仍需进一步验证。
本实验仅在正常肺上皮上进行,后续实验可在慢阻肺动物和患者中验证,进一步明确黏液高分泌相关机制,寻找相关靶点,为干预黏蛋白高分泌提供新的治疗方向。
