保留脾脏功能的腹腔镜胰体尾手术—Kimura法的初步探讨
2022-04-08王颖,李峰
王 颖,李 峰
(1.山东中医药大学针灸推拿学院,山东 济南,250014;2.山东大学齐鲁医院普通外科)
随着对脏器功能的深入研究,我们逐渐认识到脾脏是人体重要的免疫器官,担负着重要的抗感染、抗肿瘤作用[1-2]。同时脾脏还具有内分泌功能、造血功能(凝血因子Ⅷ),因此,联合无辜脾脏切除的胰腺手术会增加近远期并发症,包括脾切除术后凶险性感染及血小板升高引起的机体高凝状态与血栓形成、机体肿瘤形成等[3-4]。因此,对于胰腺良性、交界性、低度恶性肿瘤建议尽可能行保脾胰体尾切除术。腹腔镜保脾胰体尾切除术已成为目前临床主流的手术方式,保脾手术有两种术式,一种是保留脾血管及脾脏的胰体尾切除术,即Kimura法[5];另一种是切断脾血管,但保留胃短动脉、胃网膜左动脉的胰体尾切除术,即Warshaw法[6]。由于Kimura法完整保留了脾动静脉,保脾安全可靠,在临床中成为首选术式,但技术要求高,在手术实施过程中具有一定的风险与难度,需具备对相关解剖的清晰认识、熟练的腹腔镜操作技术。笔者现将对Kimura法的几点认识与思考浅谈如下。
1 腹腔镜保留脾脏胰体尾切除术Kimura法的适应证
除了胰体尾良性、交界性或低度恶性病变外,肿瘤的形态、大小及与脾动静脉、脾门的毗邻关系也决定了能否安全顺利实施Kimura术式,因此,术前应仔细判读CT资料,制定合理的手术方案。对于术前评估能否实施Kimura术式,我们总结经验如下:(1)病灶大小。病灶“个头”不是绝对的,对于较大的病灶,如果周围炎症不重,与脾血管仅仅是挤压关系,可以考虑尝试该法。反之,如果病灶虽然较小,但炎症反应重,与周围组织、脾血管界限不清,实施Kimura法很困难。(2)病灶有较完整的包膜,界限清楚。这样的病灶,往往与周围组织粘连不重,实施Kimura法可能性较大。(3)病灶与脾血管的关系辨认。如果病灶挤压血管但未引起血管变形或血管没有明显狭窄段、扩张段,说明病灶与血管间存在间隙,这种情况大多能实施Kimura法。反之,如果病灶引起静脉显著狭窄或变形,说明粘连致密,分离困难,不宜实施该法。(4)观察脾周、胃网膜是否存在迂曲增粗血管。如果迂曲增粗血管明显可见,说明病灶严重压迫脾静脉,已引起静脉回流障碍,这种情况实施Kimura法相当困难,而且术中极易分破静脉主干或属支引起大出血。(5)病灶与脾门的邻近关系。因脾门处血管密集,如果病灶紧邻脾门,将病灶完整地与脾门分离开是非常困难的,而且极易引起脾脏或脾蒂破裂出血,甚至中转开腹。(6)人为因素。该术式的实施还应考虑术者经验,对胰尾及脾门解剖的清晰认识、腔镜下的熟练操作及娴熟的镜下缝合技术是实施Kimura法的保障,而助手的熟练配合同样不可或缺。
2 Kimura法关键步骤与手术技巧
2.1 手术体位及Trocar布局 患者取仰卧位,头侧高、左侧高,术者立于患者右侧,助手立于患者左侧,扶镜手立于患者两腿间。腹部Trocar布孔位置通常采取“V”形5孔法:脐下缘为观察孔,右锁骨中线脐上方3~5 cm为主操作孔,右腋前线肋缘下2 cm为术者副操作孔;左腋前线肋缘下2 cm为助手主操作孔,左锁骨中线近脐水平为助手副操作孔。操作孔位置可根据患者体型特点适当调整,必要时增加辅助操作孔。
2.2 手术关键步骤 超声刀打开胃结肠韧带,下降脾结肠韧带,充分暴露胰体尾部。于胰腺上缘解剖出肝总动脉、脾动脉,并分别上血管吊带牵拉保护,避免离断胰腺时误伤。于胰颈部肠系膜上静脉前方贯通胰后隧道,根据胰腺厚度及质地选择合适的切割闭合钉离断胰腺,离断前应先夹持胰腺15 s,目的是让胰腺组织受力均匀并定型。胰腺断面可电凝止血,必要时加缝。助手将远端胰腺牵向左侧,术者沿脾动、静脉向脾门方向游离,胰腺与脾静脉间细小静脉属支可双极电凝烧闭,较粗属支采用Hem-o-lok夹闭或缝扎(图1)。脾动脉与胰腺体尾部间的穿支建议Hem-o-lok夹闭或缝扎。游离胰尾,使胰体尾部与周围组织完全分离,再集中处理胰尾处脾动静脉分支与属支,注意胰尾近脾门处血管较密集,处理不慎会引起大出血,或盲目夹闭血管导致部分脾缺血。当然,手术也可采取胰尾入路先行(图2),视术者操作习惯及病灶分离显露难易情况决定。
2.3 脾血管的应对处理 安全高效地处理脾血管与胰腺之间的交通支是Kimura手术的关键环节,正确的应对策略是减少术中出血、安全快速完成手术的关键。我们体会:(1)操作轻柔是前提,应杜绝为了显露术野而过度牵拉血管,不论是动脉抑或静脉均可能撕裂出血,一旦血管回缩止血更加困难;尤其静脉,在牵拉过程中变细变形,可能误认为是筋膜而直接烧断引起出血。(2)脾动脉分支解剖显露相对清晰,根据分支粗细选择合适的Hem-o-lok夹闭。较粗的动脉分支,可用Hem-o-lok夹闭后再缝扎,以确保结扎可靠。(3)术中发生血管意外出血时,不要盲目钳夹或上Hem-o-lok,尤其静脉属支更容易造成撕裂加重,此时应先压住出血部位,吸净术野、看清血管后再进行相应处理。(4)有的患者脾静脉嵌入胰腺实质内走行,并且嵌入段较长,处理此类血管可先游离显露脾静脉近远端,两端分别上血管夹夹闭阻断,再从容解剖并处理脾静脉主干及其属支,处理完毕逐一松开血管夹,检查有无出血,最后缝扎不确切的静脉侧壁(图3)。动脉处理亦是如此。(5)如果病灶与血管存在明显粘连,为了有效预防、控制分离过程中出血,借用“肝门阻断”方法,可先解剖出脾动脉并预置血管吊带。(6)对于较厚的胰腺,离断胰颈部后,远断段胰腺缝一道,起到“抓手”的作用,助手可从容提拉胰腺,以便充分暴露操作空间。(7)胰体尾切除后,务必仔细检查每一个环节,做到结扎、缝扎牢靠,对出血“零容忍”(图4)。(8)团队配合的重要性:包括术者与助手娴熟、默契配合,“双主刀”操作理念,熟练的镜下缝合技术,扶镜手快速处理能力,团队处变不惊的心态及从容应变的能力[7]。

图1 脾动脉的处理 图2 胰尾入路先行

图3 脾静脉的处理 图4 逐一检查脾动静脉
2.4 脏器悬吊技巧 由于胰腺的特殊位置,手术操作过程中胃成为阻碍术野显露的制约因素,有效消除胃的阻碍可显著提高手术效率。为此,我们采用过多种方法,均获得不错的显露效果。(1)可采用滑线或V-lok线将胃体部偏后壁缝合固定于上腹壁,使胃从原本“趴”在胰腺上的状态“直立”起来,远离胰腺,从而增加操作空间。(2)打通小网膜囊,采用14号双腔尿管(留取前段部分长10~15 cm),从头端侧孔收紧尿管,将胃体向后上方提拉,Hem-o-lok夹固定于镰状韧带上半部分(保持足够的张力)(图5),也可采用普通细号引流管提拉胃后固定于镰状韧带。如果患者胃较肥大,单纯胃体部固定仍不能充分显露术野,可再将胃体部大弯侧网膜也牵拉固定于镰状韧带。胃悬吊好了,助手双手也就自然解放出来了。
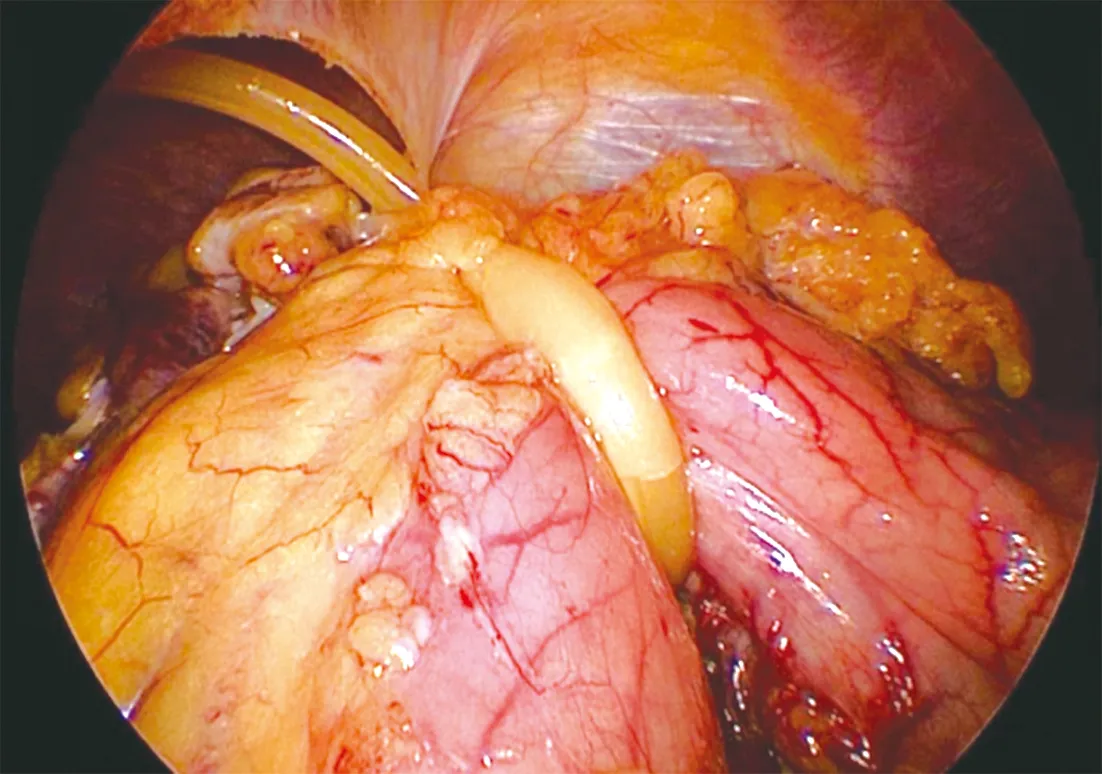
图5 胃的悬吊
3 Kimura法手术入路的选择
Kimura法通常有顺行、胰尾先行、顺逆结合3种入路方式[8]。其中,顺行入路又包括上前入路(优先处理脾动脉)、下后入路(优先处理脾静脉)。手术入路的选择应结合术前影像学资料、术中探查情况决定。根据肿瘤的类别、大小、与脾血管的粘连程度、脾静脉受压程度、与脾门关系等因素综合考虑,灵活制定个体化的入路方案[9]。(1)如果脾动脉位置比较表浅,易于解剖,可采取上前入路,游离出脾动脉上血管吊带牵拉,既可清晰结扎离断分支血管,又可及时阻断,快速有效控制意外出血。如果肿瘤位于胰尾,紧邻脾门,估计解剖困难,有出血的可能,也可采用该入路。(2)如果肿瘤界限较清楚,即便肿瘤较大,可采用下后入路,对显露、保护脾血管更为有利。(3)如果肿瘤位于胰体尾部,局部粘连不重,可采用胰尾入路,将胰腺翻向胰头方向游离。胰尾入路的优势可首先探查预判保脾的可能性,其次充分游离出胰尾,可直接闭合器切断胰腺,可避免打通胰后隧道,也能避免切除过多胰腺,减少术后内外分泌功能不良的发生。再者,胰尾入路要求仔细分离脾门血管,尽可能多地保留脾脏血供,减少脾脏缺血范围。当然,胰尾入路也有一定风险,可能引起难以控制的出血,手术转为Warshaw术式,甚至中转开腹。
合理的入路选择是手术安全性、效率的优化,不能过度强调某一种入路优劣,如黏液性囊腺瘤或胰腺导管内乳头状黏液肿瘤,往往局部粘连较重,完全可两种或多种入路联合进行,手术安全、利于操作是前提。
4 Kimura法术后常见并发症及处理
4.1 胰瘘 胰瘘同样是Kimura术式不能回避的问题,国内个别中心报道其发生率高达30%[10],国外有报道术后胰瘘发生率为18.4%[11]。术后胰瘘发生的原因可概括为三大类:(1)胰腺因素:肿瘤的性质、胰腺质地、胰腺厚度、主胰管直径[12];(2)手术操作因素:胰腺残端的处理方法、脾门处是否残留胰腺组织、术中出血量、手术时间[13-14];(3)患者因素:BMI,年龄,营养状况,是否合并糖尿病、心脏等器官基础疾病[15]。
针对不同的胰腺特点,结合患者的具体病情,采取合理的术中操作流程、规范的术后全程管理是控制与减少术后胰瘘的重要措施。我们总结经验如下:(1)闭合钉的合理选择:钉高、钉宽直接影响胰腺断端血运及闭合效果,是导致术后胰瘘的重要因素,因此,需全面了解闭合器钉的特点,选取合适的闭合钉离断胰腺。(2)切割闭合器断胰腺前应先夹持压榨胰腺15 s,确保胰腺组织、胰管受力均匀,同时减少胰腺断面的出血。(3)谨慎对待胰腺断面:胰腺血运丰富,分支胰管较多,尤其质地脆的胰腺,闭合钉会造成一定的切割损伤,出现迟发性出血、胰瘘,建议使用Prolene线或薇乔线缝合加固断端[16]。(4)胰尾的处理:尽可能完整切除胰体尾,但如果胰尾深入脾门,或伴有炎症,强行解剖可能造成难以控制的出血,不必过分强调全部切除胰尾,但建议尽可能地减少残留胰腺组织,并缝扎或采用切割闭合钉,以减少术后胰瘘,断面务必放置引流管。(5)血管阻断带的灵活使用:如果胰腺存在炎症,解剖脾血管时可预置阻断带,减少意外出血。(6)腹腔引流管是把“双刃剑”,正视腹腔引流管的作用。术后早期有效引流渗出液,对胰瘘也可起到引流与冲洗的作用,建议术后第3天查引流管淀粉酶,如果在正常值3倍左右尽快拔管。长时间带管有可能挤压、刺激胰腺断面造成长期胰瘘,经久不愈。我们早期对于拔管过于谨慎,长时间带管,有多例患者长期生化漏或B级胰瘘,后果断采取先退管再拔管的措施,胰瘘很快治愈。(7)如果术后出现胰瘘,每日在几十毫升,患者腹部体征及生命体征稳定,提示引流通畅,不建议积极进行持续腹腔冲洗,可采取间断冲洗的办法,只要保证通畅引流即可。如果量较大,患者反复发热,伴腹部不适,往往提示引流不充分,单纯引流难以控制病情,应及时持续腹腔冲洗,必要时在超声或CT引导下穿刺置管引流。(8)术后合理使用抗生素及生长抑素,加强营养支持治疗,维持水电解质、酸碱平衡。
4.2 出血 Kimura术后出血分为早期出血与迟发性出血,早期出血的主要原因:(1)术中脾血管处理不彻底,如较粗的脾动脉分支或静脉属支未用Hem-o-lok夹闭或缝扎,而是单纯超声刀闭合,术后结痂脱落引起出血[17]。(2)术中结扎线或Hem-o-lok夹闭不牢固、血管保留端过短,导致术后血管松脱引发出血[18]。我们遇1例患者术后当晚腹腔大出血,开腹探查发现脾动脉分支的Hem-o-lok完全脱落。(3)使用了不合适的闭合钉,钉高、钉距不匹配,导致胰腺断面渗血[19]。笔者就曾发生1例术后当天腹腔出血,再次手术探查出血原因为闭合钉间渗血。(4)肠系膜血管出血。此类出血极少见,笔者团队发生1例术后出血,再次手术探查发现横结肠系膜小动脉出血。迟发性出血的原因多为术后胰瘘引起的继发性出血,也有少数病例为术中能量平台的副损伤,如超声刀的热传导,电凝钩、双极电凝漏电误伤周围血管,导致术后迟发性出血。
如何采取有效预防措施规避或最大限度地减少术后出血?我们总结:(1)较细的脾静脉属支可采取双极电凝烧闭或Hem-o-lok夹闭;对于动脉分支,不建议凝闭,因为动脉的血流动力学特点,单纯凝闭易致术后结痂脱落出血,应采用Hem-o-lok夹闭或缝扎的方法。(2)术中超声刀操作时注意工作端避免贴近血管,否则会引起热损伤,导致迟发性出血。(3)血管离断时保留端尽可能长,或进行缝扎。(4)术中根据胰腺厚薄及质地选择合适的闭合钉,必要时断面加固缝合。(5)术后通畅有效的腹腔引流,密切观察是否存在胰瘘,如出现胰瘘而引流不理想,及时再次穿刺置管或冲洗,避免胰瘘腐蚀血管或假性动脉瘤形成从而引发大出血。(6)手术结束前除检查手术区域外,还应仔细检查大网膜、结肠系膜等有无遗漏处理或副损伤的血管。
4.3 脾脏梗死 从解剖学与手术角度而言,Kimura法完整保留了脾动、静脉,是最有保障的保留脾脏功能的术式,但尽管如此,仍有报道术后发生迟发性脾梗死以致再次手术的病例。分析原因,考虑术中反复钳夹脾动脉,损伤血管内膜,引发相关凝血机制,导致脾动脉内栓子形成,栓子脱落进入脾脏,继而引起脾栓塞[20-21]。尽管有报道认为,脾脏缺血梗死范围不超过30%甚至50%,可无需特殊干预[22],但临床检查缺乏准确有效的评估,况且一旦发生脾梗死,轻者长时间发热,极可能继发感染,重者需再次手术,给患者带来巨大创伤与痛苦。
那么,如何预防或规避术中术后脾缺血梗死的发生呢?首先,操作过程中尽量不要钳夹血管,如果需要通过牵拉脾血管以获得更好的术野与操作,建议采用血管吊带提拉,减少对脾血管内膜的损伤,或者缝扎胰腺后牵拉胰腺。其次,解剖脾血管过程中,不要将动脉“骨骼化”或裸化太彻底,可保留动脉外层的纤维膜性结构,以便提拉。再次,手术结束前仔细观察脾动脉充盈与搏动情况,如果脾动脉全程充盈均匀,搏动有力,无节段性扩张或充盈不充分,提示动脉血运良好。反之,有动脉损伤的可能,需要动态观察脾脏血运。最后,撤气腹前常规观察脾脏血运情况,红色或暗红色提示血运良好,颜色稍有变暗但无加重或范围未增加,均属正常反应,但如果出现明显发黑区域则提示脾脏已发生缺血,该范围脾脏难以存活保留,可根据缺血范围决定是否切除脾脏[23]。
5 Kimura法术后全程管理策略
手术的成功实施,不仅是单纯手术的顺利完成,还涵盖术后的全程管理,包括患者的饮食管理、血糖管理、引流管管理、营养管理及术后随访等。规范及个体化的术后管理符合快速康复理念,不但能促进患者的快速康复,更能使患者及时跟进后续治疗,长期获益。结合团队自身管理经验,对于Kimura术后管理策略体会如下:(1)饮食与营养管理:我们认为,早期恢复肠内营养不会增加术后消化道漏、胃瘫等并发症,相反,能促进胃肠功能恢复,但应结合患者术后恢复程度制定合理的饮食管理方案[24-25]。Kimura术后第1天,患者胃管拔除后即可不限量饮水,第2天流质饮食,同时添加短肽或整蛋白营养制剂。第4天改半流质饮食,术后6~7天可普通饮食,但会限制进食量,仍辅以营养制剂,直至术后半个月完全恢复普通饮食。(2)术后血糖的监测:胰腺手术后血糖多有升高,围手术期血糖的控制直接影响愈后。除常规宣教外,我们根据患者三餐前血糖制定相应的膳食图谱,让患者轻松熟知并做好饮食管理。此外,我们与内分泌科建立了合作机制,对于术前合并糖尿病、术后血糖难以调控的患者,定期指导,及时调整治疗方案。(3)引流管的管理。术后当天或第1天拔除胃管,鼓励患者早期下床活动。对于腹腔引流管,我们团队术后常规第3天检测腹腔引流液淀粉酶水平,如淀粉酶在正常值3倍左右,退管两次,每次1~2 cm,如患者无发热、腹部阳性体征,可及早拔除腹腔引流管[26]。如术后出现胰瘘,但引流通畅,患者无发热及腹部不适,不建议持续冲洗,保持引流管通畅即可,必要时经引流管造影明确引流管与胰腺关系,是否存在引流管压迫胰腺导致的胰瘘,及时调整引流管位置。如引流不畅或存在持续发热、腹痛等症状,及时于CT或超声下穿刺置管引流,同时密切观察,及时发现腹腔出血或前哨出血。(4)术后第4天或第5天复查强化CT,一方面了解腹腔有无积液,指导腹腔引流管退管与拔管;另一方面明确有无脾梗死及梗死范围、有无侧支循环形成,以便采取相应治疗对策。(5)胰腺外分泌功能调控:Kimura术后短期内存在胰腺外分泌功能不足,为减轻胰腺负担,建议患者术后服用胰酶片3~6个月,根据患者食欲、体重变化情况、排便情况决定加量抑或减量。(6)随访:出院后采取门诊复查的方式,第一次复查建议术后1个月,此后3~6个月复查一次,第二年6~12个月复查一次,复查采取腹部强化CT。
尽可能地保留患者的脏器功能是外科大夫的目标,Kimura法保脾安全、有效,是目前主要的保脾术式,但需严格把握手术适应证,术者需具备熟练的腹腔镜下缝合等技术、良好的应变能力与处理经验,术后全程化规范化管理,以不断提高手术效率与质量。
利益冲突:所有作者均声明不存在利益冲突。
