羧甲基化南瓜多糖的制备及抗氧化、降血糖活性研究
2022-04-07李雪晖罗心雨
李雪晖 罗心雨 王 莹
(1. 南阳师范学院生命科学与农业工程学院,河南 南阳 473061;2. 广东省生态环境技术研究所,广东 广州 510650)
南瓜(Cucurbita moschata duch)是葫芦科南瓜属草本植物的果实,在中国各地被广泛种植,富含各种维生素、氨基酸、蛋白质、多糖等营养物质,是一种高营养、低脂的功能性食品,作为一种防治糖尿病的食品而备受关注[1-2]。南瓜多糖富含降血脂、降血糖、抗氧化、抗衰老等功能[3-4]的生物活性成分,作为自由基清除剂在预防氧化损伤方面起着重要作用,其降血糖活性在动物试验和临床试验中得以证实[5]。
分子修饰是通过物理、化学及生物学等手段对化合物进行结构改造,以获得众多结构类型衍生物的方法。选用硫酸化、磷酸化、烷基化、羧甲基化等方式[6-7]对多糖分子结构进行适量修饰,能有效提高其生物学活性。通过向多糖的支链上导入羧甲基基团的羧甲基化修饰技术[8]在南瓜多糖修饰中使用较多,主要是由于其控制相对容易、生产成本低,且反应产物无毒性。多糖可捕捉过氧化链式反应中产生的活性氧,减少反应链的长度,阻断或减缓反应的进行,起到清除自由基的作用,但对于羧甲基化南瓜多糖的抗氧化活性研究尚未见报道,且南瓜多糖的羧甲基化修饰结构与生物活性的关系也尚不明确。
文章拟以南瓜多糖为原材料,对其进行羧甲基化修饰,用紫外分光光度法对羧甲基化南瓜多糖取代度进行研究,并探讨羧甲基化南瓜多糖对羟自由基、超氧阴离子自由基的清除作用以及α-葡萄糖苷酶抑制活性的抑制作用,期望通过羧甲基化的方式提高南瓜多糖的抗氧化活性和降血糖活性,为南瓜多糖的开发利用提供依据。
1 材料与方法
1.1 材料与试剂
成熟南瓜:市售;
一氯乙酸(MCA)、硫代巴比妥酸、盐酸、浓硫酸、羟基乙酸(乙醇酸)、变色酸、维生素C、氢氧化钠、盐酸羟胺、无水乙醇、三氯化铁、过氧化氢(30%)、葡萄糖、苯酚、木瓜蛋白酶等:国产分析纯。
1.2 仪器与设备
紫外可见分光光度计:WFZ UV-2000型,尤尼柯(上海)仪器有限公司;
电热恒温鼓风干燥箱:DHG-9240A型,上海恒科学仪器有限公司;
数显恒温水浴锅:HHS21-8型,上海博迅实业有限公司;
电子天平:JA2003型,上海市恒平科技科学仪器有限公司;
台式离心机:DL-5A型,上海菲恰尔分析仪器有限公司;
高效液相色谱仪:G1362A型,美国安捷伦科技公司;
真空冷冻干燥机:FD-1D-50型,北京博医康实验仪器有限公司;
酶标仪:Multiskan MK3型,美国Thermo Fisher公司。
1.3 试验方法
1.3.1 南瓜多糖、羧甲基化南瓜多糖的制备
(1)南瓜粉:根据文献[9]。
(2)南瓜多糖(PP):根据文献[10]。
(3)羧甲基化南瓜多糖(CM-PP):称取0.200 0 g PP,加入一定量的3.0 mol/L NaOH溶液,滴加一氯乙酸,一定温度下反应一定时间,调节pH为7,过滤,透析,冷冻干燥得CM-PP。
1.3.2 PP含量和CM-PP取代度测定
(1)PP含量:采用苯酚—硫酸法[11-12]。
(2)CM-PP取代度:采用紫外分光光度法[13]。
1.3.3 单因素试验
(1)一氯乙酸浓度:固定反应温度70 ℃、反应时间3.0 h,考察一氯乙酸浓度(0.5,1.0,1.5,2.0,2.5 mol/L)对羧甲基化多糖取代度的影响。
(2)反应温度:固定反应时间3.0 h、一氯乙酸浓度1.5 mol/L,考察反应温度(40,50,60,70,80 ℃)对羧甲基化多糖取代度的影响。
(3)反应时间:固定反应温度70 ℃、一氯乙酸浓度1.5 mol/L,考察反应时间(2.0,2.5,3.0,3.5,4.0 h)对羧甲基化多糖取代度的影响。
1.3.4 响应面优化 在单因素试验基础上,以一氯乙酸浓度、反应温度和反应时间为自变量,以羧甲基化多糖取代度为响应值,根据Box-Behnken试验设计基本原理优化CM-PP制备工艺。
1.3.5 抗氧化活性试验
(1)羟自由基清除率:分别取样品溶液1 mL,依次加入1 mL FeSO4溶液(9 mmol/L)和水杨酸—乙醇溶液(9 mmol/L),加入6 mL蒸馏水,摇匀。以等体积的蒸馏水代替样品溶液作空白对照,以蒸馏水代替水杨酸为本底组。加入1 mL浓度为8.82 mmol/L 的H2O2溶液,37 ℃水浴1 h,测定510 nm处吸光度,按式(1)计算羟自由基清除率。
(1)
式中:
I——自由基清除率,%;
Ii——本底组吸光度;
Ij——样品组吸光度;
I0——对照组吸光度。
(2)超氧阴离子自由基清除率:向试管中加入4.6 mL 浓度为50 mmol/L的Tris-HCl缓冲液(pH 8.2),25 ℃水浴20 min,分别加入1 mL样品溶液,0.4 mL浓度为10 mmol/L 的邻苯三酚溶液,摇匀,25 ℃水浴4 min,加入0.1 mL浓度为8 mol/L的HCl溶液终止反应,测定325 nm处吸光度,以蒸馏水取代样品溶液为对照组,以蒸馏水取代邻苯三酚溶液为本底组,并按式(1)计算超氧阴离子自由基清除率。
1.3.6 抑制α-葡萄糖苷酶活性试验 根据文献[14]略修改。向酶标板中加入80 μL磷酸缓冲液(pH 6.8),加入16 μL样液和α-葡萄糖苷酶溶液(0.2 U/mL),37 ℃反应15 min;加入16 μL浓度为2.5 mmol/L的p-NPG溶液,37 ℃反应30 min;加入100 μL浓度为1.0 mol/L的Na2CO3溶液,用酶标仪测定λ=405 nm处吸光度,以阿卡波糖为阳性对照,按式(2)计算α-葡萄糖苷酶抑制率。
(2)
式中:
α——α-葡萄糖苷酶抑制率,%;
αi——本底组吸光度;
αj——样品组吸光度;
α0——对照组吸光度。
1.4 数据处理
使用Origin 2019b软件处理数据,并制图;使用Design-Expert 8.06软件构建响应面模型,并进行方差分析。
2 结果与分析
2.1 CM-PP制备工艺优化
2.1.1 单因素试验 由图1(a)可知,随着一氯乙酸浓度的升高,羧甲基化多糖取代度呈先上升后下降的趋势。当一氯乙酸浓度为1.5 mol/L时,羧甲基化多糖取代度最大,可能是随着一氯乙酸用量的增加,促使NaOH渗透到多糖分子中产生钠盐,增加了与一氯乙酸化学反应的机会,进而增加了羧甲基化多糖取代度;但一氯乙酸用量过多会加速一氯乙酸的水解,同时消耗部分NaOH,使反应过程体系pH值下降,从而不利于取代反应的进行,羧甲基化多糖取代度下降。因此,最佳一氯乙酸浓度为1.5 mol/L。
由图1(b)可知,当反应温度为40~70 ℃时,羧甲基化多糖取代度随反应温度的升高而增大,可能是温度升高提高了化学反应试剂的活力,加快了羧甲基化反应;同时,升高温度使原料迅速溶胀,颗粒中NaOH、一氯乙酸和分散剂的相互渗透能力增强,分子之间的有效接触面积增多,因而取代度提高。当反应温度>70 ℃时,羧甲基化取代度随反应温度的升高而减小,是因为温度过高可能会破坏多糖的结构,从而引起焦糖化反应,同时副反应速率提高,会影响主反应速率,使一氯乙酸利用率降低;另外,由于环境温度过高、分子运动加速导致分子结合力下降,使化学反应速率显著下降,取代度降低。因此,最优反应温度为70 ℃。
由图1(c)可知,当反应时间为2.0~3.0 h时,羧甲基化多糖取代度与反应时间呈正相关关系,可能是反应活性中心随反应时间的增加而增多,有利于多糖与一氯乙酸充分接触,使得取代度逐渐增加。当反应时间为3.0 h时,取代度达到最高,当反应时间>3.0 h时,取代度与反应时间呈负相关关系,可能是反应过程中出现了副反应,从而使取代度降低。因此,最优的反应时间为3.0 h。
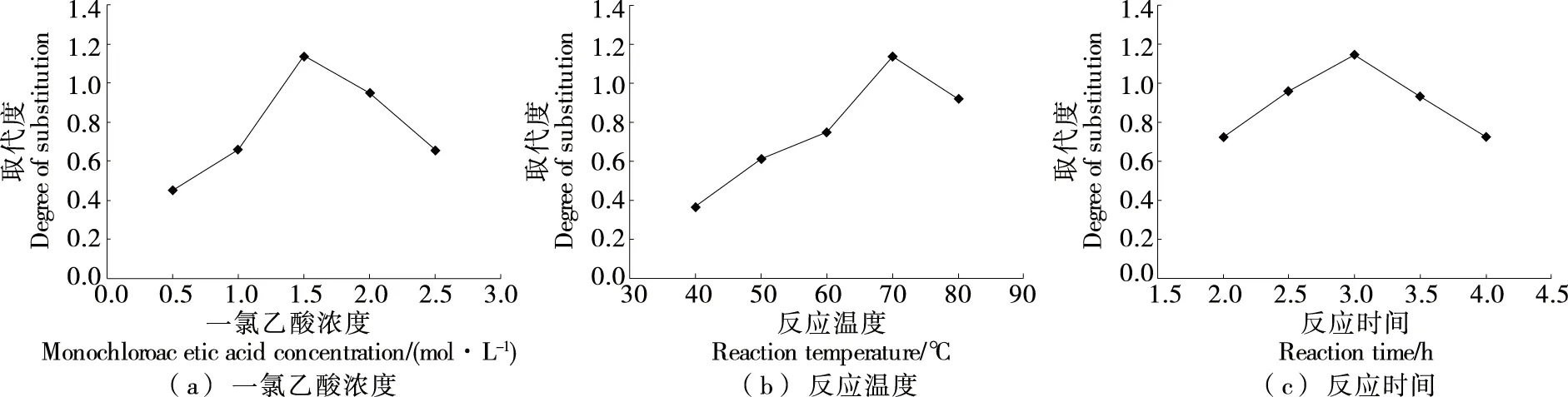
图1 各因素对羧甲基化多糖取代度的影响Figure 1 Effects of various factors on the degree of substitution of carboxymethylated polysaccharide
2.1.2 羧甲基化南瓜多糖工艺优化 在单因素试验基础上,以一氯乙酸浓度、反应温度和反应时间为试验因素,以羧甲基化取代度为考察指标,并利用Design-Expert 8.06软件构建三因素三水平响应面试验。因素水平表见表1,试验设计及结果见表2。
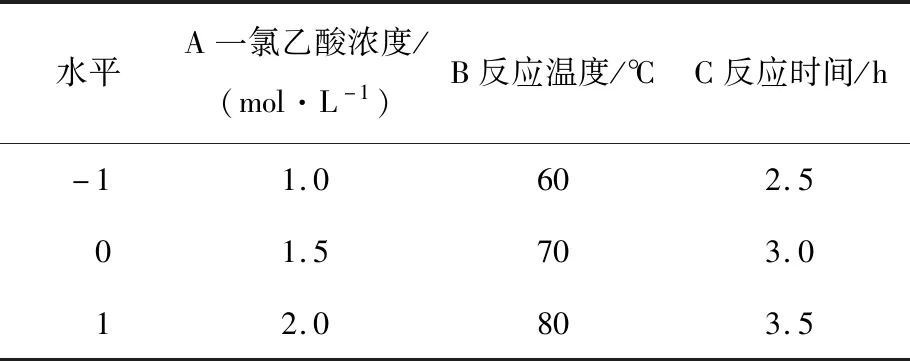
表1 响应面试验因素及水平设计Table 1 Response surface test factors and horizontal design

表2 Box-Behnken试验设计及结果Table 2 The Box-Behnken test scheme and results
运用Design-Expert 8.06软件对试验结果进行二次方程模型拟合,得二次回归方程:
Y=1.18+0.17A+0.025B+0.037C+0.022AB-0.036AC+0.032BC-0.100A2-0.068B2-0.11C2。
(3)
由表3可知,模型F=21.32较高,显著水平P=0.000 3 较低,因变量和全体不同自变量之间的线性函数关联显著。失拟项不显著(P=0.100 3),表明其他因素对取代度干扰较小,回归模型与实际情况相符合。影响取代度大小的因素主次顺序为一氯乙酸浓度>反应时间>反应温度,但各因素之间的相互作用并不明显(见图2)。

图2 各因素相互作用对羧甲基化取代度的影响Figure 2 Effect of interaction of various factors on degree of substitution of carboxymethylation
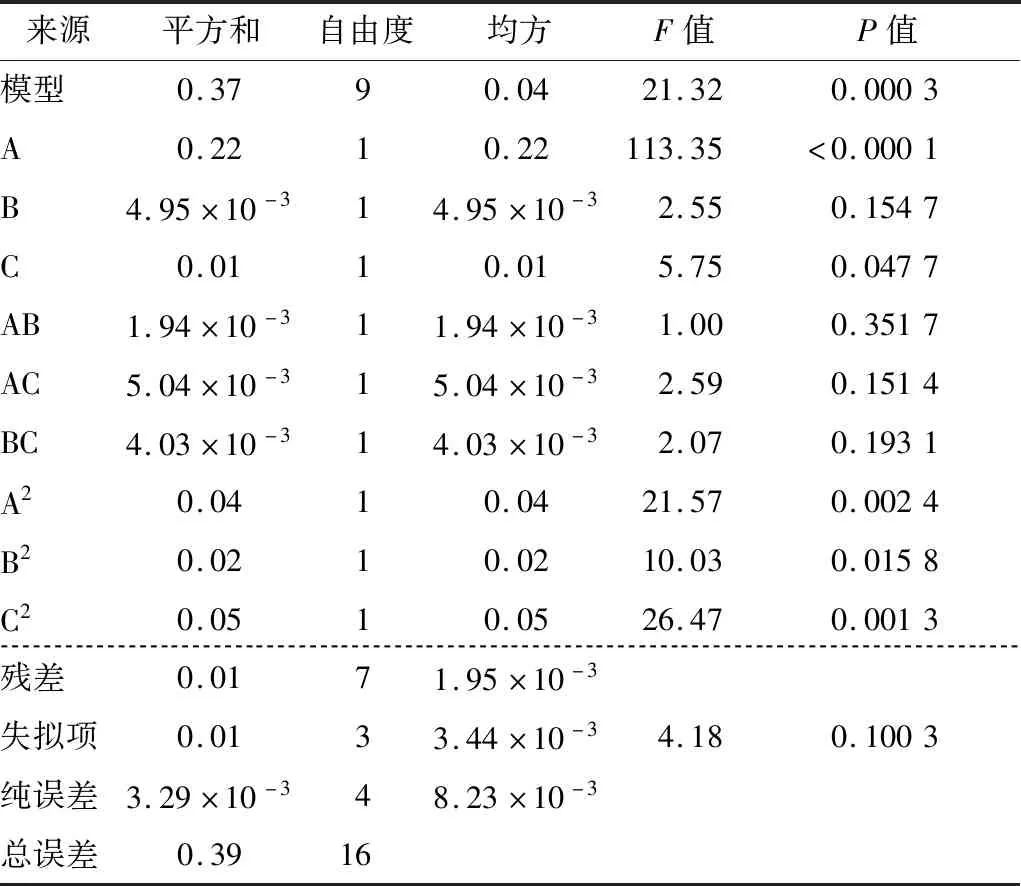
表3 响应值方差分析†Table 3 Analysis of variance of response value
最佳工艺条件为一氯乙酸浓度1.93 mol/L、反应温度73.40 ℃、反应时间3.04 h,该条件下的CM-PP取代度理论值为1.254。
2.1.3 模型验证 为了检验模型的稳定性和可行性,将最佳制备工艺条件修正为:一氯乙酸浓度1.9 mol/L、反应温度73 ℃、反应时间3 h。该工艺条件下的羧甲基化多糖取代度为1.247(n=4),与理论值非常相近,证明了响应面试验法优化羧甲基化南瓜多糖制备工艺是合理可行的。
2.2 抗氧化活性
2.2.1 羟自由基清除能力 由表4可知,不同质量浓度下,PP、CM-PP样品均存在不同的羟自由基清除率,具有明显的羟自由基清除能力;且PP、CM-PP的羟自由基清除率随质量浓度的提高呈剂量浓度依赖性关系[15]。从浓度角度考虑,维生素C、PP、CM-PP的IC50值分别为4.33×10-4,4.21×10-5,3.26×10-6mol/L,表明引入羧甲基基团能提高多糖对羟自由基的清除能力,且优于维生素C,可能与修饰后的多糖结构及羟基基团含量有关,与周际松等[16]的结果相似,可能是多糖链构象结构特征发生了改变,从而提高了羟自由基的清除能力。
2.2.2 超氧阴离子自由基清除能力 由表4可知,PP、CM-PP对超氧阴离子自由基的清除率与质量浓度有显著的正相关关系[17-19],与柳红等[20]的研究结果一致。从浓度角度考虑,维生素C、PP、CM-PP的IC50值分别为5.14×10-4,1.54×10-5,3.06×10-6mol/L,说明CM-PP对超氧阴离子自由基的清除能力显著提高,可能是在PP中引入了羧甲基基团,从而改变了多糖的生物学活性;并且其抗氧化活性高于维生素C。陈放[21]研究表明:苦瓜多糖经羧甲基化修饰后其清除作用增强,可能与多糖水溶性有一定的关系,其作用机制可能是抑制超氧自由基转化为过氧化氢或羟自由基等活性氧。
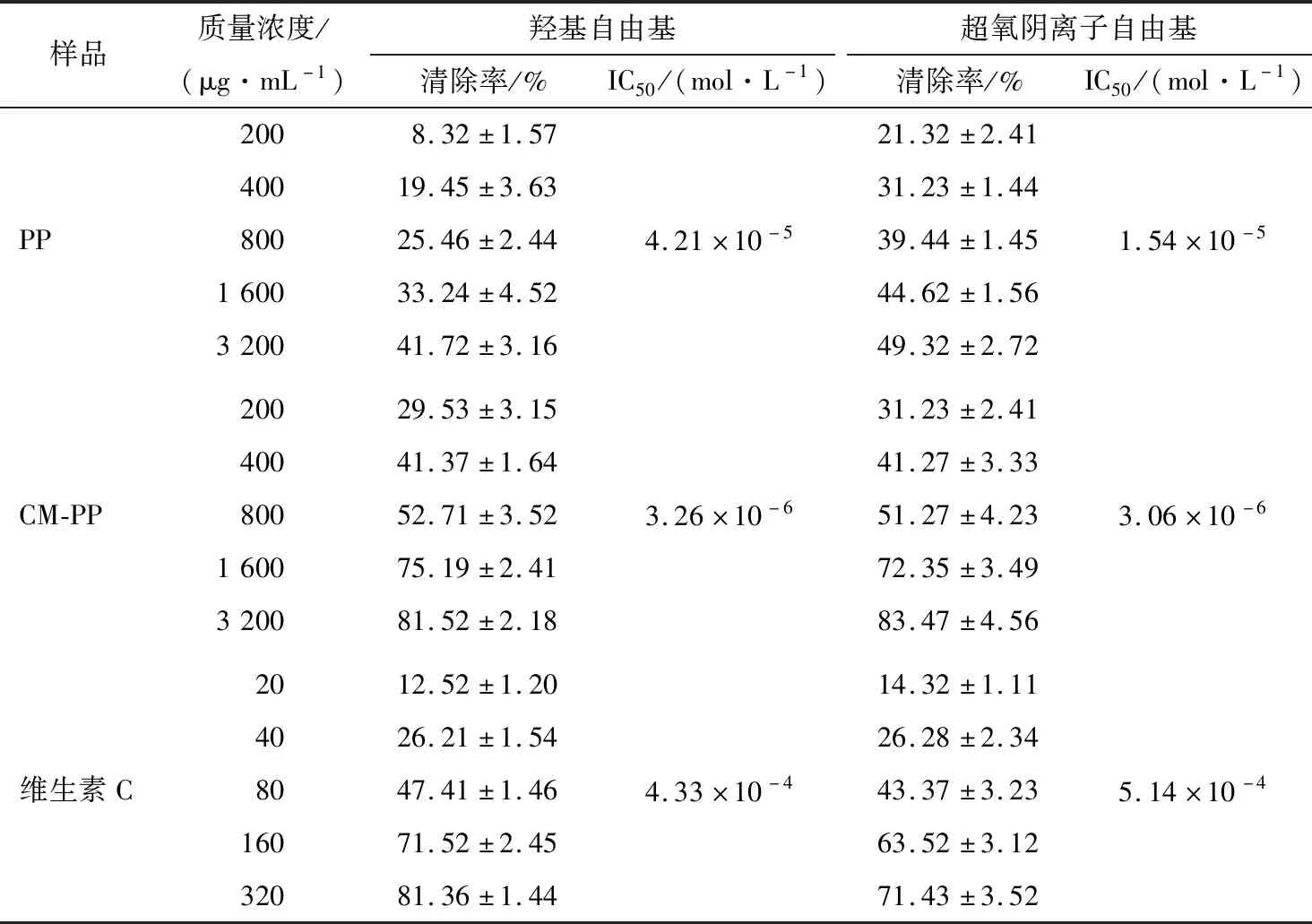
表4 PP和CM-PP对自由基的清除率Table 4 Percentage scavenging of hydroxyl radical by PP and CM-PP (n=3)
2.3 α-葡萄糖苷酶抑制活性
由图3可知,PP、CM-PP对α-葡萄糖苷酶的抑制率与质量浓度呈正相关关系;但随着质量浓度的增加,其抑制作用变化变小,表明南瓜多糖及羧甲基化南瓜多糖均有一定的抑制糖吸收的功能,降糖效果明显略低于阿卡波糖,但与阿卡波糖呈大致平行的抑制曲线,这与赵骏等[22]的研究结果一致。牛庆川等[23]研究发现,羧甲基化红枣多糖对α-葡萄糖苷酶活性的抑制作用明显高于红枣多糖,并阐明了降血糖相关的作用机理。同时,试验发现南瓜多糖具有预防糖尿病、促进机体维持正常血糖的生理功能。因此,多糖可用于降血糖药品、降血糖功能性药品、天然保健食品等多种途径[24]。查阅相关文献[25]发现,南瓜多糖中引入了羧甲基基团,可能使其水溶性和电负性发生了改变或者增强,进而影响了抗氧化和降血糖等生物活性。
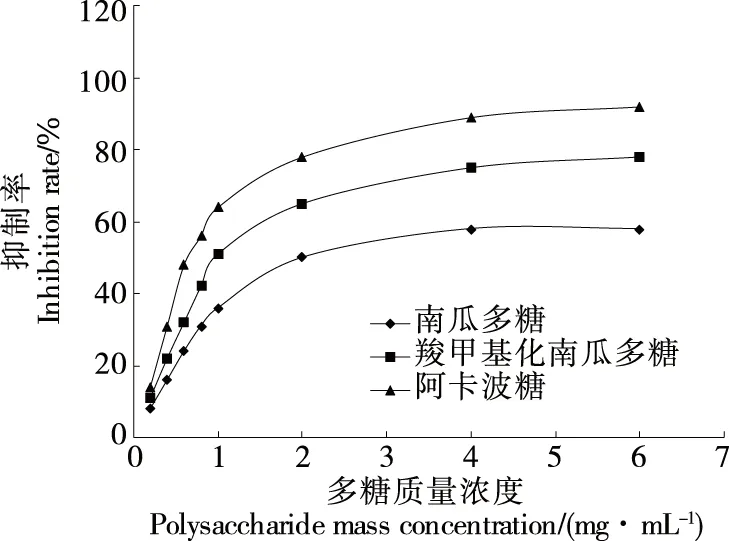
图3 α-葡萄糖苷酶抑制率与多糖质量浓度的关系Figure 3 Relationship of α-glycosidase inhibitory activity and polysacchrides concentration
3 结论
通过响应面试验法优化了羧甲基化南瓜多糖的制备工艺。结果表明,羧甲基化南瓜多糖的最佳制备工艺为:一氯乙酸浓度1.9 mol/L、反应温度73 ℃、反应时间3 h,该条件下的羧甲基化南瓜多糖取代度为1.247,说明羧甲基化南瓜多糖的优化工艺是合理可行的。南瓜多糖和羧甲基化南瓜多糖均可以清除羟自由基和超氧阴离子自由基;与修饰前南瓜多糖相比,多糖的羧甲基化修饰也能提高其对α-葡萄糖苷酶的抑制活性,说明羧甲基化南瓜多糖具有较强的抗氧化活性和降血糖活性。后续可对羧甲基化南瓜多糖的降血糖作用机制进行分析。
