水酶法提取紫海胆性腺脂质的工艺优化及提取方法对其品质的影响
2022-04-06江婷婷陈晓婷徐清云吴靖娜蔡水淋廖登远刘智禹
潘 南,江婷婷,陈晓婷,徐清云,吴靖娜,蔡水淋,6,廖登远,刘智禹
(1.福建省水产研究所 国家海水鱼类加工技术研发分中心,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013; 2.闽南师范大学 生物科学与技术学院,福建 漳州 363000;3.厦门软件职业技术学院 软件工程系,福建 厦门 361024; 4.厦门医学院 厦门市海洋药用天然产物资源重点实验室,福建 厦门 361023; 5.厦门医学院 海洋生物医药资源福建省高校工程研究中心,福建 厦门 361023; 6.华侨大学 化工学院,福建 厦门 361021)
紫海胆(Heliocidaricrassispina)隶属于棘皮动物门、海胆纲、拱齿目、长海胆科,广泛分布于中国东海、南海海域以及日本沿海。紫海胆性腺,又称紫海胆黄,是一种深受美食饕客追捧的健康食材,其脂质占总质量的10%~30%(干基),包含甘油酯、磷脂、糖脂及脂溶性微量生物活性物质等,赋予了其鲜醇甜润的口感,并有益于维持机体健康稳态。目前,紫海胆相关研究主要集中于营养成分分析、化学成分分离及结构鉴定、增养殖及其对生态的影响等方面[1-3],而关于其性腺脂质的提取、理化性质、脂质组成、脂肪酸组成、营养指标及熔融、结晶特性等研究鲜见报道。
传统制油工艺具有高效、出油多等优点,但存在能耗大、污染环境、操作危险、残渣蛋白变性严重、毛油成分复杂、有机溶剂残留等问题[4]。水酶法是一种条件温和、绿色安全、副产物价值高的制油工艺,目前已应用于橄榄油、菜籽油、花生油、大豆油、椰子油等的工业化生产,创造了良好的社会与经济价值[5]。近年来,水酶法被越来越多地应用于微藻和类微藻原生生物、海洋浮游动物、水产品加工副产物等海洋膳食脂质的制备[6-8]。然而,油料的巨大差异对提取工艺的转化应用提出了更多适应性要求,因此亟需针对特定油料性质、工艺技术以及脂质品质之间的相互关系开展研究,以推动水酶法技术在海洋膳食脂质领域的不断完善。
本研究以福建省泉州市永宁镇近海海域采集的紫海胆性腺为对象,采用单因素实验和正交实验优化水酶法提取脂质工艺,并基于GC-MS、Generik Diol SPE、HPTLC和DSC等技术,以脂质的得率、理化性质、脂肪酸组成、营养指标、脂质组成、熔融与结晶特性为指标,探讨了水酶法、Folch法和Matyash法对紫海胆性腺脂质品质的影响,以期为水酶法制备高品质海洋膳食脂质产品及其应用提供更多的技术参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
紫海胆,采集于福建省泉州市永宁镇近海海域,保活运输至福建省水产研究所,开壳,取出性腺,使用1%食盐水漂洗后,沥干水分,真空冷冻干燥,粉碎、过0.425 mm(40目)筛,真空袋密封,-20℃保藏。
中性蛋白酶(5万U/g)、碱性蛋白酶(5万U/g)、风味蛋白酶(5万U/g)、木瓜蛋白酶(20万U/g),南宁庞博生物工程有限公司;正己烷、异辛烷、氯仿、二氯甲烷、甲基叔丁基醚、乙醚、乙酸乙酯、丙酮、甲醇、乙醇、异丙醇、冰乙酸、碘化钾、盐酸、氯化钾、磷酸氢二钠、磷酸二氢钠等,分析纯;韦氏试剂;硫代硫酸钠标准溶液;氢氧化钾-乙醇标准溶液;37种脂肪酸甲酯混标、甘油一酯与甘油二酯和甘油三酯混标、单半乳糖甘油二酯(MGDG)、磷脂酰甘油(14∶0 PG)、磷脂酰胆碱(21∶0 PC)、磷脂酰乙醇胺(18∶0 PE)、磷脂酰肌醇(18∶0 PI)、磷脂酰丝氨酸(16∶0 PS)、樱草黄,西格玛奥德里奇(上海)贸易有限公司。
1.1.2 仪器与设备
Agilent 6890N/5975B气质联用系统(GC-MS),美国安捷伦科技有限公司;SP®-2560毛细管GC色谱柱(100 m×0.25 mm,0.20 μm)、VisiprepTMSPE真空固相萃取装置、60 F254高效硅胶薄层色谱板,西格玛奥德里奇(上海)贸易有限公司;气体钢瓶,厦门艺东气体有限公司;Generik Diol SPE小柱,苏州赛分科技有限公司;DSC 3差示扫描量热仪、FE28-Standard pH计,瑞士梅特勒-托利多国际有限公司;5804R台式离心机,德国艾本德(中国)有限公司;916Ti-Touch全自动电位滴定仪,瑞士万通中国有限公司;冷冻干燥机,北京四环科学仪器厂有限公司;NV-15G氮吹仪,天津博纳艾杰尔科技有限公司;R-100旋转蒸发仪、Recirculating Chiller F-305循环冷却器、Vacuum Pump V-100真空泵,步琦实验室设备贸易(上海)有限公司;SHZ-B水浴恒温振荡器;双槽展开缸;ZF-90B多功能紫外透射仪;DHG-9141A电热恒温鼓风干燥箱;MX-RL-Pro旋转混匀仪,美国赛洛捷克有限公司。
1.2 实验方法
1.2.1 水酶法提取紫海胆性腺脂质
精确称取2 g紫海胆性腺粉末,加入酶制剂和相应缓冲溶液,在一定温度下酶解一定时间。酶解完成后,沸水浴灭酶10 min,加入25%氯化钠、65%无水乙醇[9],超声15 min,调节pH至4.5,离心,加入适量正己烷萃取油相3次,合并萃取液,35℃氮气吹干至恒重,计算脂质得率(脂质得率=紫海胆性腺脂质质量/紫海胆性腺质量×100%)。实验所用4种酶制剂的最适温度、最适pH和相应的缓冲溶液见表1。
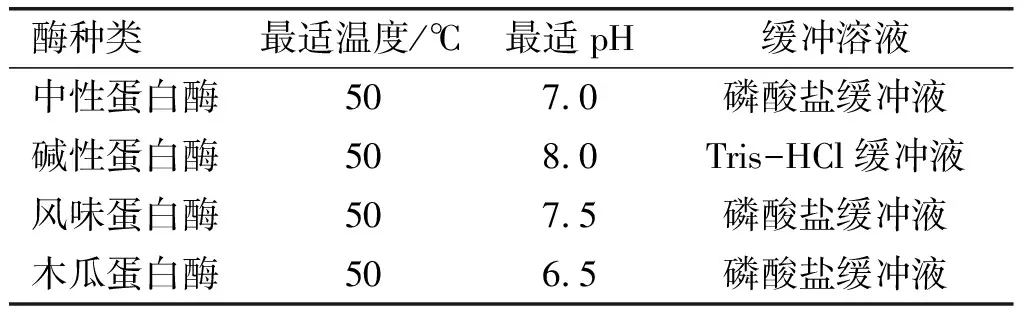
表1 蛋白酶最适酶解条件
1.2.2 Folch法提取紫海胆性腺脂质[10]
精确称取1 g紫海胆性腺粉末,按料液比1∶20加入氯仿-甲醇(体积比2∶1)溶液,室温下旋转萃取1 h,离心后移取上层萃取液,沉淀重复萃取2次,合并萃取液,加入1/4体积的0.9%氯化钠溶液,离心后收集氯仿层,35℃氮气吹干至恒重,计算脂质得率。
1.2.3 Matyash法提取紫海胆性腺脂质[11]
精确称取1 g紫海胆性腺粉末,按料液比1∶20加入甲基叔丁基醚-甲醇(体积比1.5∶5.0)溶液,室温下旋转萃取1 h,加入1/5体积去离子水,离心后收集甲基叔丁基醚层,35℃氮气吹干至恒重,计算脂质得率。
1.2.4 紫海胆性腺脂质理化性质的测定
色泽、气味测定参考GB/T 5492—2008;酸值测定参考GB 5009.229—2016;碘值测定参考GB/T 5532—2008;过氧化值测定参照GB 5009.227—2016;皂化值测定参考GB/T 5534—2008。
1.2.5 紫海胆性腺脂质脂肪酸组成分析
甲酯化:称取适量紫海胆性腺脂质,加入20 μL 0.5 μg/μL内标(21∶0 PC)和2 mL甲醇-浓硫酸溶液(体积比25∶1),涡旋混匀,80℃水浴1 h,待冷却后加入2 mL正己烷和1 mL水,涡旋振荡,离心,取上层有机相至新玻璃管,加1 mL水,涡旋振荡,离心;再取上层有机相至另一新玻璃管,氮气吹干;加入100 μL异辛烷,涡旋振荡,转移至进样瓶,供GC-MS检测分析。
GC条件:进样量1 μL;进样口温度和检测器温度均为280℃;载气为高纯氦气;氢气流量30 mL/min;空气流量300 mL/min;升温程序为初始温度90℃,保持1 min,以10℃/min升温至170℃,保持5 min,以5℃/min升温至175℃,以1℃/min升温至210℃,保持5 min,以5℃/min升温至240℃,保持20 min。
MS条件:电离方式EI,离子源温度200℃,接口温度300℃,电子能量70 eV,质量扫描范围(m/z)20~500。
1.2.6 紫海胆性腺脂质营养指标分析
紫海胆性腺脂质致动脉粥样硬化指标(AI)[12]、血栓形成指标(TI)[12]、促进健康指标(HPI)[13]、不饱和指标(UI)[14]分别按公式(1)~(4)计算,以评价不同工艺提取的紫海胆性腺脂质对人类心血管疾病的潜在影响。
IA=(C12∶0+4C14∶0+C16∶0)/(∑MUFA+∑n-3 PUFA+∑n-6 PUFA)
(1)
IT=(C14∶0+C16∶0+C18∶0)/(0.5∑MUFA+3∑n-3 PUFA+0.5∑n-6 PUFA+∑n-3 PUFA/∑n-6 PUFA)
(2)
IHP=(∑MUFA+∑PUFA)/(C12∶0+4C14∶0+C16∶0)
(3)
IU=C1+2C2+3C3+4C4+5C5+6C6
(4)
式中:IA为致动脉粥样硬化指标;IT为血栓形成指标;IHP为促进健康指标;IU为不饱和指标;MUFA为单不饱和脂肪酸;n-3 PUFA为n-3型多不饱和脂肪酸;n-6 PUFA为n-6型多不饱和脂肪酸;C1为单烯酸含量;C2为二烯酸含量;C3为三烯酸含量;C4为四烯酸含量;C5为五烯酸含量;C6为六烯酸含量。
1.2.7 紫海胆性腺脂质组成分析
采用Generik Diol SPE小柱对不同工艺提取的紫海胆性腺脂质进行分离、纯化。使用6 mL甲醇、6 mL丙酮和6 mL正己烷对SPE小柱进行除杂和活化,取适量脂质溶于二氯甲烷溶液中,上样。使用6 mL正己烷洗脱中性脂、6 mL丙酮洗脱糖脂、6 mL甲醇洗脱磷脂,洗脱液35℃氮气吹干至恒重。以洗脱脂质质量占上样紫海胆性腺脂质质量的比例表示脂质分布情况。
采用高效薄层色谱法鉴定不同脂质。使用HPTLC Silica gel 60 F254型硅胶板,中性脂以正己烷-乙醚-冰乙酸(体积比80∶20∶2)为展开剂,糖脂和磷脂均以乙酸乙酯-异丙醇-二氯甲烷-甲醇-0.25% KCl(体积比25∶25∶25∶10∶9)为展开剂,室温展开[15]。以樱草黄(0.01%溶于80%丙酮)为显色剂,365 nm紫外灯下检视、拍照。
1.2.8 紫海胆性腺脂质热力学分析
采用差示扫描量热仪分析紫海胆性腺脂质的熔融与结晶特性。称取适量紫海胆性腺脂质于铝盘中并密封,空盘密封作为对照,50 mL/min氮气保护下测试:25℃保持1 min,50℃/min升温至80℃,保持10 min;10℃/min降温至-55℃,保持10 min;5℃/min 重新升温至80℃。记录冷却和重新加热过程中脂质结晶与熔融情况。使用STARe Evaluation Software Version 16.20软件分析示温图。
1.2.9 数据处理
2 结果与分析
2.1 水酶法提取紫海胆性腺脂质工艺优化
2.1.1 酶制剂的选择
酶制剂对油料及其催化反应具有严格的选择性。不同酶制剂对同一油料中脂蛋白、脂多糖等复合体酶解,由于酶切位点不同,脂质从油料中释放能力不同。与此同时,酶制剂能破坏油滴表面脂膜,降低乳化液的稳定性,从而提高脂质得率。在料液比1∶20,酶解时间3 h,酶添加量3 000 U/g,各酶最适温度、最适pH、相应缓冲溶液条件下,研究不同酶制剂对水酶法提取脂质得率的影响,结果见表2。

表2 不同酶制剂提取紫海胆性腺脂质得率 %
由表2可知,中性蛋白酶脂质得率最高,其次为碱性蛋白酶与木瓜蛋白酶,风味蛋白酶的最低。因此,选取中性蛋白酶作为最适酶制剂。
2.1.2 单因素实验
2.1.2.1 酶添加量的影响
采用中性蛋白酶,在pH 7、料液比1∶20、酶解温度50℃、酶解时间3 h的条件下,研究酶添加量对水酶法提取脂质得率的影响,结果见图1。

图1 酶添加量对脂质得率的影响
由图1可知,在酶添加量1 000~9 000 U/g范围内,脂质得率随着酶添加量的增加而增加。酶添加量为1 000~3 000 U/g时的脂质得率显著低于9 000 U/g的脂质得率,当酶添加量达到7 000 U/g时,酶添加量对脂质得率增效无显著影响,酶添加量为9 000 U/g时,脂质得率达到最大值。随着酶添加量的增多,酶与油料结合程度提高,酶解效果越明显;而随着酶与油料结合位点的饱和,继续添加酶制剂已无法增大酶促效应,脂质得率趋于稳定。因此,选择最佳酶添加量为7 000 U/g。
2.1.2.2 酶解时间的影响
采用中性蛋白酶,在pH 7、料液比1∶20、酶解温度50℃、酶添加量3 000 U/g的条件下,研究酶解时间对水酶法提取脂质得率的影响,结果见图2。

图2 酶解时间对脂质得率的影响
由图2可知,在酶解时间1~5 h内,脂质得率随着酶解时间的延长而显著增大,当酶解时间超过4 h,脂质得率趋于稳定,无显著性变化。这是因为随着酶解反应的进行,油脂、游离肽、氨基酸等酶解产物被释放至反应体系中,反向作用于酶制剂,进而抑制酶促反应的进行。因此,选择酶解时间为4 h。
2.1.2.3 pH
采用中性蛋白酶,在料液比1∶20、酶解温度50℃、酶添加量3 000 U/g、酶解时间3 h的条件下,研究pH对水酶法提取脂质得率的影响,结果见图3。

图3 pH对脂质得率的影响
由图3可知,pH在6~8内,脂质得率随着pH增加先增加后降低,在pH为7时达到最大值。这是因为中性蛋白酶具有两性电解性质,其活性中心功能基团的解离状态随着反应体系pH的改变而改变,直接影响酶活力及其与油料的结合能力,进而影响脂质得率。因此,选择最佳pH为7。
2.1.3 正交实验
基于单因素实验结果,采用中性蛋白酶,固定料液比1∶20、酶解温度50℃,以脂质得率为指标,选取酶添加量(A)、酶解时间(B)与pH(C)为因素,根据L9(34)设计正交实验,优化水酶法提取紫海胆性腺脂质工艺。正交实验因素水平见表3,正交实验设计及结果见表4。

表3 正交实验因素水平
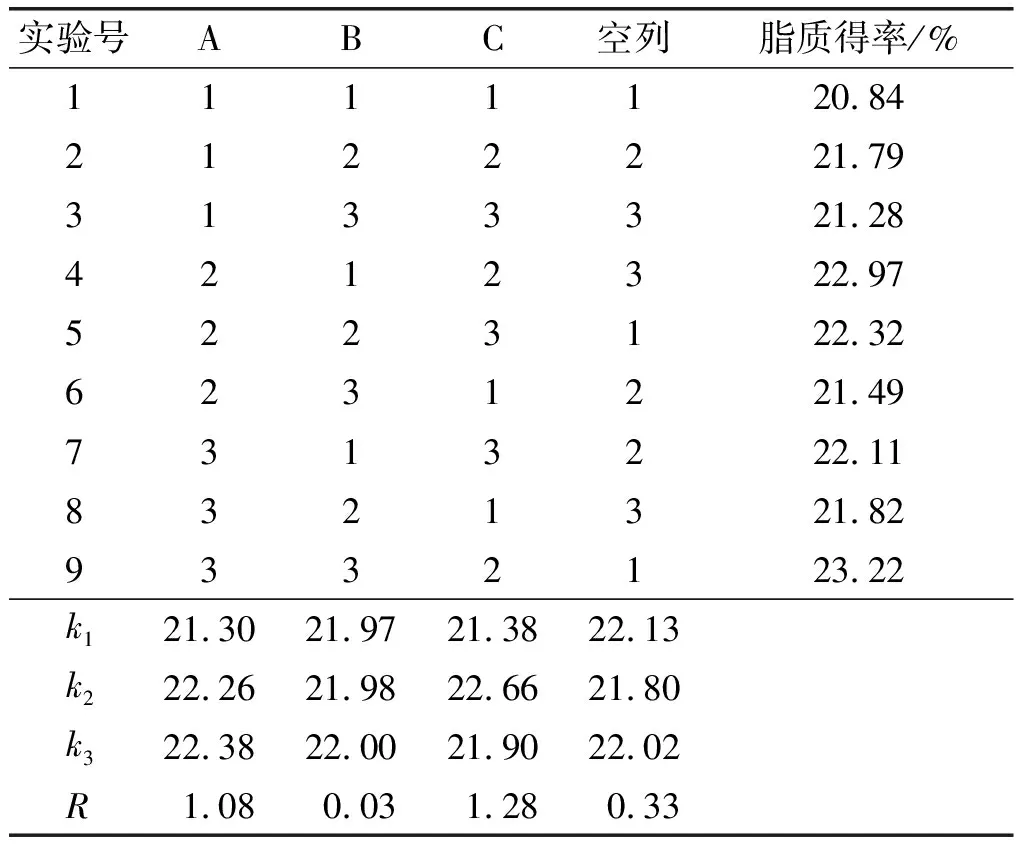
表4 正交实验设计及结果
由表4可知,不同因素影响水酶法提取紫海胆性腺脂质得率的主次顺序依次为pH(C)>酶添加量(A)>酶解时间(B)。水酶法提取紫海胆性腺脂质得率最优组合为A3B3C2,即酶添加量7 500 U/g、酶解时间5 h、pH 7,在此条件下进行3次验证实验,紫海胆性腺脂质得率平均值达到23.22%。
2.2 不同提取方法对紫海胆性腺脂质得率和品质的影响
2.2.1 对脂质得率的影响
不同工艺对紫海胆性腺脂质得率的影响如图4所示。
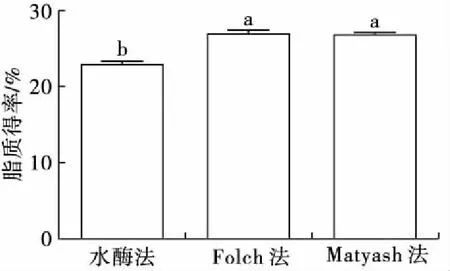
图4 不同工艺对紫海胆性腺脂质得率的影响
从图4可以看出,水酶法脂质得率((23.22±0.29)%)显著低于Folch法((27.27±0.40)%)和Matyash法((27.14±0.18)%)。分别以Folch法与Matyash法脂质得率为总脂得率,水酶法脂质提取率分别为(85.14±1.05)%和(85.54±1.05)%,与水酶法提取光棘球海胆(Strongylocentrotusnudus)性腺脂质的提取率((82.0±2.1)%)[9]相比略高,这可能与油料性质(海胆的种类、捕捞季节、贮藏条件)、破乳工艺、仪器设备与人为操作等因素的差异有关。宋玉昆等[16]比较了索氏法、水酶法和超临界CO2法(SC-CO2)提取西伯利亚鲟鱼(Acipenserbaerii)卵脂质,发现水酶法脂质得率显著低于索氏法,但高于SC-CO2法;Zhou等[17]比较了索氏法、水酶法和SC-CO2提取扇贝(Patinopectenyessoensis)内脏脂质发现,水酶法脂质得率显著低于其余两种方法。由此可见,不同工艺对脂质得率具有显著影响,水酶法具有反应条件温和、能耗低、操作安全、绿色环保、副产物价值高等优势,但仍存在成本高、游离油得率低、破乳工艺复杂等技术瓶颈,有待进一步提升与优化。
2.2.2 对脂质理化性质的影响
不同工艺对紫海胆性腺脂质理化性质的影响如表5所示。
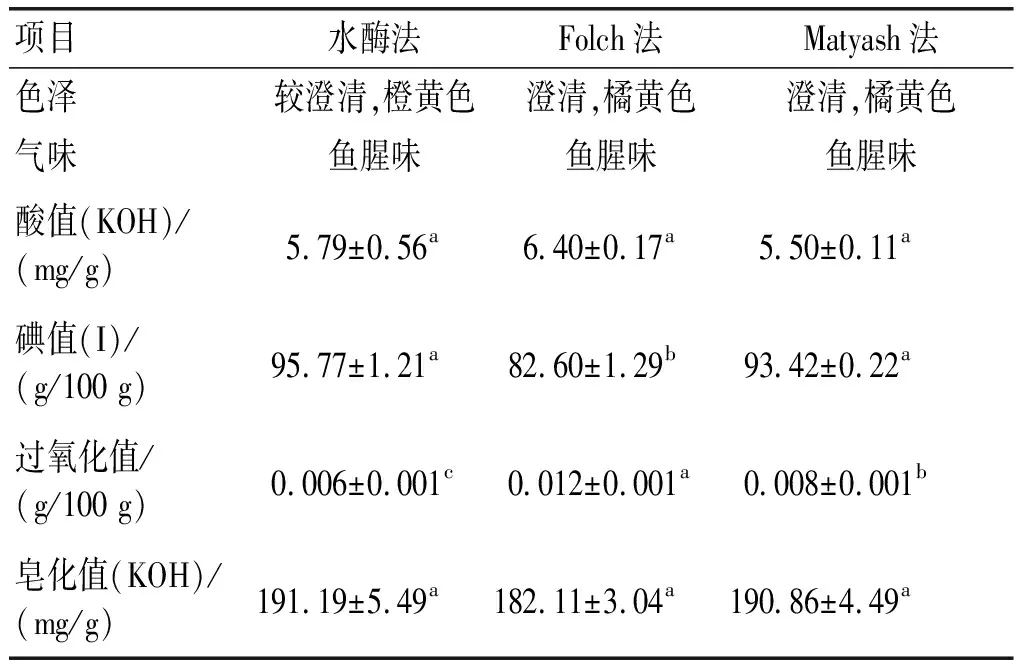
表5 不同工艺对紫海胆性腺脂质理化性质的影响
从表5可以看出,水酶法脂质的澄清度较差、颜色较浅,呈橙黄色。3种工艺提取脂质均有特殊的鱼腥味,有待进一步精炼脱臭。3种工艺提取脂质的酸值、皂化值差异均不显著。水酶法与Matyash法脂质的碘值差异不显著,但均显著高于Folch法,反映了前两种工艺提取脂质的不饱和度高于Folch法,氧化稳定性弱于Folch法。3种工艺提取脂质的过氧化值均较低,其中水酶法提取脂质的过氧化值(0.006 g/100 g)最低,说明该工艺提取过程中脂肪酸氧化降解形成的氢过氧化物较少、酸败程度较低。由此可知,水酶法提取的脂质具有较低的过氧化值、较高的碘值,品质较好。
2.2.3 对脂肪酸组成与营养指标的影响
不同工艺提取紫海胆性腺脂质脂肪酸组成见表6。
由表6可以看出:3种工艺提取脂质中均检测出29种脂肪酸,其中SFA含量最高,以C14∶0、C16∶0、C24∶0为主;PUFA含量次之,以C20∶4n6和C20∶5n3(EPA)为主;MUFA含量最少,以C18∶1n7、C20∶1n9、C22∶1n9为主。Folch法的SFA含量显著高于Matyash法和水酶法,水酶法的PUFA含量显著高于Folch法,而MUFA组间比对没有显著差异,说明不同工艺对紫海胆性腺脂质SFA与PUFA含量具有显著影响。水酶法与Matyash法的EPA与C22∶6n3(DHA)总含量均显著高于Folch法,说明以上两种方法提取的脂肪酸具有较高的营养价值。

表6 不同工艺提取紫海胆性腺脂质的脂肪酸组成 %
具有较低AI、TI和较高HPI、UI的膳食脂质更有利于心血管疾病的预防与治疗。不同工艺提取紫海胆性腺脂质的营养指标如表7所示。
从表7可以看出:水酶法提取脂质的AI显著低于Folch法与Matyash法,TI显著低于Folch法,HPI显著高于Folch法与Matyash法,UI显著高于Folch法,说明水酶法提取脂质营养价值更好。与其他膳食食物相比,水酶法紫海胆性腺脂质的AI(1.46)显著高于罗氏海盘车(Asteriasrollestoni)[18](0.81)、养殖鸡[19](0.372~0.390)、绵羊[20](0.49~0.52);TI(0.51)显著低于养殖鸡[19](0.755~0.784)、绵羊[20](1.1~1.15)和小母牛[21](1.10~1.34)等养殖肉类,但高于罗氏海盘车(Asteriasrollestoni)[18](0.29);HPI(0.69)较牛奶、奶酪[13]更高,UI(1.59)显著高于大豆[22](1.48~1.55)与猪肉[23](1.11~1.24),表明其具有较好的不饱和程度及常温流动性,更有利于健康稳态的维持。
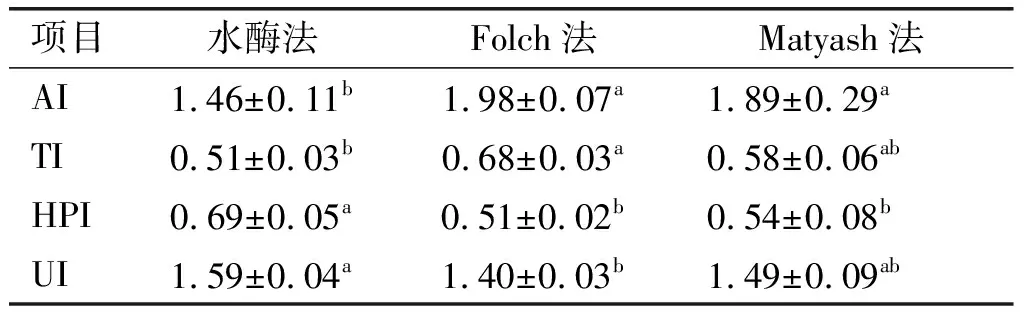
表7 不同工艺提取紫海胆性腺脂质的营养指标
综上,水酶法提取紫海胆性腺脂质的SFA含量较低,PUFA含量较高,EPA与DHA总含量最高,营养指标均较好,具有更好的预防心血管疾病、促进健康稳态的功效。
2.2.4 对脂质组成的影响
基于Generik Diol SPE技术对不同脂质组分分离、纯化的研究鲜有报道[24]。本研究采用Generik Diol SPE技术对不同工艺提取的紫海胆性腺脂质进行分离、纯化,采用高效薄层色谱法对各洗脱脂质成分进行定性分析,中性脂(A)、糖脂(B)和磷脂(C)的高效薄层色谱图见图5,不同工艺对紫海胆性腺脂质组成的影响见图6。

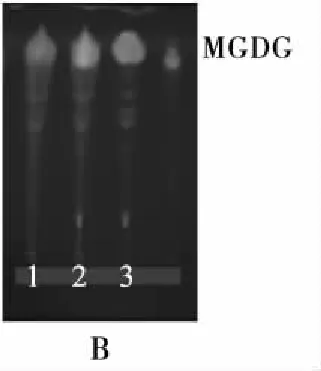
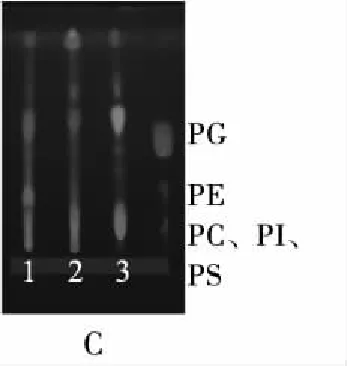
注:1.水酶法; 2.Folch法; 3.Matyash法。
由图5可知,基于Generik Diol SPE法分离不同工艺提取的紫海胆性腺脂质中性脂(A)、糖脂(B)和磷脂(C),在与标准品相应的位置上,均显示出白色斑点,说明Generik Diol SPE法具有较好的分离中性脂、糖脂和磷脂的作用。由图6可知,不同工艺提取的紫海胆性腺脂质的中性脂含量差异不显著,糖脂、磷脂含量存在一定差异,其中:水酶法的糖脂含量((17.40±0.31)%)与Folch法无显著性差异,但显著低于Maytash法的;水酶法的磷脂含量((4.23±0.36)%)则显著低于其他两种方法的。采用水酶法提取藻类脂质同样存在磷脂含量较低的现象[25]。水酶法使用了水相与正己烷体系,Folch法与Maytash法分别采用了氯仿-甲醇(体积比2∶1)与甲基叔丁基醚-甲醇(体积比1.5∶5.0)体系,不同溶剂极性大小排序为水>甲醇>氯仿>甲基叔丁基醚>正己烷。根据相似相溶原理,水酶法提取的糖脂与磷脂易溶于极性体系中,破乳工艺进一步促进了磷脂的相分离过程,因此水酶法极性脂得率较低。综上,水酶法对磷脂的选择性较低,有待进一步改良。
2.2.5 对脂质熔融与结晶特性的影响
脂质的熔融与结晶特性影响其品质、稳定性和适用性。不同工艺提取紫海胆性腺脂质熔融过程和结晶过程DSC曲线见图7。由于DSC熔融曲线低温侧带凹陷,因此以峰值温度(Tp)为表征,该熔融、结晶过程所吸收或释放的热量为熔融、结晶的热焓(ΔH)[26],上述转变温度见表8、熔融/结晶热焓见表9。
由图7(A)可知,水酶法与Matyash法脂质在-30~40℃ 范围内一共出现4个吸热峰,Folch法脂质在-30~40℃范围内一共出现3个吸热峰,其中峰3为Folch法脂质熔融的主要区域,峰3、峰4为水酶法与Matyash法脂质熔融的主要区域,3种工艺提取脂质低温范围的吸热峰均比高温范围的吸热峰弱、峰宽均比高温范围的峰宽窄,说明上述脂质均为同质多晶型,所含甘油三酯种类较多,熔点温度相对不集中。由表8、表9可知:水酶法与Matyash法脂质峰3的Tp分别为(13.92±0.41)℃和(12.51±0.34)℃,ΔH分别为(-6.76±1.60)J/g和(-9.75±0.67)J/g,而Folch法脂质在此温度附近无明显的相转变,说明在该温度范围水酶法和Matyash脂质与Folch法脂质相比具有更多固态向液态的转变,熔点显著较低;水酶法与Matyash法脂质峰4的Tp((28.59±0.26)℃与(29.76±0.34)℃)与Folch法脂质峰3的Tp((29.51±0.89)℃)相比没有显著性差异,而水酶法峰4的ΔH绝对值显著低于Folch法脂质峰3与Matyash法脂质峰4的ΔH绝对值,说明水酶法脂质的主要熔融过程热流变化较小、吸热较少,与其含有较少的SFA、较多的PUFA变化规律一致。3种工艺提取的紫海胆性腺脂质的熔融温度均低于人体生理温度(36.6~37.3℃),其与哺乳动物乳脂[27]、藻油[28]相比,具有较好的乳化、吸收与代谢等特性,有利于进一步开发海洋膳食营养脂质产品。
由图7(B)可知,水酶法、Folch法与Matyash法提取的紫海胆性腺脂质均分别在0~20℃和-20~0℃范围内出现1个放热峰,且高温范围的放热峰均比低温范围的放热峰尖锐、峰宽均比低温范围的峰宽窄。由表8可知,水酶法与Matyash法脂质的第一个放热峰Tp((8.83±0.82)℃与(9.66±0.21)℃)均显著低于Folch法((11.73±0.37)℃),水酶法脂质第二个放热峰Tp((-10.56±0.19)℃)显著低于Folch法((-7.70±0.63)℃)与Matyash法((-7.97±0.17)℃),说明水酶法脂质具有较低的结晶温度,与其所含SFA、PUFA含量变化规律一致。由表9可知,从热效应的角度看,水酶法、Folch法与Matyash法提取脂质的第一个放热过程均显著强于第二个放热过程,热效应分别约为第二个放热过程的1.4、1.3倍和1.2倍。脂质加工过程,通常使用结晶过程改善品质及稳定性,因此可利用该结晶特性通过控制温度对脂质进一步分离、纯化,以保证脂质在低温长期贮藏的稳定性。


图7 不同工艺提取紫海胆性腺脂质在熔融(A)与结晶(B)过程的DSC曲线
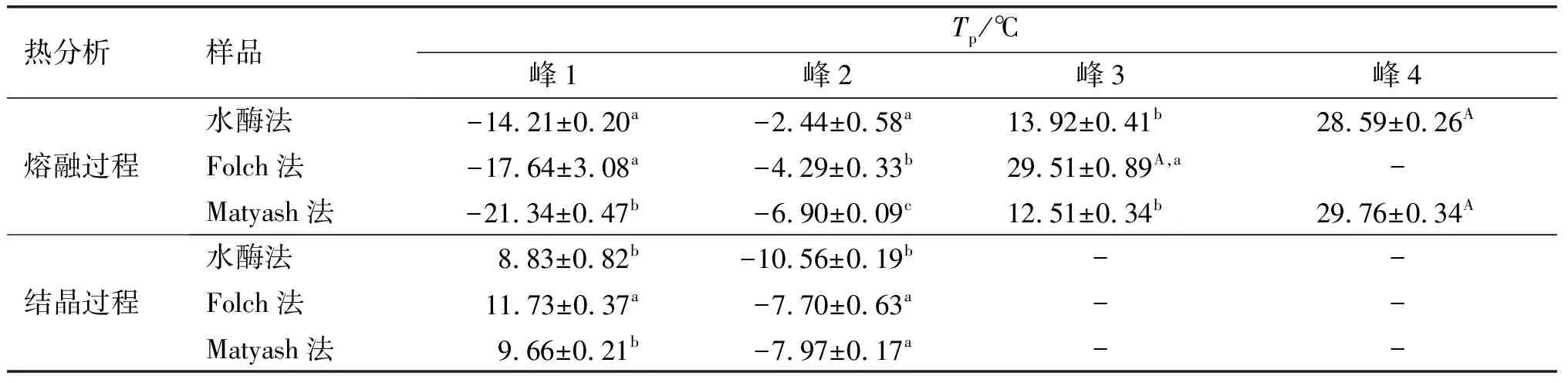
表8 不同工艺提取紫海胆性腺脂质的DSC熔融/结晶曲线中转变温度的比较

表9 不同工艺提取紫海胆性腺脂质的DSC曲线中熔融/结晶热焓的比较
综上,不同工艺提取的紫海胆性腺脂质具有天然油脂同质多晶的特性,水酶法提取的脂质具有较低的熔融与结晶温度,更好的乳化、吸收与代谢的特性,因此水酶法更适合高品质海洋膳食脂质产品的开发。
3 结 论
采用单因素实验和正交实验对水酶法提取紫海胆性腺脂质的工艺进行优化,获得最佳提取工艺条件为料液比1∶20、中性蛋白酶添加量7 500 U/g、酶解温度50℃、酶解时间5 h和pH 7,该条件下脂质得率为(23.22±0.29)%,显著低于Folch法和Matyash法。与Folch法和Matyash法相比,水酶法提取紫海胆性腺脂质的过氧化值较低,碘值较高,SFA含量((51.48±2.16)%)较低,PUFA含量((34.53±0.87)%)较高,EPA与DHA总含量((15.04±0.30)%)较高;营养指标均较好;磷脂得率((4.23±0.36)%)较低;熔融温度与结晶温度较低。由此可见,水酶法工艺所提取的紫海胆性腺脂质品质佳,具有较好的营养价值、较好的预防心血管疾病的功效,较低的熔融与结晶温度。因此,水酶法更适合高品质紫海胆性腺脂质的研制。
