PI3K/AKT信号通路参与地塞米松促进骨髓间充质干细胞内质网应激反应的研究
2022-04-06程锁利牛东生孙玺淳白志刚郭崇军梁钰琪郭舟桐
程锁利,巩 凡,牛东生,孙玺淳,白志刚,黄 朋,郭崇军,梁钰琪,郭舟桐
激素性股骨头缺血性坏死是由大量使用糖皮质激素引起的全身性多发性骨坏死,最常见发生的部位是股骨头,其主要症状是髋关节的活动性疼痛,如果不及时有效的治疗,会进行性的加重,最终导致患者残疾和畸形[1]。虽然糖皮质激素诱导激素性股骨头缺血坏死的确切机制尚不清楚,但它似乎与骨细胞凋亡、内皮细胞凋亡有关。最近的证据表明,骨细胞及内皮细胞的凋亡与内质网应激有关,内质网应激是错误折叠与未折叠蛋白积累的结果,长时间的内质网应激条件下和蛋白质折叠负荷大于内质网折叠能力的情况下,往往会发生细胞功能障碍和死亡[2-4]。因此,了解内质网应激如何在骨细胞、内皮细胞病理生理学中起作用,是对激素性股骨头缺血坏死疾病进行治疗调整的重要一步。本研究探讨DEX对BMSCs细胞增殖和凋亡及BMSCs细胞内ERS相关蛋白表达的影响,初步阐明了部分相关的分子生物学机制,为 SANFH 的临床治疗提供基础性的研究数据。
1 资料与方法
1.1 一般资料:原代人BMSCs(深圳Otwo Biotech公司);Thapsi-gargin (T135258,Aladdin 纯度95%);BYL719(购自 AbMole,M8791);ELISA试剂盒(武汉恒意赛);Cell Counting Kit-8 (CCK-8) (Dojindo);流式细胞仪器(Bio-Rad);Western-blot仪(Bio-Rad);SYBR Green PCR 试剂盒(Thermo Fisher Scientific);
1.2 骨髓间充质干细胞培养:原代人 BMSCs购自 Otwo Biotech (ShenZhen) Inc.。BMSCs在 Dulbecco 改良鹰培养基 (DMEM)/1% 青霉素/链霉素/10% 去除外泌体的胎牛血清中培养。细胞培养物保持在37°C 的 5% CO2中,每3天更换一次培养基,并用0.05% 胰蛋白酶/EDTA 传代细胞。Thapsi-gargin(毒胡萝卜素)(T135258,Aladdin,≥95%) 是ERS的特异性诱导剂。在本研究中,将终浓度为 100 nM 的毒胡萝卜素加入培养基中预培养48 h,以诱导 ERS 作为阳性对照BYL719(一种 PI3K抑制剂,购自 AbMole,M8692)用于进一步验证 DEX 是否通过PI3K/AKT 信号通路激活ERS,并且该方法如前所述。将BYL719 溶于含有 5% DMSO 的PBS中,浓度设为10 μM。
1.3 酶联免疫吸附试验(ELISA):将BMSC以1×105细胞/孔的密度一式三份接种在 96孔板中,并在 37 ℃和5% CO2的加湿培养箱中培养72 h。根据制造商的说明使用Quantikine ELISA Kit Human IGF-1 (R&D Systems)来测量细胞培养物上清液中的IGF-1水平。通过内插法从标准曲线中计算对照和样品中的抗原量。
1.4 细胞增殖试验:将 BMSCs以1×105细胞/孔的细胞密度接种到96孔板上含有10%FBS的培养基中。将细胞与指定浓度的DEX孵育24 h,然后使用 Cell Counting Kit-8(CCK-8)(Dojindo)进行计数。用酶标仪在490 nm波长处测量吸光度。
1.5 流式细胞术:用DEXCSR-CK001(Cosmo Bio)处理后,根据制造商的说明,使用膜联蛋白V-FITC细胞凋亡检测试剂盒(Roche Applied Science)对BMSCs进行荧光标记。收集BMSCs颗粒并用冷 PBS 洗涤两次,然后轻轻重悬在500 μL含有5 μL Annexin V-FITC 和5 μL PI的结合缓冲液中,室温下15 min。然后,使用流式细胞术(BD Biosciences)分析样品。
1.6 Western-blot BMSC:用冷磷酸盐缓冲盐水洗涤,并在2X十二烷基硫酸钠(SDS)样品缓冲液100 mM Tris-HCl(pH 6.8)、10 mM EDTA、4%SDS和10%甘氨酸)中裂解1 h。12,000 μg离心15 min,然后用增强型BCA蛋白质测定试剂盒(Beyotime)测量蛋白质含量。每个泳道中等量(30 μg)的蛋白质通过10% SDS-聚丙烯酰胺凝胶电泳分离并转移到聚偏二氟乙烯膜(Millipore)上。为了检测蛋白质表达,使用了以下抗体:PI3K(CST,3 192,1∶1 000)、ATF6 (Cosmo Bio,AM-73-500-B,1∶1 000)、TFAR19 (Abcam,ab83958,1∶1 000)、IGF1 (Cosmo Bio,KM2076,1∶1 000),IRE1a (Abcam,ab146176,1∶1 000),AKT (Abcam,ab62352,1∶1 000),β-catenin (CST 84800,1)。抗兔 (111-035-003) 和抗小鼠 (115-035-003) HRP 偶联二抗购自 Jackson ImmunoResearch,使用蛋白质印迹鲁米诺试剂 (Santacruz,sc-2048) 显示信号。
1.7 定量实时 PCR (qRT-PCR) 验证:使用 TRIzol 试剂(Invitrogen)从组织中提取总 RNA(根据试剂盒说明书操作流程进行)。使用 ImProm Ⅱ逆转录酶(Promega) 逆转录总RNA(根据试剂盒说明书操作流程进行)。使用SYBR Green PCR试剂盒 (Ta Ka Ra)进行实时PCR。使用 2-ΔΔCt方法计算相对表达倍数变化,并使用甘油醛3-磷酸脱氢酶 (GAPDH) mRNA 作为内部对照。所有实验均在相同条件下进行,至少重复3次。合成了以下序列特异性引物:
GAPDH正义:5′-GGTGAAGGTCGGAGTCAACG-3′;
GAPDH 反义:5′-CAAAGTTGTCATGGATGHACC-3′;
IRE1 α正义:5′-GAATTCATGCCGGCCCGGCGGCTGCTGCTG-3′;
IRE1 α反义:5′-AAGCTTGAGGGCGTCTGGAGTCACTGGGGGC-3′;
PI3K正义:5′-TCATCCAGCCTTAGCAAACC-3′;
PI3K 反义:5′-ATGCTTTCACGGTCTTGGTC-3′;
ATF6 正义:5′-CTTCCTCCAGTTGCTCCATC-3′;
ATF6 反义:5′-CAACTCCTCAGGAACGTGCT-3′。

2 结果
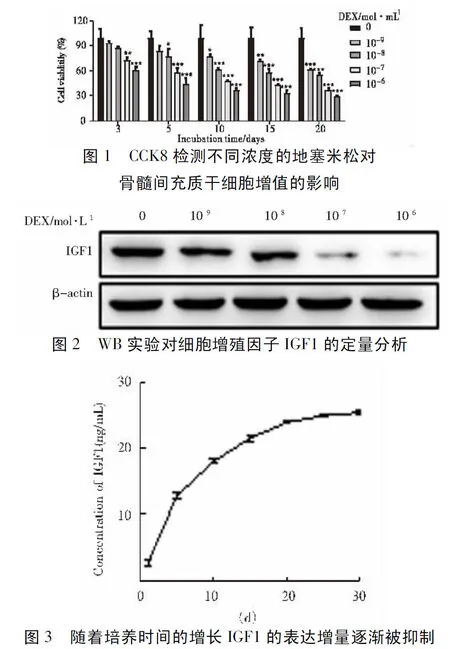
2.1 不同浓度DEX抑制BMSCs增殖结果比较:DEX的浓度设定为10-9mol/L、10-8mol/L、10-7mol/L和10-6mol/L,以不含DEX的培养基为对照,随着DEX浓度的增加和培养时间的延长,BMSCs的细胞活性逐渐降低(P<0.05),见图1。然后进行蛋白质印迹法测定细胞生长因子IGF1的表达,结果表明,随着DEX浓度的增加,IGF1的表达逐渐降低,表明DEX可以抑制BMSCs的增殖见图2。ELISA法定量分析 BMSCs中IGF1 的分泌见图3,数据表明,随着浓度的增加,IGF11的浓度呈现上升的趋势,在20 d时趋于稳定,DEX的浓度为10-7mol/L。
2.2 不同浓度DEX对BMSCs凋亡的影响:流式细胞术分析结果表明,随着DEX浓度的增加,BMSCs的凋亡百分比逐渐增加(图4A和图4B,目录后)。随着DEX浓度的增加,凋亡相关蛋白 TEAR19 的表达增加(P<0.05),见图5(目录后),表明DEX可以促进BMSCs的凋亡。
2.3 DEX激活BMSCs的ERS:检测BMSCs经DEX处理后两种ERS相关因子(IRE1a 和 ATF6)的表达。qRT-PCR结果显示,随着DEX浓度的增加,ATF6和IRE1a的mRNA表达显著增加(P<0.05),见图6(目录后)。此外,从蛋白质印迹分析中获得了类似的结果,随着DEX浓度的增加,ATF6、p-IRE1a/IRE1a蛋白的表达明显升高(P<0.05),见图7(目录后)。qRT-PCR 和蛋白质印迹分析均表明,DEX 处理可能通过调节 ERS 相关蛋白(ATF6和 IRE1a)来激活 BMSCs 的 ERS。
2.4 DEX通过PI3K/AKT通路激活BMSCs的ERS:Western blot和qRT-PCR实验结果表明,BMSCs经DEX处理后,PI3K、AKT蛋白的表达显著增加(P<0.05),见图7(目录后)。考虑到当DEX浓度增加时PI3K的表达增加,使用BYL719(一种PI3K抑制剂)进一步验证DEX是否通过PI3K/AKT信号通路激活ERS。在这个过程中,毒胡萝卜素用于诱导ERS。DEX显著促进PI3K和AKT蛋白的表达,诱导TEAR19的增加和IGF1的减少(P<0.05),见图8(目录后)。Thapsigargin 是一种 ERS特异性诱导剂,对这些蛋白质的作用与 DEX 相似,而且作用更明显。在 DEX 的基础上联合 BYL719显著降低了DEX对PI3K、AKT和TEAR19 的促进作用,以及对 IGF1 的抑制作用。这表明使用 BYL719可能会部分缓解DEX引起的ERS。图9(目录后)显示,BYL719不仅促进细胞活力,而且挽救了DEX对细胞活力的抑制作用 (P<0.05)。此外,BYL719的加入也减弱了 DEX 对细胞凋亡的促进作用(P<0.05)。这些数据表明抑制PI3K/AKT减少了DEX对增殖的抑制和对细胞凋亡的促进。以上均表明DEX通过PI3K/AKT途径激活ERS,影响BMSCs的细胞行为。
3 讨论
糖皮质激素是一种由人肾上腺皮质分泌的类固醇激素,参与调节糖、脂肪、蛋白质的生物合成和代谢以及炎症反应[5-6]。1953年,Pietrogrande 等人报道了首例应用糖皮质激素后股骨头坏死的病例[7]。近年来,由于糖皮质激素的广泛使用,SANFH的患病率不断上升,约占非创伤性股骨头坏死的51%,并呈年轻化趋势。大量研究表明,SANFH的发生与多种因素有关[8-9]。目前其发病机制和病理过程尚未阐明,但提出了多种假说,主要包括两种学说:①细胞坏死学说,包括脂肪代谢障碍、骨质疏松、骨内压增高、血管内凝血等。②细胞凋亡学说,包括激素代谢、骨髓基质干细胞脂肪分化、基因多态性等的影响。疾病的发展可能对股骨头造成不可逆的损伤,严重影响患者的生活质量,任何治疗都不能完全逆转疾病的进展。因此,研究SANFH的发病机制对于预防、诊断和治疗具有重要意义。
研究表明在糖皮质激素作用下,BMSCs可分化为脂肪细胞,引起细胞增殖肥大,导致骨缺血性坏死[10]、大剂量DEX可影响BMSCs的脂质代谢[11-12]。本研究证明DEX可以抑制BMSCs的增殖和促进其凋亡,并且这种作用以与剂量无关的方式增强。我们的结果与之前的研究一致,本研究发现DEX既可以抑制BMSCs的增殖,也可以促进BMSCs的凋亡。BMSCs功能异常会导致ERS,早期ERS反应由三种跨膜受体即PERK、ATF6 和 IRE1 介导[13]。这是非常经典的理论,但在实验中却发现并非是单一的,这恰恰支持了生物经济学的基本原理,在正常细胞中ATF6和IRE1与内质网腔中的分子伴侣GRP78结合以维持非激活状态。当压力发生时,两个受体分离,导致受体激活和 ERS。早期ERS是一种促生存反应,可以帮助减少内质网中未折叠蛋白的积累,恢复内质网的功能。但当内质网不足以保护细胞存活时,ERS会作为凋亡信号的起源诱导细胞凋亡[14],我们已经证明DEX可以激活BMSCs的ERS。在ATF6和IRE1中,PI3K/AKT的表达随DEX浓度的变化而变化。因此,我们在接下来的研究中主要探讨了PI3K/AKT通路涉及 DEX 介导的 BMSCs 增殖和凋亡的潜在分子机制。
众所周知,PI3K/AKT是非常经典的调控通路,参与了很多的细胞活动。先前的研究报告称,PI3K/AKT的下游因子非常多[15],可以诱导细胞状态。我们检测了不同浓度DEX下相关细胞蛋白的表达变化,发现DEX可以增加PI3K/AKT的磷酸化水平,DEX 还可以诱导蛋白的易位,当ERS过多时,会启动细胞的凋亡加入。BYL719可以逆转DEX对BMSCs细胞行为的影响,但三次实验的结果表明其逆转的强度似乎在细胞的传代有下降的趋势,所以说调控肯定是多节点、多通路的[15]。
本研究探讨了DEX对BMSCs细胞行为的影响,结果表明DEX可促进BMSCs凋亡,抑制细胞活力,在调节BMSCs的ERS中发挥重要作用。进一步深入的机制研究表明,DEX可以通过激活PI3K通路来激活或者部分激活BMSCs的ERS现象,并影响BMSCs 的细胞行为。本研究可为DEX在SANFH临床治疗中的应用提供部分基础理论依据。
