轮状病毒NSP1和NSP3蛋白真核表达载体构建、表达及其调控Ⅰ型干扰素信号通路的功能
2022-04-06李凤迪王嘉瑞刘新宇黄海岩叶丽萍
李凤迪,王嘉瑞,刘新宇,黄海岩,叶丽萍,曾 艳,曹 欣
(1.西北民族大学生物医学研究中心,生物工程与技术国家民委重点实验室,兰州 730030;2.西北民族大学生物医学研究中心,甘肃省动物细胞技术创新中心,兰州 730030;3.西北民族大学生命科学与工程学院, 兰州 730030;4.吉林农业大学动物科学技术学院,吉林省动物微生态制剂工程研究中心,长春 130118)
【研究意义】轮状病毒(Rotavirus, RV)属呼肠孤病毒科,轮状病毒属,基因组由11段dsRNA组成,共编码12种蛋白,包括6种结构蛋白(VP1~VP4,VP6及VP7)和6种非结构蛋白(NSP1~NSP6)[1-2]。其中结构蛋白构成病毒的3层衣壳,而非结构蛋白影响病毒的复制和基因表达调控过程[3]。轮状病毒是引起幼儿和动物幼畜病毒性腹泻的重要病原体[4-5]。结合RV的基因组结构和抗原性将其分为7个组即A~G,其中A~C组能引起人畜感染,D~G组主要引起动物感染,而A组轮状病毒又是导致幼儿和动物幼畜腹泻的主要病原体。人和动物在感染轮状病毒后,轻者症状为呕吐、厌食、腹泻、脱水等,严重者可导致死亡[6-7]。【前人研究进展】NSP1蛋白由RV的第5段基因编码,在RV蛋白质组中保守程度最低,不同来源毒株的NSP1差异较大。NSP1通过多种途径拮抗干扰素应答。NSP1通过蛋白酶体途径可使IRF3快速降解,缺乏IFN启动子活性[8-9]。NSP3蛋白通常由RV7,8或9基因片段编码,具体的基因片段与病毒株的种类有关,一般由313个氨基酸残基组成,为非糖基化蛋白。Trujillo-Alonso等[10]研究发现轮状病毒感染诱导了UPR(Unfolded protein response,未折叠的蛋白反应),而UPR在翻译水平上被病毒非结构蛋白NSP3抑制。这种反应似乎是由病毒复制周期中合成的病毒产物触发的,更有可能是由一种或多种病毒蛋白合成的,而不是由病毒dsRNA触发的,与谷凤丽等[3]从感染RV的MA104细胞裂解物中分离得到具有复制酶活性的NSP3,都表明NSP3可能在病毒的复制和形态中起重要作用。【本研究切入点】本文对猿轮状病毒SA11株病毒的NSP1和NSP3的基因进行克隆和真核表达载体构建,基于双荧光素酶报告基因系统判定NSP1和NSP3蛋白对IFN-β/ISRE报告基因活性的影响,初步确定NSP3蛋白对IFN-I信号通路的调控功能。【拟解决的关键问题】轮状病毒NSP3蛋白对IFN-I信号通路的调控作用初探,为研究NSP3蛋白如何拮抗宿主IFN-I抗病毒反应的分子机理提供研究材料和奠定理论基础。
1 材料与方法
1.1 供试材料
1.1.1 细胞系、载体和菌种 人胚肾上皮细胞(HEK293T)由吉林省动物微生态制剂工程研究中心保存;pRK-Flag载体、pRK-HA载体、pUCm-T载体由本实验室保存,感受态菌种为大肠杆菌DH5α菌种。
1.1.2 主要试剂 DMEM高糖培养基、0.25%胰蛋白酶、PBS磷酸盐缓冲液、青霉素—链霉素溶液(双抗)、胎牛血清(FBS)、各种限制性内切酶(SalI-HF、NotI -HF)、T4 DNA连接试剂盒、Lipo6000TM转染试剂、Western一抗稀释液、HA标签抗体、Flag标签抗体、萤火虫荧光素酶裂解液、双荧光素酶检测试剂盒等。
1.1.3 主要设备 全自动高压灭菌器、微量移液器(2.5、10、100、200、1000 μL)、PCR扩增仪、琼脂糖凝胶电泳槽、凝胶成像分析系统、离心机、摇床、化学发光仪Amersham Imager 600 System、荧光检测仪等。
1.2 引物设计
根据GenBank上Rotavirus A NSP1 gene for NSP1, strain: SA11(GenBank: LC178570.1)和Rotavirus A NSP3 gene for NSP3,strain: SA11(GenBank: LC178572.1)基因序列分别设计上下游引物,序列如表1。引物设计时需在其前加入限制性内切酶位点(SalⅠ为上游引物,NotⅠ为下游引物)及保护性碱基,SalⅠ限制性内切酶识别位点前加GTCGAC保护碱基,NotⅠ限制性内切酶识别位点前加GCGGCCGC保护碱基。引物提交生工生物工程(上海)股份有限公司进行合成[11]。
1.3 PCR扩增
以pUCm-T克隆载体为模版,通过PCR扩增技术进行目的基因片段NSP1和NSP3的扩增,反应体系为100 μL,反应体系如表2。反应程序为:预变性98 ℃ 20 s;变性98 ℃ 10 s,退火55 ℃ 5 s,延伸72 ℃30 s,共循环30次;最终延伸72 ℃ 2 min。PCR产物经核酸电泳验证正确后将条带切下,用康为胶回收试剂盒进行回收,回收产物与TaKaRa rTaq酶1∶1混合后,72 ℃延伸15 min,使目的基因加上A尾,用康为DNA纯化试剂盒纯化PCR产物。纯化产物用于连接或-20 ℃保存。

表1 Rotavirus A NSP1和NSP3的引物信息

表2 PCR反应体系
1.4 重组质粒的构建及测序鉴定
将加了A尾的NSP1和NSP3片段与TaKaRa 的pMD18-T载体连接,16 ℃连接过夜,连接体系如表3。连接的产物通过热激法转化至DH5α感受态菌中37 ℃摇床培养1 h,取适量菌液涂布带有Amp抗性的LB平板37 ℃培养过夜,挑取单菌落于液体LB培养基(含100 μg/mL Amp)中37 ℃振荡培养过夜,通过康为质粒小量提取试剂盒提质粒,用SalI和NotI 进行双酶切37 ℃4 h,通过琼脂糖凝胶电泳检测酶切产物,将大小正确的片段进行胶回收。

表3 连接反应体系
1.5 连接至真核表达载体
酶切产物连接至pRK-Flag/pRK-HA载体。16 ℃连接过夜,连接体系如表4。连接产物通过热激法转化DH5α,提取质粒进行双酶切验证,验证正确的重组质粒用康为质粒中提试剂盒提取无内毒素质粒,用于转染,并送往生工生物公司测序。

表4 连接反应体系
1.6 转染
以2×105cell/孔HEK293T细胞接种于24孔板,待细胞长至70%~90%时,,将构建成功的质粒进行转染。用等体积DMEM分别稀释pRK-Flag-NSP1/pRK-HA-NSP1和pRK-Flag-NSP3/pRK-HA-NSP3质粒以及Lipofectamine 6000 1 μL/孔转染试剂,充分混匀室温静置5 min,再将质粒混合物与转染试剂混合物轻轻混匀室温静置20 min,将混合物缓慢滴加至HEK293T中,37 ℃,5% CO2培养箱内培养24 h。
1.7 Western Blot 鉴定蛋白的表达情况
弃去细胞培养基后,用RIPA和2×SDS-PAGE Buffer混合物进行裂解,100 ℃金属浴10 min,12 000 r/min离心1 min。取上清进行聚丙烯酰胺凝胶电泳,经SDS-PAGE后将蛋白转印至NC膜,5%脱脂奶粉封闭1 h,孵育一抗稀释液/二抗稀释液各1 h后,利用化学发光仪Amersham Imager 600 System系统成像分析。
1.8 双荧光素酶报告基因检测
HEK293T细胞以2×105个细胞每孔接种于24孔细胞培养板,待其融合度达70%左右按照1.7步骤转染。分别转染IFN-β-Luc、ISRE-Luc、和pRL-TK质粒同时转染pRK-Flag-NSP1和pRK-Flag-NSP3作为实验组、转染空载体质粒作为阴性对照、转染通路上游质粒pRK-Flag-RIG-IN作为阳性对照,每组设置3个重复。转染24 h后,吸弃细胞培养液,加入100 μL荧光素荧光素酶细胞裂解液,置于震板仪上震荡10 min,取20 μL上清与萤火虫荧光素酶底物以及海肾荧光素酶底物按1∶1∶1混匀,利用荧光素酶检测仪检测萤火虫荧光和海参荧光。记录2次荧光值以及二者比值。
2 结果与分析
2.1 PCR扩增目的基因
以带有轮状病毒SA11株NSP1、NSP3编码基因的克隆载体为模板进行PCR基因扩增,经琼脂糖凝胶电泳后得到NSP1和NSP3基因条带(图1),条带顺序依次是2000 DNA marker、NSP1、NSP1、2000 DNA marker、NSP3、NSP3。目的条带大小在900~1500 bp。经查阅, NCBI中NSP1基因大小约为1491 bp,NSP3基因大小约948 bp,与预期一致,可进行下一步试验。

图1 NSP1和NSP3基因PCR扩增结果Fig.1 Result of PCR amplification product of NSP1 and NSP3 gene
2.2 pRK-Flag-NSP1/pRK-HA-NSP1和pRK-Flag-NSP3/pRK-HA-NSP3重组质粒的鉴定
对通过Amp抗性筛选的菌落提取质粒,进行双酶切鉴定,通过琼脂糖凝胶电泳检测,得到2条约为1491和948 bp的条带,符合预期结果见图2,NSP1和NSP3特异性条带与预期一致,故可确认NSP1和NSP3基因插入到pRK-Flag/pRK-HA载体中,但重组质粒 pRK-Flag-NSP1/pRK-HA-NSP1和pRK-Flag-NSP3/pRK-HA-NSP3能否表达NSP1和NSP3 蛋白仍需进一步验证。

图2 pRK-Flag-NSP1/pRK-HA-NSP1和pRK-Flag-NSP3/pRK-HA-NSP3重组质粒鉴定Fig.2 The identification of pRK-Flag-NSP1/pRK-HA-NSP1 and pRK-Flag-NSP4/pRK-HA-NSP4 recombinant plasmid
2.3 真核表达载体的表达验证
将重组质粒转染HEK293T细胞,转染24 h后裂解细胞提取蛋白,处理后通过Western Blot,以HA标签抗体或Flag标签抗体作为一抗,检测表达水平,图3a~d分别为pRK-HA-NSP1、pRK-HA-NSP3、pRK-Flag-NSP1、pRK-Flag-NSP3,结果显示,表达的NSP1和NSP3蛋白分别为59和37 kDa,可见与预期结果相符,表明目的蛋白表达,可进行下一步试验。
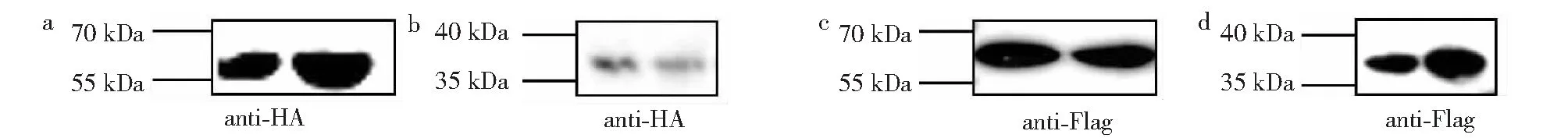
图3 Wester blotting 检测结果Fig.3 The identification result of protein expressed by Western-blotting
2.4 检测NSP1、NSP3蛋白对IFN-β和ISRE启动子活性的影响
为进一步探究NSP1和NSP3蛋白对I型干扰素表达的影响,利用双荧光素酶报告基因系统,在IFN-I通路上游关键信号分子RIG-IN刺激下,检测NSP1和NSP3蛋白对IFN-β和ISRE启动子活性的影响。由图4显示,NSP1和NSP3蛋白可抑制由RIG-IN介导的IFN-β和ISRE启动子活性,证明NSP1和NSP3蛋白对IFN-β信号通路有抑制作用。

图4 NSP1和NSP3抑制RIG-IN介导的IFN-β和ISRE启动子活性Fig.4 NSP1 and NSP3 inhibition of the IFN-β and ISRE promoter activities induced by RIG-IN
3 讨 论
本研究对合成猿轮状病毒SA11株的非结构蛋白NSP1和NSP3基因进行PCR,获得目的基因片段扩增,并在体外构建真核表达载体pRK-Flag-NSP1/pRK-HA-NSP1、pRK-Flag-NSP3/pRK-HA-NSP3,成功验证表达出目的蛋白并获得其蛋白印迹。后续检测了NSP1和NSP3蛋白对IFN-β和ISRE启动子活性的影响,结果显示,二者均可抑制由RIG-I N介导的IFN-β和ISRE启动子活性,初步证明了NSP1和NSP3蛋白对IFN-β信号通路有抑制作用。
轮状病毒是导致婴幼儿病毒性腹泻的最重要原因之一,全世界每年约有50万人死于轮状病毒。正因为RV具有强突变性,也存在季节性和地域性的问题,导致对RV的医治仅在改善阶段,无法达到清除的效果[1,10]。其中RV NSP1是拮抗宿主先天性免疫的关键蛋白,是病毒产生对抗IFN-I的广谱拮抗剂,从而抑制IFN-I的产生,拮抗先天性免疫[12-13];NSP3蛋白与病毒粒子感染细胞有关,前人已经研究了病毒蛋白与RNA之间的相互作用,其N端可以与RV mRNA3′保守末端结合,C端与Poly(A)结合引起宿主细胞关闭mRNA的翻译[3, 14-15],从而使NSP3在轮状病毒复制中的起到作用。就目前了解到NSP1蛋白已有对干扰素信号通路的研究报道,本研究结果也符合前人研究的结论,确证了NSP1蛋白拮抗先天免疫的功能。目前NSP3蛋白对IFN-I信号通路的调控机制知之甚少,本试验对其调控IFN-I信号通路的功能进行初步探究,发现NSP3对RIG介导抗病毒免疫具有明显的抑制作用。为阐明NSP3蛋白产生抗病毒作用的原理提供理论依据,为后续揭示NSP3蛋白调节IFN-I功能及进一步研究病毒感染后机体抗病毒天然免疫过程具有重要意义。
4 结 论
本研究以PCR技术扩增猿轮状病毒SA11株NSP1和NSP3的基因序列,将其克隆到pRK真核表达载体中,成功构建重组质粒pRK-Flag-NSP1/pRK-HA-NSP1和pRK-Flag-NSP3/pRK-HA-NSP3,通过Western Blot检测细胞中存在特异性外源蛋白的表达。本研究发现NSP1和NSP3可以抑制RIG-IN介导的IFN-β及ISRE启动子活性,为后续探索NSP3蛋白调控IFN-I信号通路具体分子机制提供实验基础,为将来抗RV疫苗的开发和有效预防RV感染奠定理论基础。
