体质量指数对IgA肾病患者临床病理及预后的影响
2022-04-04高鹏丽陈丽丽张嘉倩陈怿鹏亓晓菁邢广群
高鹏丽,陈丽丽,田 芬,张嘉倩,陈怿鹏,亓晓菁,邢广群
(青岛大学附属医院 肾内科,山东 青岛 266555)
IgA肾病(IgA nephropathy, IgAN)是我国乃至世界范围内常见的原发性肾小球疾病,是慢性肾脏病(chronic kidney disease, CKD)和肾功能衰竭的主要病因,多达30%的患者在确诊后约20年内发展成为终末期肾病(end-stage renal disease, ESRD)。IgAN作为一组临床病理综合征,其临床表现多样,预后与转归有很大不同[1-4]。一些大型队列研究显示,IgAN死亡风险增加,并伴随着更高的死亡率和更短的预期寿命。一项流行病学研究显示,与IgAN相关的代谢综合征是CKD进展的重要危险因素[5]。然而,大多数临床对照研究都集中在确定高血压、高尿酸与肾脏疾病之间的关系,很少有研究探讨体质量指数(body mass index,BMI)与IgAN的临床病理及预后的关系[6-7]。在一项大型亚洲人群的研究中发现,低BMI和高BMI都与各种原因导致的死亡风险增加相关,总体上呈 “U”形关联[8]。在IgAN患者中,BMI过高,特别是BMI>25 kg/m2,是肾脏疾病进展的危险因素[9-10]。另外,有些研究认为,体重不足是IgAN等肾脏疾病进展的独立危险因素[11]。此外,在过去10年里,若干临床流行病学研究发表,尽管存在很大的局限性,但它们揭示了BMI与CKD甚至ESRD的发生有关[12-13]。因此,本研究收集2013年2月至2021年5月在青岛大学附属医院就诊,并行肾穿刺活检经组织病理学确诊为原发性IgAN的初治患者,依据BMI将其分为3组,在既往研究较多的指标基础上,纳入了血管损伤程度、炎细胞浸润程度等指标。以更深入地了解BMI对IgAN临床病理特征及预后的影响,并探讨影响IgAN合并超重肥胖患者预后的危险因素。
1 资料与方法
1.1病例选择 收集2013年2月至2021年5月在青岛大学附属医院就诊,并行肾穿刺活检经组织病理学确诊为原发性IgAN的初治患者肾活检时的临床病理资料及预后。排除标准:①年龄<18岁;②继发性IgAN:系统性红斑狼疮、肝硬化、过敏性紫癜等;③肾活检时估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<15 ml/(min·1.73 m2);④临床记录不足、缺失和肾组织活检肾小球数目<8个。本研究经青岛大学附属医院伦理委员会批准(QYFYWZLL26468)。
1.2方法 本研究为单中心、回顾性研究。根据WHO肥胖分类(BMI于患者接受肾组织活检时测得),将所有患者分为以下3组:低体重组19例(BMI<18.5 kg/m2)、正常体重组267例(18.5 kg/m2≤BMI<25.0 kg/m2)、超重肥胖组247例(BMI≥25 kg/m2) 。记录患者肾活检时的临床病理资料,并随访至2021年5月记录患者预后。
1.2.1临床资料 临床资料包括一般资料及实验室资料。一般资料包括:年龄、性别、收缩压(SBP)、舒张压(DBP)、激素或免疫抑制剂使用史、血管紧张素转换酶抑制剂(angiotensin-converting-enzyme inhibitors,ACEI)/血管紧张素Ⅱ 1型受体拮抗剂(angiotensin Ⅱ receptor type 1,ARB)使用史等。实验室资料包括: eGFR、血红蛋白、24小时尿蛋白排泄量、C反应蛋白(C-reactive protein,CRP)、中性粒细胞计数、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血尿素氮(blood urea nitrogen,BUN)、血尿酸(uric acid,UA)、甘油三酯(triglyceride,TG)、胱抑素 C(cystatin C, CysC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、空腹血糖(fasting plasma glucose, FPG)、尿红细胞计数、尿白细胞计数、血清补体C1q(complement 1q,C1q)、血清补体C3 (complement 3,C3)、补体C4 (complement 4,C4)、血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白E(IgE)等。24小时蛋白尿排泄量通过24小时尿液收集来评估。eGFR根据慢性肾脏病流行病学合作研究公式(CKD-EPI)计算。
1.2.2病理资料 所有肾组织标本均通过经皮穿刺活检获得,肾活检标本常规进行光镜、免疫荧光及电镜检查。病理切片由肾脏病理专家进行审查。①使用牛津病理分型标准进行病理评分,包括系膜细胞增生(M0/1),内皮细胞增生(E0/1),节段性硬化/黏连(S0/1),肾小管萎缩/间质纤维化(T0/1/2),新月体病变(C0/1/2)。②炎细胞浸润程度:无明显浸润赋值=0,<25%赋值=1,25%~<50%赋值=2,50%~75%赋值=3,>75%赋值=4。③血管损伤程度:未见明显病变赋值=0,单纯血管壁增厚赋值=1,血管壁增厚合并其他赋值=2,如玻璃样病变等。④免疫荧光下观察肾组织中IgA、IgG、IgM、C3、C4、C1q的沉积强度(“阴性”赋值=0,“+/-”赋值=1,“+”赋值=2,“++”赋值=3,“+++”赋值=4)。
1.2.3预后 复合终点:血肌酐水平翻倍和(或)进入ESRD和(或)肾替代治疗和(或)死亡[14]。

2 结 果
2.1入组情况 2013年2月至2021年5月在青岛大学附属医院肾内科就诊,并经肾活检确诊为原发性IgAN的初治患者共568例。按照排除标准,排除继发性IgAN患者10例,临床记录不足、缺失和肾活检不充分14例,eGFR<15ml/(min·1.73 m2)11例,最终533例纳入本研究。
2.23组临床资料比较
2.2.1一般资料比较 总体发病年龄18~79岁,平均(39.74±13.46)岁,总体BMI(16.7~38.4) kg/m2,平均(24.98±3.72) kg/m2。533例患者中,低体重组19例(3.6%),体重正常组267例(50.1%),超重肥胖组247例(46.3%)。超重肥胖组的年龄、男性占比、收缩压、舒张压、ACEI/ARB使用占比大于低体重组和正常体重组(均P<0.05),正常体重组年龄、收缩压、舒张压、ACEI/ARB使用比例大于低体重组(均P<0.05),正常体重组的男性占比与低体重组比较,差异无统计学意义(P>0.05)。3组激素或免疫抑制剂治疗占比比较,差异无统计学意义(均P>0.05)。见表1。
2.2.2实验室资料比较
2.2.2.13组实验室资料比较 超重肥胖组血红蛋白、24小时尿蛋白排泄量、TG、FPG、血补体C3和C4水平高于低体重组和正常体重组(均P<0.05),而HDL-C水平低于低体重组和正常体重组(均P<0.05),且正常体重组与低体重组上述指标比较,差异无统计学意义(均P>0.05)。低体重组eGFR高于正常体重组和超重肥胖组,且正常体重组eGFR高于超重肥胖组(均P<0.05)。超重肥胖组血UA高于正常体重组和低体重组,且正常体重组血UA高于低体重组(均P<0.05)。超重肥胖组和正常体重组的LDL-C水平均高于低体重组(均P<0.05),但超重肥胖组和正常体重组LDL-C水平比较,差异无统计学意义(P>0.05)。与正常体重组比较,超重肥胖组的IgM水平较低、CRP水平较高(均P<0.05)。低体重组的中性粒细胞计数高于正常体重组(均P<0.05)。3组其他各项指标比较,差异无统计学意义(均P<0.05)。见表2。
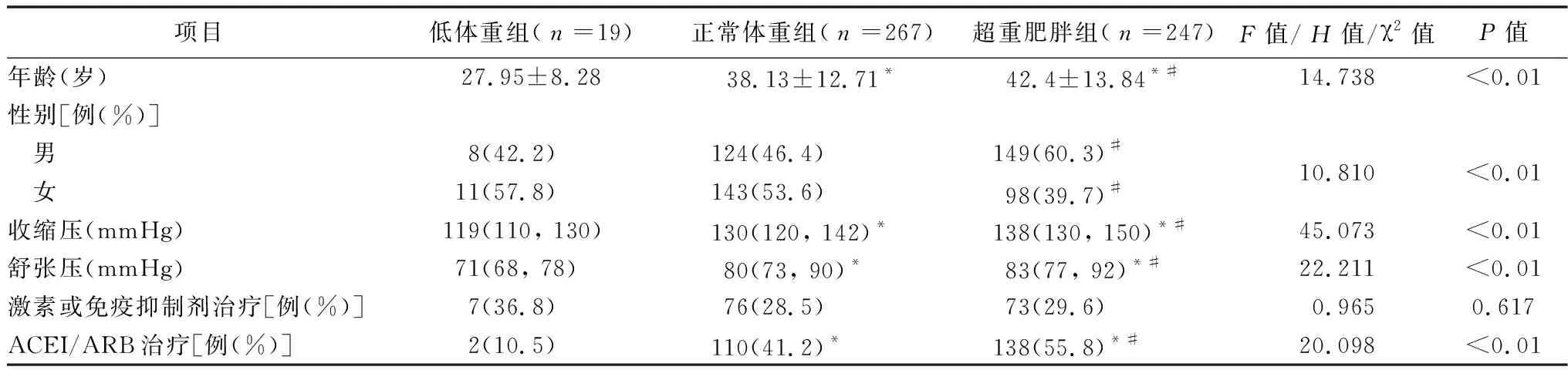
表1 3组一般资料比较
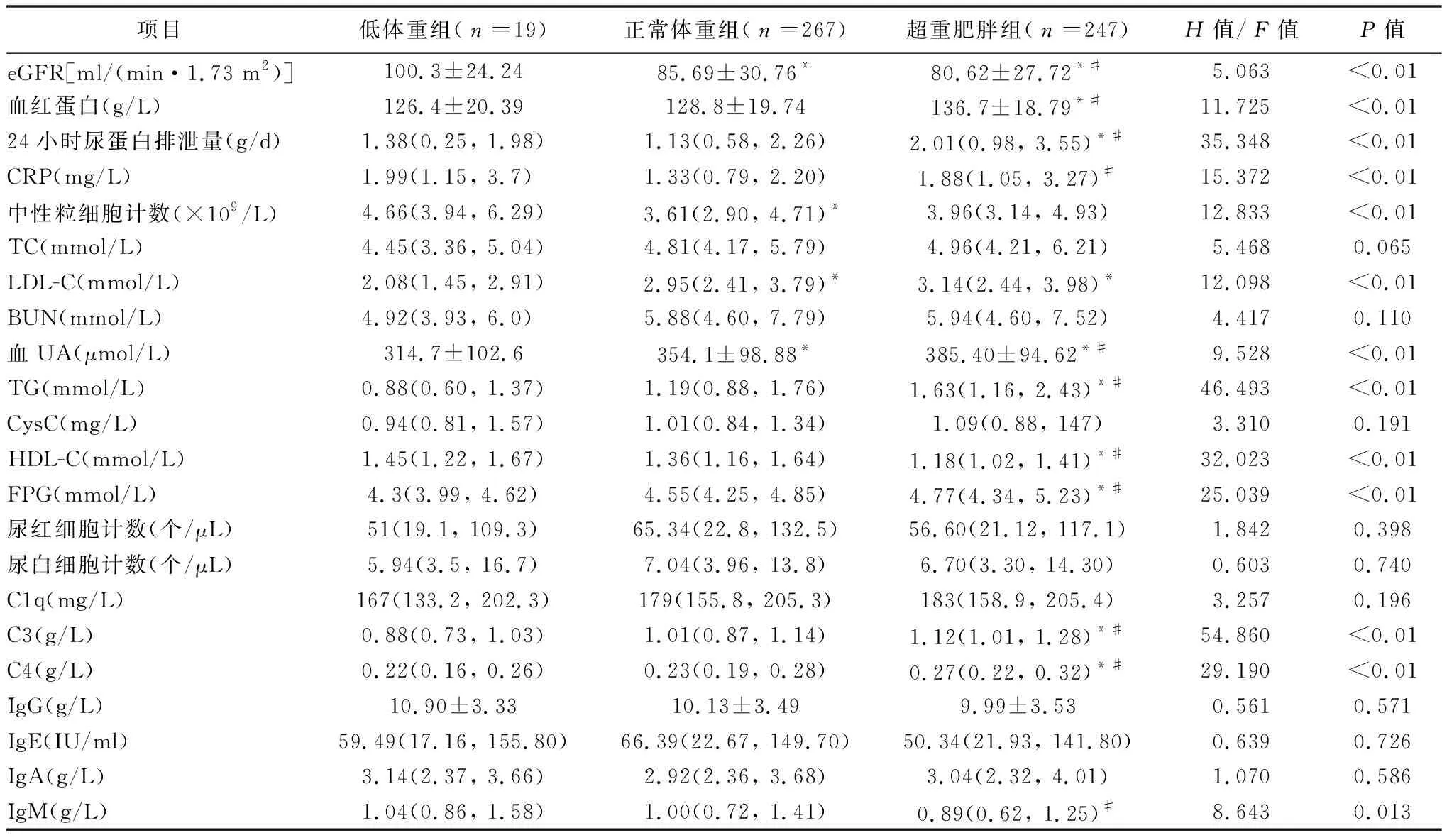
表2 3组实验室资料比较
2.2.2.2按性别分层后3组血UA、血红蛋白、eGFR比较 由于血UA、血红蛋白、eGFR存在性别差异,3组性别差异有统计学意义可能会导致假阳性结果。通过性别分组后发现,在女性中,超重肥胖组血UA高于正常体重组和低体重组(均P<0.05),但低体重组与正常体重组比较,差异无统计学意义(P>0.05);低体重组eGFR高于超重肥胖组(P<0.05);超重肥胖组血红蛋白水平高于体重正常组(P<0.05);其余指标3组比较,差异无统计学意义(均P>0.05)。在男性中,超重肥胖组的血红蛋白高于低体重组(P<0.05)。其余指标3组比较,差异无统计学意义(均P>0.05)。见表3。
2.33组病理资料比较 超重肥胖组、正常体重组的血管损伤程度、炎细胞浸润程度高于低体重组(均P<0.05),但超重肥胖组、正常体重组血管损伤程度、炎细胞浸润程度比较,差异无统计学意义(均P>0.05)。与正常体重组比较,超重肥胖组的系膜C3沉积减弱(P=0.035)。3组牛津病理分型、系膜免疫球蛋白沉积比较,差异无统计学意义(均P>0.05),见表4,图1。
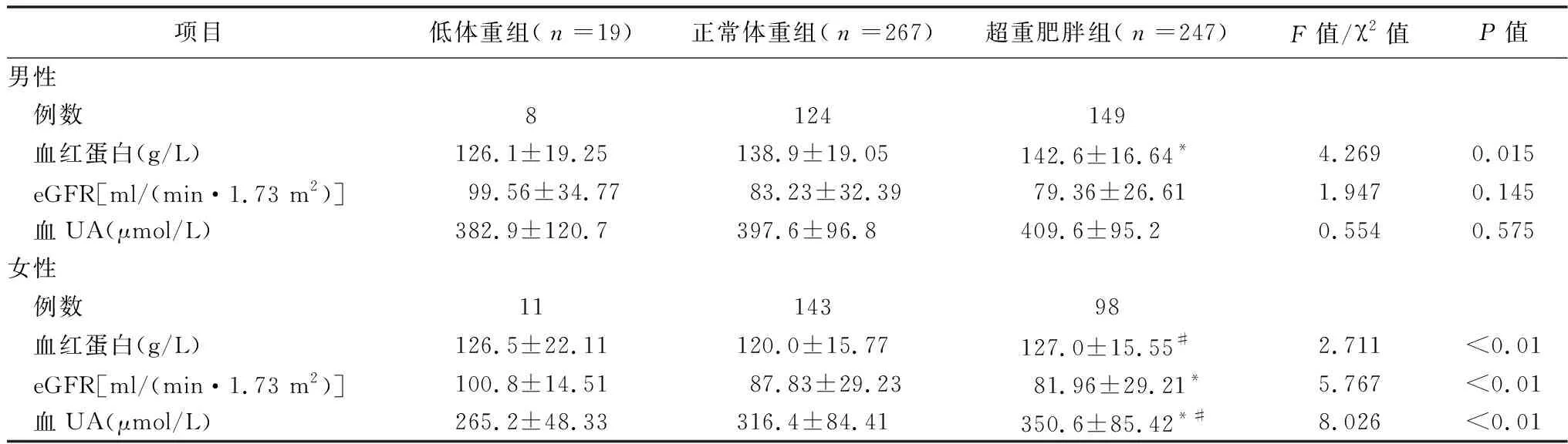
表3 按性别分层后3组UA、血红蛋白、eGFR比较

表4 3组肾脏病理改变的比较
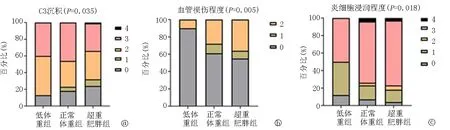
图1 3组C3沉积、血管损伤程度、炎细胞浸润程度比较 a.C3沉积; b.炎细胞浸润程度; c.血管损伤程度
2.43组肾脏累积生存率比较 排除随访时间<6个月的患者后,共计380例,出现终点事件33例(8.6%),其中肾脏替代治疗4例,ESRD 16例,血肌酐翻倍13例。低体重组中位随访时间为20.4个月,出现终点事件共2例(12.5%),均达到ESRD。正常体重组中位随访时间为22.9个月,出现终点事件10例(6.5%),其中肾脏替代治疗2例, ESRD 5例,血肌酐翻倍3例。超重肥胖组中位随访时间为27.7个月,出现终点事件19例(9.0%),其中肾脏替代治疗2例, ESRD 7例,血肌酐翻倍10例。Kaplan-Meier生存曲线表明,正常体重组的肾脏累积生存率高于超重肥胖组(Log-rank检验,χ2=8.702,P=0.003),而超重肥胖组肾脏累积生存率高于低体重组(Log-rank检验,χ2=4.624,P=0.032)。3组的肾脏5年生存率分别为69.8%、75.6%、85.9%,正常体重组的5年肾脏生存率高于超重肥胖组(Log-rank检验,χ2=4.996,P=0.025),而超重肥胖组的5年生存率高于低体重组(Log-rank检验,χ2=5.764,P=0.016)。见图2。
2.5影响IgAN合并超重肥胖患者肾脏预后的危险因素分析 对超重肥胖组进行单因素Cox回归分析,结果显示,起病时eGFR降低、24小时尿蛋白排泄量增加、血红蛋白降低、TG升高、肾小管萎缩/间质纤维化比例≥25%与预后相关(均P<0.05),见表5。将上述指标纳入多因素Cox回归分析,结果显示, 24小时尿蛋白排泄量增加、TG升高、血红蛋白降低是影响IgAN合并超重肥胖患者肾脏不良预后的独立影响因素(均P<0.05),见表6。

图2 3组Kaplan-Meier生存曲线
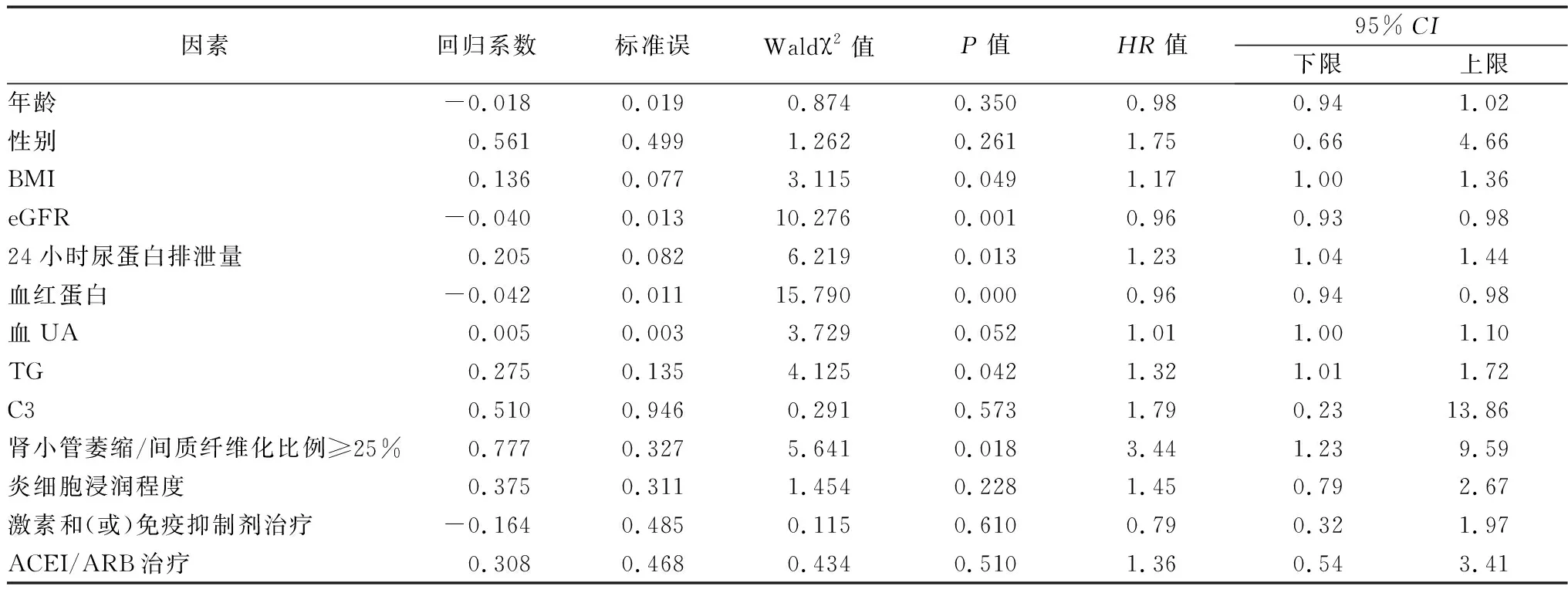
表5 影响IgAN合并超重肥胖肾脏预后的Cox单因素分析

表6 影响IgAN合并超重肥胖肾脏预后的Cox多因素分析
3 讨 论
IgAN是中国最常见的原发性肾小球疾病,20%~40%的患者会缓慢发展为肾功能衰竭,这使得IgAN成为ESRD的主要病因之一。国外一项研究显示,IgAN患者的死亡率比正常人群增加53%,比正常人群提前6年死亡[15]。因此,临床医师应当足够重视IgAN。然而,预测IgAN患者预后十分困难。目前,其发病机制尚未明确,除已知的免疫因素外,可能与高血压、高尿酸、肥胖等多种因素有关。
近年来,随着生活水平的提高,肥胖发病率逐年上升,已成为我国的一大公共卫生问题。在最近的全国调查中,超过50%的中国成年人超重或肥胖[16]。在2019年,超重和肥胖导致非传染性疾病相关的死亡率从1990年的5.7%上升到了11.1%[17]。流行病学资料显示,超重和肥胖是CKD和ESRD的共同危险因素[18-20]。本研究共入选IgAN患者533例,其中46.3%合并超重肥胖,男性较多,发病年龄较大,与既往文献报道基本一致[16]。在对3组临床资料的比较中发现,超重肥胖组的血压(舒张压及收缩压)较高,肾功能损害较为严重,脂质代谢异常者较多,血清C3、C4、CRP水平较高,IgM较低。目前认为肥胖患者发生代谢紊乱的可能机制是高尿酸血症、高血压和高三酰甘油血症等引起的胰岛素抵抗,导致动脉硬化进程加快,从而加重IgAN患者的病情恶化,同时高尿酸可通过多种机制促进肾间质纤维化,进一步加重肾损伤[21-22]。Yonekura等[23]在4 060例原发性肾小球肾炎患者中发现,BMI>25 kg/m2的IgAN患者尿蛋白排泄量明显升高。Fox等[24]发现BMI与IgAN患者的GFR显著相关,是GFR降低的危险因素。国际上关于IgAN病因的研究显示,肥胖可能通过肾小球高滤过或者改变肾小球基底膜的超微结构从而引起24小时尿蛋白排泄量升高[25-26]。在关于C3、C4的研究中,有文献报道,C3和C4由脂肪组织表达和分泌[27],且血清C3与代谢综合征密切相关[28-29]。国外学者发现血清C3和C4水平与IgAN患者BMI、蛋白尿呈正相关,提示肥胖可能通过诱导亚临床炎症而激活补体系统,并且与IgAN患者的肾脏表现密切相关[30-31]。此外,在一项来自瑞典的大型临床研究发现,在调整初始体重、身高、随访时间和生活方式等因素后,血清C3水平仍随体重的增加而升高[32]。一项关于IgM与BMI关系的研究显示,IgM在减轻肥胖相关炎症、葡萄糖耐受不良和胰岛素抵抗中发挥着重要作用,这可能是造成超重肥胖组血清IgM水平较低的原因[33]。
虽然3组牛津分型和免疫球蛋白沉积水平差异无统计学意义,但不能否认超重和肥胖对IgAN肾脏病理结构的影响。在本研究中,超重肥胖组的血管损伤程度、炎细胞浸润程度均高于其他组。我们观察到超重肥胖组主要表现为肾内血管损伤、小动脉血管壁增厚和小动脉玻璃样变性等,与国内外的研究结果一致,他们发现IgAN血管病变的加重程度与BMI有关,推测可能是肥胖引起全身血流量增加或血压升高,使得肾脏灌注增加,从而加重肾脏血管损伤[34]。本研究还发现,系膜C3沉积随着BMI的增加而降低,与Hong等[35]结果一致,他们认为肥胖对IgAN局部补体系统激活的影响是适度的,血清C3与系膜C3的变化显示出了相互矛盾的结果,推测局部补体激活在IgAN的发病过程中起着重要作用。目前有学者已经研究了系膜C3沉积是否对IgAN的疾病进展有影响,但在这个问题上有很多争议。Nam等[36]认为肾小球系膜C3和C4d沉积是IgAN进展的独立危险因素。Park等[37]发现,在根据系膜C3沉积程度分组后,组间肾活检时的eGFR与24小时尿蛋白排泄量无差异。因此,系膜补体沉积可能对肾脏的表现和预后有不同的影响,需要进一步的分析来阐明系膜区补体沉积在IgAN中的病理作用。在对3组肾脏累积生存率的比较中,我们发现超重肥胖组和低体重组的肾脏累积存活率明显低于体重正常组,低体重组、超重肥胖组和正常体重组的5年肾脏生存率分别是69.8%、75.6%、85.9%,差异有统计学意义。这与一项对亚洲人群的大型研究结果一致,即低BMI和高BMI均与各种原因导致的死亡风险增加有关,而且总体上呈“U”形关联[8]。
目前,中国成人肥胖率可高达50%[16],但有关IgAN合并肥胖患者预后危险因素的文献很少,因此,我们进一步分析了IgAN合并肥胖超重患者肾脏生存时间的影响因素。本研究提示,24小时尿蛋白排泄量、TG、血红蛋白是影响患者进入终点事件的独立危险因素。既往研究证实,24小时尿蛋白排泄量对肾脏结局的预测不受其他因素影响[38-39],因此可以认为它对IgAN合并超重肥胖患者的预后具有独立预测作用。国外学者也发现与低体重患者比较,高BMI更容易导致蛋白尿和肾功能不全,而蛋白尿的增多又会加剧肾功能的恶化,从而形成一个恶性循环[40]。肥胖与血红蛋白关系的潜在机制尚未完全明确。有学者认为,高BMI人群食用更多的食物,因此摄入更多的铁导致血红蛋白升高[41]。也有学者认为,肥胖在社会经济地位较低的个体中更为普遍,他们的饮食特点是一般以碳水化合物摄取较多,而含铁食物(如肉类)较少,血红蛋白水平较低[42]。体外研究显示,瘦素和促红细胞生成素具有协同作用,促进红系发育,推测高BMI人群的瘦素-肥胖基因可能是导致肥胖者血红蛋白水平升高的原因[41]。研究表明,肥胖和低血红蛋白是导致运动耗氧量峰值下降和氧化代谢能力下降的重要因素,而且血红蛋白水平低也是IgAN进展的一个危险因素,其不良结局的风险也较高[43-45]。无论是超重肥胖者合并其他代谢综合征,还是高血压或血UA代谢紊乱加重超重肥胖,可能都会加速IgAN的进展,及时干预血压、血脂、血UA等可以延缓IgAN进展对改善长期预后十分重要。
本研究存在一定的局限性:①本研究为回顾性研究,结论可能受研究方法影响,因此需要前瞻性、大规模、长期随访的研究以明确BMI对IgAN的影响。②仅将就诊于青岛大学附属医院的患者包括在内,未纳入我国其他地区患者,不具有普遍性。因此,肥胖与IgAN的临床病理资料及预后的关系有待进一步研究。③本研究未纳入与代谢综合征相关的参数,如腰围等。
综上, IgAN合并超重肥胖患者的临床病理表现更为严重,且预后较差。尿蛋白排泄量、TG、血红蛋白为影响患者进入终点事件的独立影响因素。还需要进一步研究IgAN患者最适合的BMI。在治疗及随访过程中,对于异常BMI的IgAN患者应加强TG等的监测、治疗与管理。
