miR-568通过下调AKR1B10表达影响胶质母细胞瘤细胞的增殖和凋亡
2022-04-04姚庆东张福生张国顺殷会咏张一平孟艳举
姚庆东,张福生,张国顺,殷会咏,张一平,孟艳举
胶质母细胞瘤是常见的原发性脑部肿瘤,中位生存期约为12 个月,具有较高的病死率[1]。该疾病的治疗主要是外科手术辅助放、化疗[2],但目前的治疗方法并不能改善病人的长期生存率。从分子水平了解胶质母细胞瘤的发病机制并寻找有效的治疗靶点对于提高治疗疗效、改善病人生存期具有积极意义。miR-568 是一种在乳腺癌中表达下调的微小RNA(miRNA),miR-568 表达的下调促进乳腺癌转移[3]。但目前,miR-568 在胶质母细胞瘤中的作用还未知。生物信息学软件预测显示,醛酮还原酶家族1 成员B10(AKR1B10)可能是miR-568的靶基因。AKR1B10 主要表达于正常的消化道上皮中,而在其他组织中不表达或表达水平极低[4]。张茜[5]研究显示,AKR1B10 在神经胶质瘤组织中的表达水平高于正常脑组织,其表达水平与胶质瘤大小呈正相关,过表达AKR1B10 可促进神经胶质瘤细胞的增殖。
本研究自2018 年12 月至2019 年7 月,探讨了miR-568 能否靶向AKR1B10 调控胶质母细胞瘤细胞增殖和凋亡,以期为该肿瘤的治疗提供新靶点。
1 材料与方法
1.1 细胞和试剂正常星形胶质细胞HA1800及胶质母细胞瘤细胞U251、T98G 和SHG44,中国科学院上海细胞库;四甲基噻唑蓝(MTT),美国Sigma 公司;胎牛血清,浙江天杭;双荧光素酶活性检测试剂盒、RPMI 1640培养基和BCA蛋白测定试剂盒,北京索莱宝;PCR 实验相关试剂盒,大连宝生物;蛋白质印迹实验所需,中国Abcam 公司;LipofectamineTM2000 试剂盒,美国Invitrogen 公司;引物序列、miR-568 模拟物(mimics)和抑制剂(anti-miR-568)、AKR1B10 小干扰RNA(si-AKR1B10)及小干扰RNA阴性序列(si-NC)、模拟对照序列(miR-NC)和抑制剂阴性序列(anti-miR-NC)、AKR1B10 过表达载体(pcDNA-AKR1B10)和空载体(pcDNA)、AKR1B10野生型(WT)和突变型(MUT)荧光素酶报告基因载体,上海生工。
1.2 方法
1.2.1 细胞培养 正常星形胶质细胞HA1800、胶质母细胞瘤细胞系(U251、T98G 和SHG44)均用完全培养基(含10%胎牛血清的RPMI 1640 培养基)培养。
1.2.2 细胞转染 接种U251 细胞于6 孔板中,接种个数为1.0×105个/孔。培养24h后,利用LipofectamineTM2000 试剂盒分别转染miR-568 mimics(miR-568 组)、miR-NC(miR-NC 组)、anti-miR-568(anti-miR-568 组)、anti-miR-NC(anti-miR-NC 组)、si-AKR1B10(si-AKR1B10 组)、si-NC(si-NC 组)、共转染miR-568 mimics 与pcDNA-AKR1B10(miR-568+pcDNA-AKR1B10 组)、miR-568 mimics 与pcDNA(miR-568+pcDNA 组),转染时间为12 h。检测细胞中miR-568 或AKR1B10 表达,验证转染效果后,用于后续实验。
1.2.3 qRT-PCR 检 测miR-568 和AKR1B10 mRNA表达 Trizol 试剂提取细胞中总RNA,逆转录为cDNA 后,进行扩增。扩增程序:设置温度为95 ℃,预变性5 min;然后95 ℃进行变性(时间为10 s),之后设置温度为60 ℃进行退火(时间30 s),最后设置温度为72 ℃延伸(时间30 s),并重复此过程,共35 个循环。miR-568 正向引物5'-ATGTATAAATGTATACACAC-3',反向引物5'-GTGTGTATACATTTATACAT-3';AKR1B10正向引物5'-TCATACGGATCCACCATGGCCACGTTTGT-3',反向引物5'-CTGCTCGAATTCTCAATATTCTGCATTGAAGGGAT-3';U6 正向引物5'-TCAGTTTGCTGTTCTGGGTG-3',反向引物5'-CGGTTGGCTGGAAAGGAG-3';GAPDH正向引物5'-CATCGAGCACGGCATCGTCA-3',反向引物5'-TAGCACAGCCTGGATAGCAAC-3'。用2-ΔΔCt法计算miR-568相对U6、AKR1B10 mRNA相对GAPDH的表达。
1.2.4 蛋白质印迹法(Western blotting)检测AKR1B10、CyclinD1、p21、Bcl-2和Bax蛋白表达RIPA试剂提取各组细胞中总蛋白,经BCA 法测蛋白浓度后,利用SDS-PAGE 实验进行分离。将分离蛋白先转至PVDF 膜,放于5%脱脂奶粉中进行封闭(时间为1 h)。然后于4 ℃冰箱中,分别放置在沉默醛酮还原酶家族1 成员B10(AKR1B10)(1∶500)、细胞周期蛋白1(CyclinD1)(1∶500)、细胞周期依赖性蛋白激酶抑制因子1A(p21)(1∶50)、B 细胞淋巴癌/白血病-2 基因(Bcl-2)(1∶100)、前凋亡蛋白(Bax)(1∶100)和甘油三磷酸脱氢酶(GAPDH)一抗中孵育过夜。洗膜后,再放在山羊抗兔二抗(1∶200)中孵育(37 ℃、1 h)。加显影液显影,曝光拍照。
1.2.5 MTT 检测细胞增殖 接种转染后细胞至96孔板中,接种个数均为1.0×104个/孔板中。培养24 h、48 h、72 h后,加5 g/L MTT(每孔20 μL),孵育4 h。弃培养基,加二甲基亚砜(每孔150 μL),混合均匀。将96 孔板设入酶标仪卡槽中,设置波长为490 nm,测定吸光度(OD)值。
1.2.6 流式细胞仪检测细胞凋亡 接种转染后细胞至24 孔板中,接种个数均为5.0×104 个/孔。培养48 h后,弃培养液,收集各组细胞。严格按照Annexin VFITC/PI试剂盒操作,上流式细胞仪检测细胞凋亡。
1.2.7 双荧光素酶报告基因实验 接种U251 细胞于6 孔板中,接种个数为1.0×105个/孔。培养24 h后,利用LipofectamineTM2000 试剂盒分别共转染miR-568 mimics 与AKR1B10-WT(或AKR1B10-MUT)、miR-NC 与AKR1B10-WT(或AKR1B10-MUT),转染时间为12 h。然后裂解各组细胞,3 500 r/min 离心10 min。取20 μL 上清液,加100 μL 1×萤火虫或海肾荧光素酶反应工作液,混合均匀,检测萤火虫或海肾的荧光强度。用萤火虫与海肾荧光强度的比值表示细胞荧光素酶活性。
1.3 统计学方法SPSS 22.0 软件分析实验数据。计量资料以表示,两组间比较采用独立样本t检验;多组间比较用单因素方差分析,组间比较采用LSD-t分析。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-568 和AKR1B10 在胶质母细胞瘤细胞系中的表达胶质母细胞瘤细胞系(U251、T98G 和SHG44)中miR-568 表达均低于HA1800 细胞(P<0.05),AKR1B10 mRNA 和蛋白表达均高于HA1800细胞(P<0.05)。见图1、表1。
表1 miR-568和AKR1B10在胶质母细胞瘤细胞系中的表达/
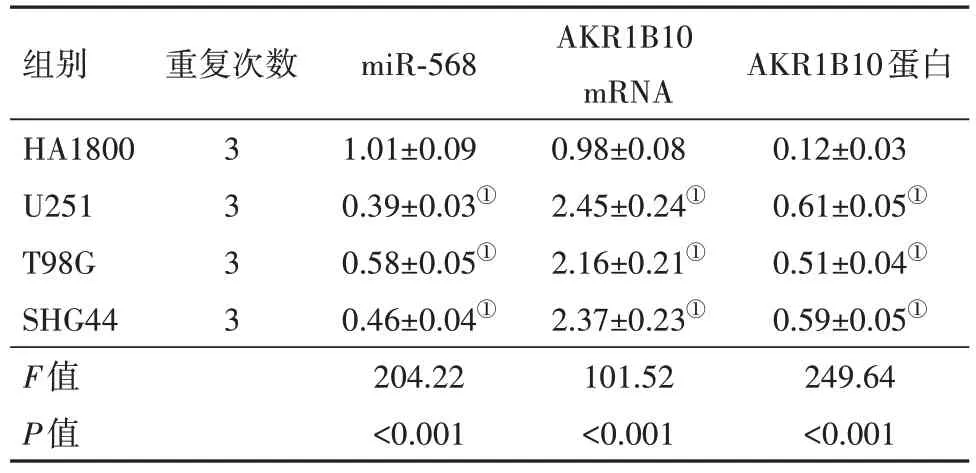
表1 miR-568和AKR1B10在胶质母细胞瘤细胞系中的表达/
注:HA1800 为正常星形胶质细胞,U251、T98G、SHG44 均为胶质母细胞瘤细胞,miR-568为微小RNA-568,AKR1B10 mRNA为醛酮还原酶家族1 成员B10 基因,AKR1B10 为醛酮还原酶家族1 成员B10蛋白。①与HA1800细胞比较,P<0.05。
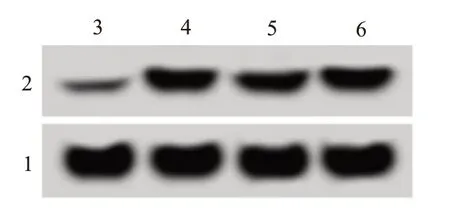
图1 胶质母细胞瘤细胞系中AKR1B10蛋白表达
2.2 miR-568 靶向调控AKR1B10的表达AKR1B10 的3’UTR 与miR-568 互补的核苷酸序列见图2A。
共转染miR-568 mimics 与AKR1B10-WT 的U251 细胞荧光素酶活性为(0.43±0.03),较共转染miR-NC与AKR1B10-WT的U251细胞荧光素酶活性(1.01±0.09)显著降低(t=17.60,P<0.05);共转染miR-568 mimics 与AKR1B10-MUT 的U251 细 胞荧光素酶活性为(1.02±0.09),与共转染miR-NC与AKR1B10-WT 的U251 细胞荧光素酶活性(1.04±0.08),比较差异无统计学意义(t=0.36,P=0.727)。
miR-568组AKR1B10蛋白表达量为(0.24±0.03),较miR-NC 组0.61±0.06显著降低(t=16.55,P<0.05);anti-miR-568组AKR1B10蛋白表达量为(0.96±0.08),较anti-miR-NC组(0.58±0.05)显著升高(t=12.08,P<0.05),见图2B。
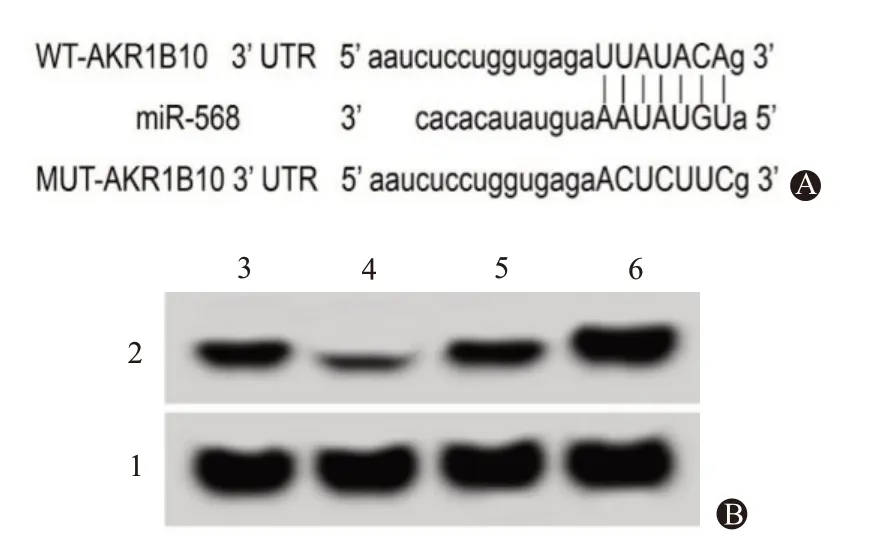
图2 miR-568靶向调控AKR1B10的表达:A为AKR1B10的3’UTR与miR-568互补的核苷酸序列;B为miR-568对AKR1B10蛋白表达的影响
2.3 上调miR-568 对U251 细胞增殖和凋亡的影响miR-568在miR-568 组U251 细胞中的表达量为2.38±0.24,较miR-NC组1.01±0.08显著升高(t=22.46,P<0.05)。miR-568 组U251 细胞培养48 h、72 h 后的OD 值,较miR-NC 组均降低(P<0.05),见表2。miR-568组U251细胞凋亡率为[(22.41±2.15)%],较miR-NC 组(6.58±0.67)%,升 高(t=21.07,P<0.05),见图3。
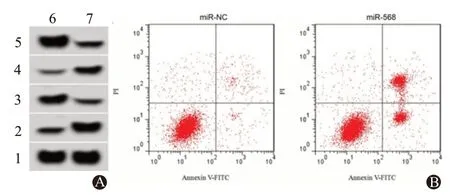
图3 上调miR-568对U251细胞增殖、凋亡的影响:A为上调miR-568的U251细胞中增殖、凋亡相关蛋白表达;B为流式细胞仪检测上调miR-568的U251细胞凋亡
表2 上调miR-568对U251细胞增殖(波长为490 nm时测定吸光度)的影响/
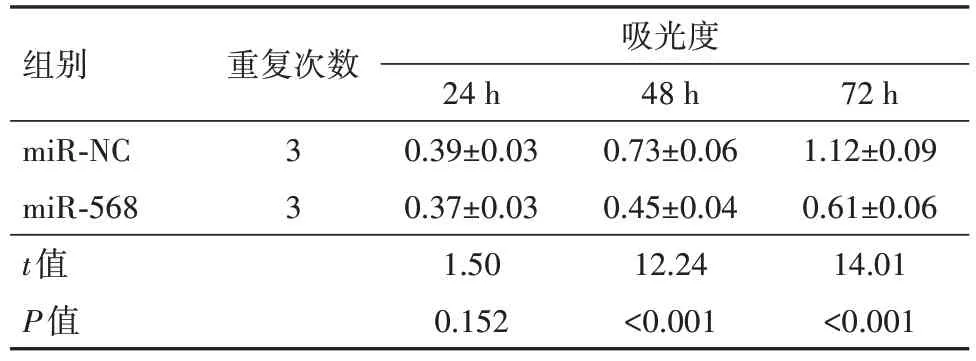
表2 上调miR-568对U251细胞增殖(波长为490 nm时测定吸光度)的影响/
注:miR-NC为微小RNA-568阴性对照,miR-568为微小RNA-568。
同时,miR-568 组U251 细胞中增殖和凋亡相关蛋白CyclinD1 和Bcl-2 表达均低于miR-NC 组[CyclinD1:(0.32±0.03)比(0.78±0.07),t=18.44,P<0.05;Bcl-2:(0.29±0.03)比(0.67±0.07),t=16.29,P<0.05],p21 和Bax 表达均高于miR-NC 组[p21:(0.58±0.05)比(0.22±0.03),t=18.88,P<0.05;Bax:(0.72±0.07)比(0.31±0.03),t=16.66,P<0.05]。
2.4 下调AKR1B10 对U251 细胞增殖和凋亡的影响AKR1B10 蛋白在si-AKR1B10 组U251 细胞中的表达量为0.28±0.03,较si-NC 组0.63±0.06 显著降低(t=15.11,P<0.05)。si-AKR1B10 组U251 细胞培养48 h、72 h 后的OD 值均较si-NC 组均降低(P<0.05),见表3。
表3 下调AKR1B10对U251细胞增殖的影响/
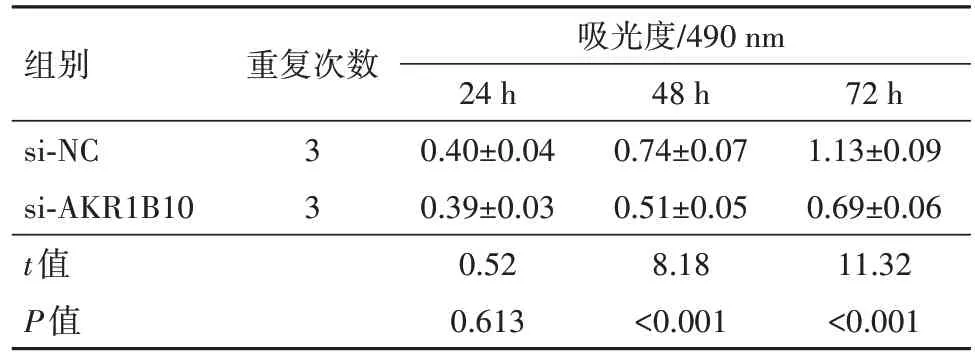
表3 下调AKR1B10对U251细胞增殖的影响/
注:si-NC 为阴性对照,si-AKR1B10 为沉默醛酮还原酶家族1 成员B10基因。
si-AKR1B10 组U251细胞凋亡率为(21.26±2.14)%,较si-NC 组(8.02±0.78)%升高(t=17.42,P<0.05),见图4。
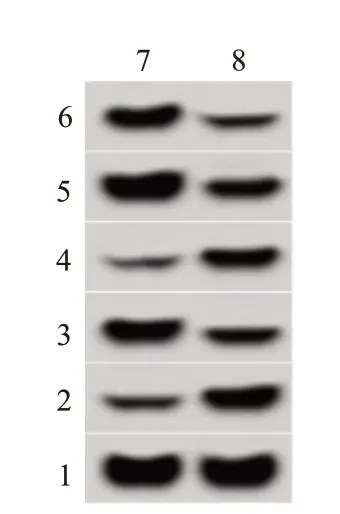
图4 下调AKR1B10的U251细胞中增殖、凋亡相关蛋白表达
同时,si-AKR1B10 组U251 细胞中增殖和凋亡相关蛋白CyclinD1和Bcl-2表达均低于si-NC 组[CyclinD1:(0.35±0.03)比(0.76±0.07),t=17.13,P<0.05;Bcl-2:(0.32±0.03)比(0.69±0.07),t=15.12,P<0.05],p21 和Bax 表达均高于si-NC 组[p21:(0.56±0.05)比(0.21±0.03),t=16.59,P<0.05;Bax:(0.67±0.07)比(0.29±0.03),t=14.65,P<0.05]。
2.5 上调AKR1B10 逆转上调miR-568 对U251 细胞增殖和凋亡的影响miR-568+pcDNA-AKR1B10组U251 细胞培养48 h、72 h 后的OD 值、CyclinD1 和Bcl-2蛋白表达均高于miR-568+pcDNA组(P<0.05),凋亡率、p21和Bax蛋白表达均低于miR-568+pcDNA组(P<0.05)。见图5、表4。
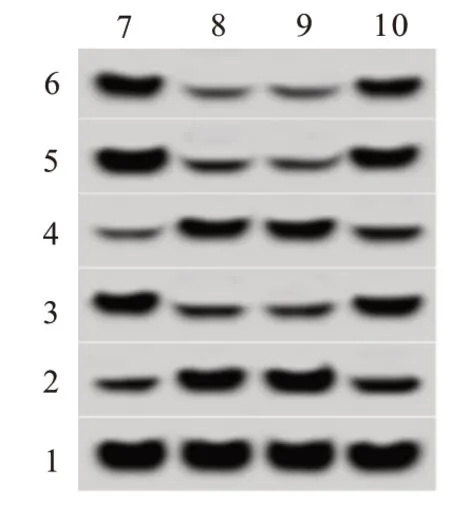
图5 AKR1B10和增殖、凋亡相关蛋白表达
表4 上调AKR1B10逆转了上调miR-568对U251细胞增殖和凋亡的影响/
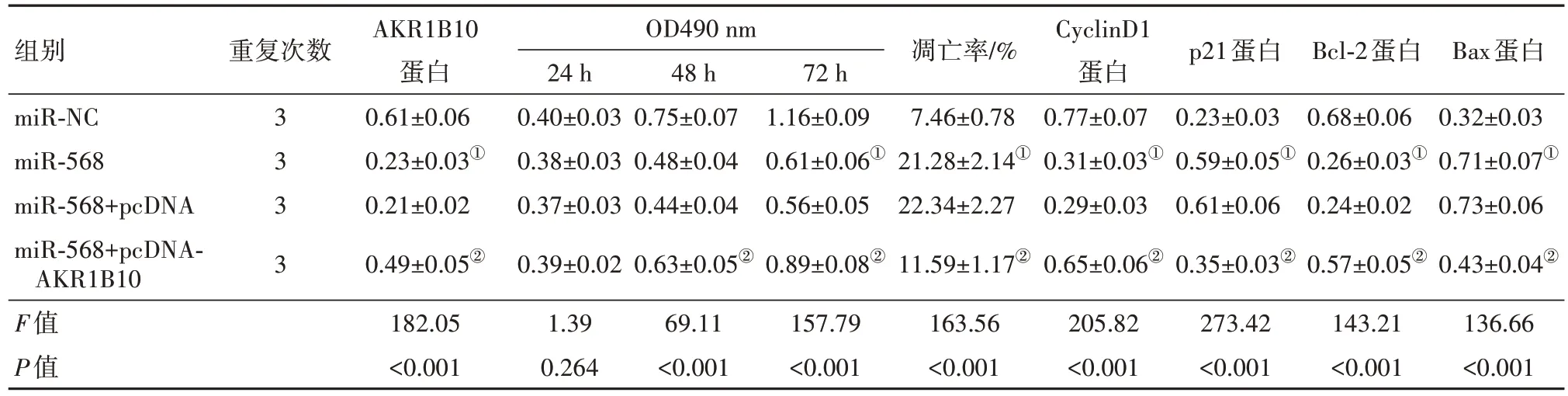
表4 上调AKR1B10逆转了上调miR-568对U251细胞增殖和凋亡的影响/
注:miR-NC 为微小RNA-568 阴性对照,miR-568 为微小RNA-568,miR-568+pcDNA 为微小RNA-568 过表达转染真核细胞的表达空载体,miR-568+pcDNA-AKR1B10为微小RNA-568过表达转染真核细胞的表达醛酮还原酶家族1成员B10基因载体。①与miR-NC组比较,P<0.05。②与miR-568+pcDNA组比较,P<0.05。
3 讨论
胶质母细胞瘤的发生发展与多种编码基因和非编码基因的异常表达密切相关[6-7]。研究表明,胶质母细胞瘤中存在大量异常表达的miRNA,如miR-199a-5p、miR-628-5p 和miR-423-5p,这些miRNA 参与胶质母细胞瘤细胞的恶性生物学行为,是胶质母细胞瘤治疗的潜在分子靶点[8-10]。作为一种miRNA,miR-568 在肿瘤中的表达及其对肿瘤细胞增殖、凋亡等生物学行为的影响也被广泛关注。雷桃香[11]研究显示,miR-568靶向抑制CDK4的表达阻碍宫颈癌细胞增殖;李俊堂[12]研究显示,miR-568 是乳腺癌细胞中表达下调的一种miRNA,上调miR-568对乳腺癌细胞增殖和迁移起抑制作用。
本研究显示,miR-568 在胶质母细胞瘤细胞的表达较正常星形胶质细胞明显降低,提示miR-568参与胶质母细胞瘤的发生和发展;进一步上调母细胞瘤细胞中miR-568 的表达引起细胞增殖能力降低,而凋亡加剧,同时导致细胞中增殖、凋亡相关蛋白CyclinD1 和Bcl-2 表达降低,而p21 和Bax 表达升高,这提示上调miR-568 可能抑制胶质母细胞瘤的发展,miR-568 有可能成为胶质母细胞瘤治疗的分子靶点。
AKR1B10 基因位于7 号染色体长臂3 区3 带,是一种致癌基因。Wang 等[13]研究显示,AKR1B10表达的上调通过促进肝癌细胞的细胞周期进程来促进肝癌细胞生长。Zhou 等[14]研究显示,沉默AKR1B10 表达肺癌细胞的增殖和侵袭能力降低,细胞周期阻滞,AKR1B10 可能是肺癌的潜在诊断和治疗靶点。Xiao 等[15]研究显示,过表达AKR1B1可通过ERK1/2 途径促进胰腺癌细胞增殖,并抑制细胞凋亡。本研究结果显示,AKR1B10 在胶质母细胞瘤细胞中的表达水平明显高于正常星形胶质细胞,下调AKR1B10 表达可抑制胶质母细胞瘤U251 细胞增殖,并诱导其凋亡,提示下调AKR1B10有可能延缓胶质母细胞瘤的发展进程。为探究miR-568 抑制胶质母细胞瘤细胞增殖及促进其凋亡的分子机制,本研究证实了miR-568 靶向结合并负调控AKR1B10。此外,本研究利用恢复实验发现,上调AKR1B10逆转了上调miR-568对胶质母细胞瘤细胞增殖和凋亡的影响,提示miR-568 通过靶向下调AKR1B10来影响胶质母细胞瘤细胞增殖和凋亡。
综上所述,miR-568 在胶质母细胞瘤细胞系中表达下调,而AKR1B10 表达上调。上调miR-568 可通过靶向抑制AKR1B10 的表达阻碍胶质母细胞瘤细胞增殖,并促进细胞凋亡,miR-568/AKR1B10 轴有可能为胶质母细胞瘤的治疗提供了新靶点。
