利用手持技术实验探究二氧化碳的性质
2022-04-03侯秀珠曾新庭张贤金
侯秀珠 曾新庭 张贤金
摘要:对人教版九年级《化学》上册“二氧化碳的溶解性实验”进行调研分析,发现已有的教材演示实验和文献中某些改进实验还存在不足,使学生难以充分认识二氧化碳的性质。利用手持技术对二氧化碳的性质以及实验问题进行实证探究,先处理并分析实验数据,再从定性和定量两个维度分析实验结果,得出相应的实验结论,并提出若干实验注意事项。
关键词: 手持技术实验; 二氧化碳性质; 实验探究
文章编号: 1005-6629(2022)03-0070-06
中图分类号: G633.8
文献标识码: B
1 问题提出
“二氧化碳的溶解性实验”是人教版九年级《化学》上册第六单元课题3中的一个演示实验,教师一般采用教材实验6-4[1]进行教学,即向一个集满CO2的软塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,振荡后软塑料瓶变瘪来验证;李德前等[2]用一个盛满CO2的集气瓶加水盖上玻璃片振荡后倒立,玻璃片悬而不落来证明;张晓燕[3]用一支装满CO2的试管倒扣在水中,轻摇试管,发现试管内液面上升来印证。上述这三种方法各有所长,但都是定性的验证性实验,学生缺乏定量化感知。王荣桥[4]在常温常压下用一支100mL注射器,通过抽取50mL干燥的CO2,再迅速抽取40mL水后密封注射器口,反复振荡,发现剩余气体体积约为10mL,不但验证CO2能溶于水,还得出该状态下,1体积水约能溶解1体积的CO2,实现了CO2的溶解性验证实验由定性向定量的转变。可是,以上这些实验教学均存在不足: 都只注重实验结果,忽视过程的探索。“软塑料瓶变瘪”“玻璃片悬而不落”和“管内液面上升”,都只是间接反映CO2气体减少致压强变小的结果,这让学生无法直观感知该过程中压强量的变化。这些粗略的直接呈现结果的实验方法,让学生可能产生诸多疑问或认知障碍: CO2气体减少是否只与溶解性有关,是否还受温度变化的影响?实验操作为何需要振荡,振荡前后压强有何变化?另外,有教师用注射器向集满CO2的密闭软塑料瓶中注入约1/3体积的水(装置气密性良好),振荡后发现软塑料瓶不变瘪,却又无法准确解释此现象。这些都可能造成学生对CO2性质的错误认知。为此,笔者认为有必要让学生参与实验的探究过程,具体感知压强量的变化,了解CO2气体减少与自身性质有关,从而增进對CO2性质的理解。
2 手持技术实验案例研究
2.1 探究思路分析
手持技术实验案例研究包括实验主题、设计和价值三个维度。本研究主题——以手持技术实验探究CO2性质,从对照实验、自变量、传感器三个角度进行设计,建构实验探究模型;运用手持技术实验软件定量描绘出两组曲线,并实时采集实验数据以及筛选数据制作图表,通过分析得出实验结论,促进学生对CO2性质的认识。本案例试图探究以下内容(见表1),手持技术实验探究的基本模型见图1[5]。
2.2 实验仪器、试剂及装置
(1) 主要仪器: 电脑、数据采集器、压强传感器、温度传感器、pH传感器、100mL三颈烧瓶、100mL注射器、100mL量筒等;
(2) 试剂: 饱和碳酸钠溶液、1∶4稀硫酸、蒸馏水;
(3) 装置如图2、图3所示。
2.3 实验方案及参数设置
利用Lab Studio软件,将数据采集器的采样频率设置为1.1s,采样时间为3~5min。本实验需测定:
(1) 室温下,注入不同体积蒸馏水后,集满CO2的密闭三颈烧瓶内振荡前后压强和温度的变化。
(2) 室温下,通入不同体积CO2后,装有100mL体积蒸馏水的敞口三颈烧瓶内振荡前后pH和温度的变化。
2.4 实验原理
根据理想气体状态方程PV=nRT(R为常数)、H2O+CO2H2CO3(碳酸溶液pH小于7)以及常温常压下蒸馏水pH=7.0,结合传感器测量的实验数据进行分析。
2.5 实验步骤
实验1 (1)检查装置气密性后,用100mL规格的三颈烧瓶,利用排水法集满CO2(CO2在水中有少量溶解,但溶解很慢,且气体损失量不大,可用排水法收集),用注射器抽取一定体积的蒸馏水,按照图2连接好装置;(2)打开电脑数字化探究系统Lab Studio软件,仪器校准后设置实验参数,点击插入绘图按钮,再点击开始采集按钮;(3)打开止水夹,迅速把注射器中的蒸馏水全部注入三颈烧瓶后关闭止水夹;(4)待数据稳定后(1min),缓慢振荡反应容器(30s),待数据稳定后(1min),再次缓慢振荡反应容器(30s),直至数据稳定后停止采集。
实验2 (1)向100mL规格的三颈烧瓶(经测量,该三颈烧瓶容量约为188mL)注入100mL蒸馏水(
不超过三颈烧瓶容积的2/3,符合实验要求,
水面线见图3),用注射器收集一定体积的CO2气体,按照图3连接好装置;(2)见实验1步骤(2);(3)打开止水夹,把注射器中的CO2全部缓缓地挤入蒸馏水中;(4)待数据稳定后(30s),缓慢振荡反应容器(30s),待数据稳定后停止采集。
3 实验数据的处理与分析
3.1 实验数据
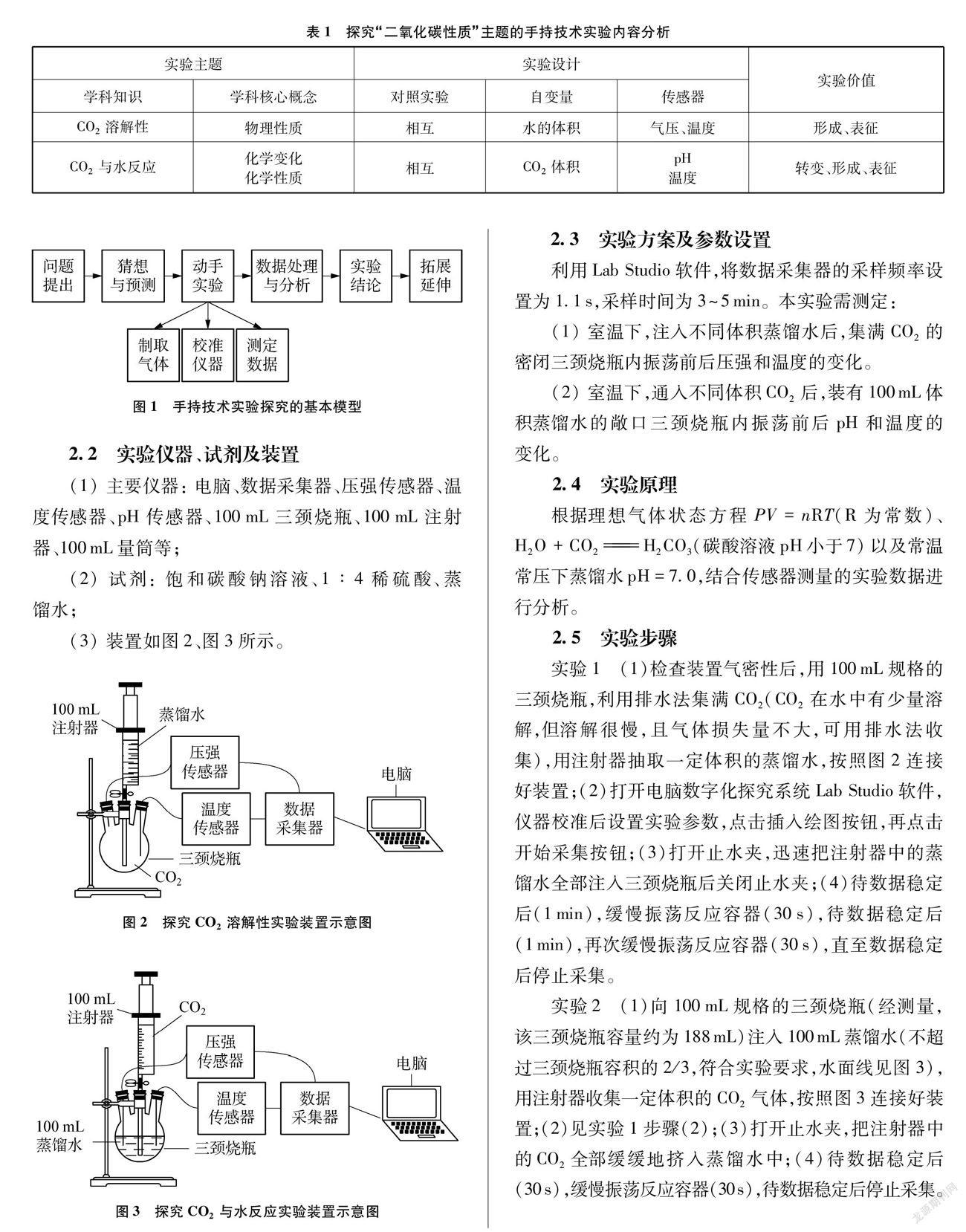
按图2所示,实验1中三组学生所绘制的分别注入20mL、 40mL、 60mL蒸馏水前后气压和温度随时间变化的曲线图(见图4~图6)。
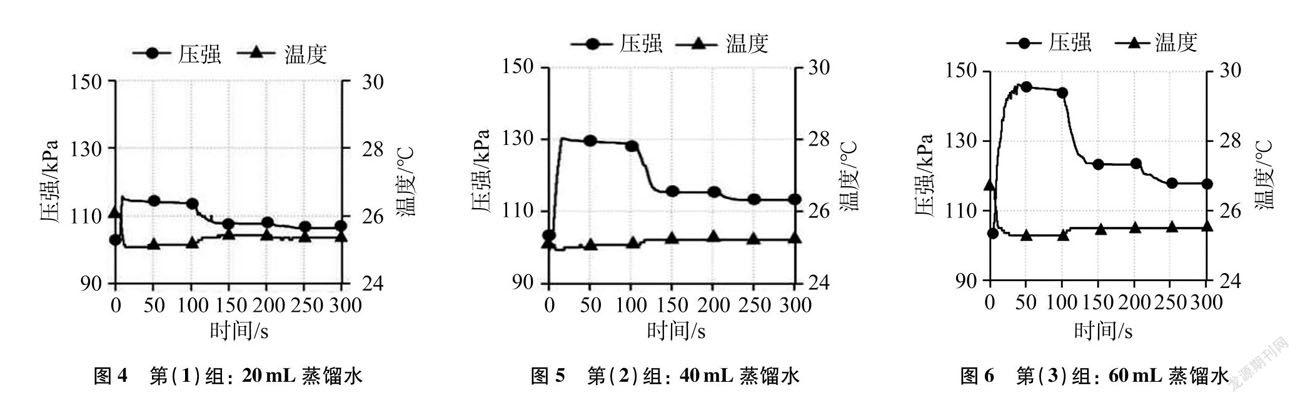
按图3所示,实验2中三组学生所绘制的分别通入20mL、 60mL、 100mL CO2后溶液pH和温度随时间变化的曲线图(见图7~图9)。
3.2 实验数据的处理
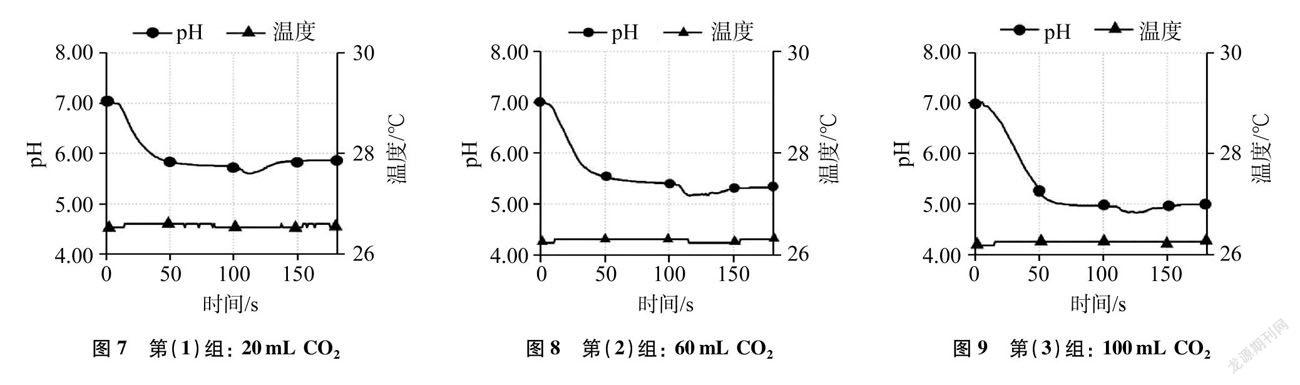
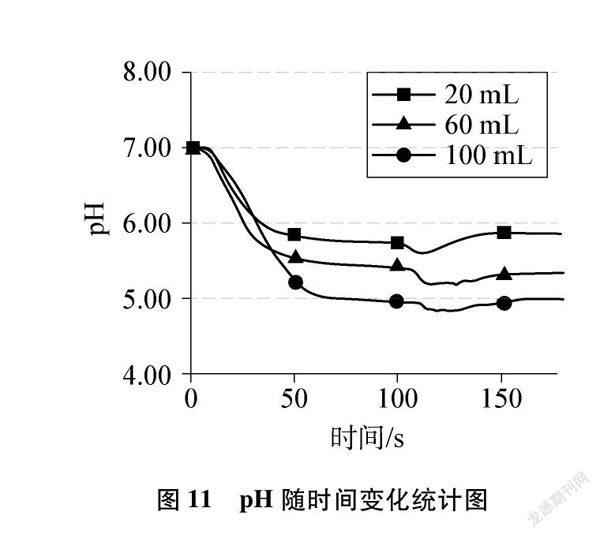
在Lab Studio软件中把形成图4、图5、图6的实验数据存储为Excel格式,并用Excel软件进行数学建模,绘制出压强随时间变化统计图(见图10)。同理,收集形成图7、图8、图9的实验数据,绘制出pH随时间变化统计图(见图11)。
从图4~图9看,在整个变化过程中,温度随时间变化不明显,故不作汇总整合处理。
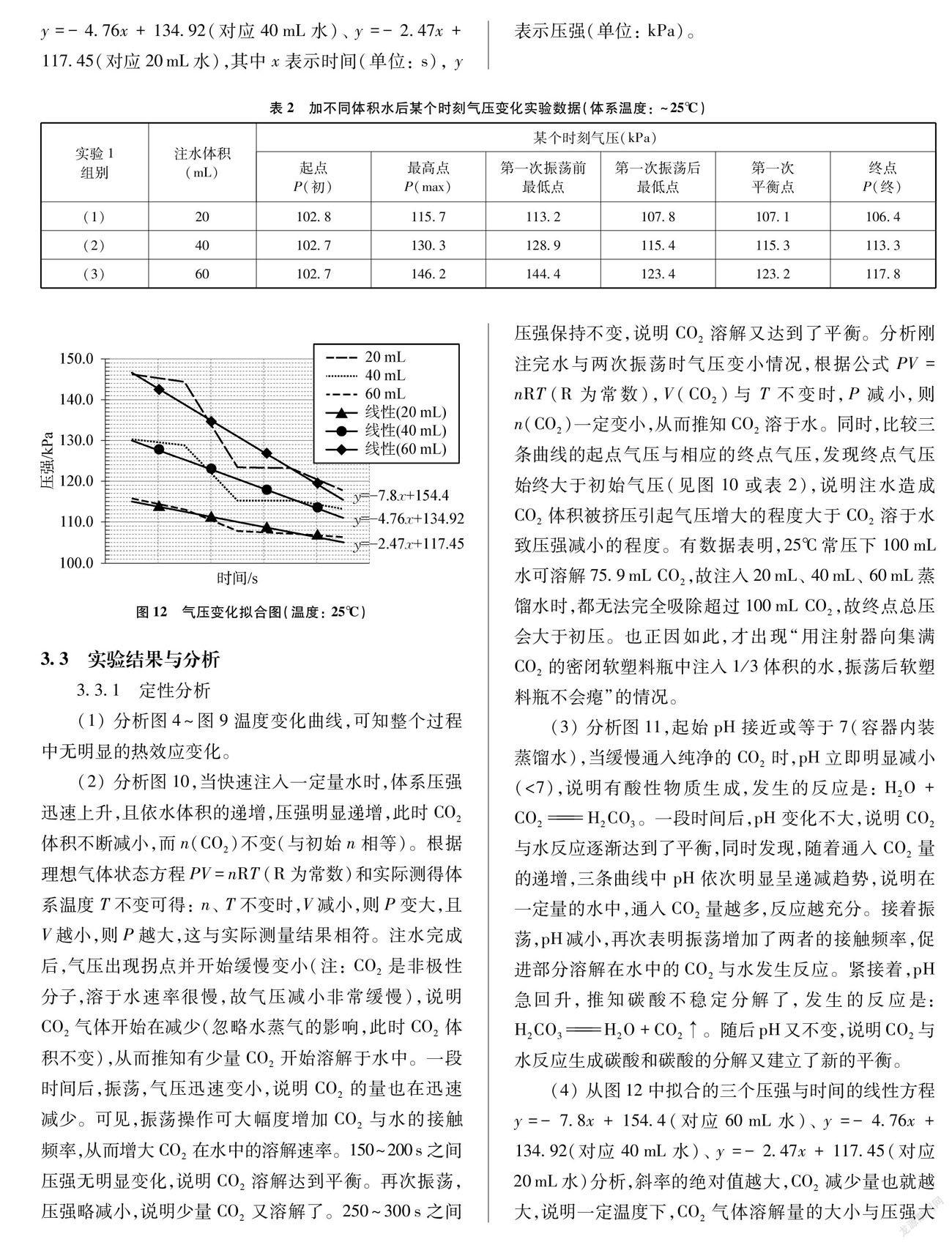
从形成图10的数据中各筛选出特殊点(起点、拐点、终点),形成实验1中某个时刻气壓变化实验数据表(见表2),去除起始压强,形成气压随时间变化曲线图(见图12),并把三条压强变化曲线拟合成三个线性方程分别为y=-7.8x+154.4(对应60mL水)、y=-4.76x+134.92(对应40mL水)、y=-2.47x+117.45(对应20mL水),其中x表示时间(单位: s),y表示压强(单位: kPa)。
3.3 实验结果与分析
3.3.1 定性分析
(1) 分析图4~图9温度变化曲线,可知整个过程中无明显的热效应变化。
(2) 分析图10,当快速注入一定量水时,体系压强迅速上升,且依水体积的递增,压强明显递增,此时CO2体积不断减小,而n(CO2)不变(与初始n相等)。根据理想气体状态方程PV=nRT(R为常数)和实际测得体系温度T不变可得: n、 T不变时,V减小,则P变大,且V越小,则P越大,这与实际测量结果相符。注水完成后,气压出现拐点并开始缓慢变小(注: CO2是非极性分子,溶于水速率很慢,故气压减小非常缓慢),说明CO2气体开始在减少(忽略水蒸气的影响,此时CO2体积不变),从而推知有少量CO2开始溶解于水中。一段时间后,振荡,气压迅速变小,说明CO2的量也在迅速减少。可见,振荡操作可大幅度增加CO2与水的接触频率,从而增大CO2在水中的溶解速率。150~200s之间压强无明显变化,说明CO2溶解达到平衡。再次振荡,压强略减小,说明少量CO2又溶解了。250~300s之间压强保持不变,说明CO2溶解又达到了平衡。分析刚注完水与两次振荡时气压变小情况,根据公式PV=nRT(R为常数),V(CO2)与T不变时,P减小,则n(CO2)一定变小,从而推知CO2溶于水。同时,比较三条曲线的起点气压与相应的终点气压,发现终点气压始终大于初始气压(见图10或表2),说明注水造成CO2体积被挤压引起气压增大的程度大于CO2溶于水致压强减小的程度。有数据表明,25℃常压下100mL水可溶解75.9mL CO2,故注入20mL、 40mL、 60mL蒸馏水时,都无法完全吸除超过100mL CO2,故终点总压会大于初压。也正因如此,才出现“用注射器向集满CO2的密闭软塑料瓶中注入1/3体积的水,振荡后软塑料瓶不会瘪”的情况。
(3) 分析图11,起始pH接近或等于7(容器内装蒸馏水),当缓慢通入纯净的CO2时,pH立即明显减小(<7),说明有酸性物质生成,发生的反应是: H2O+CO2H2CO3。一段时间后,pH变化不大,说明CO2与水反应逐渐达到了平衡,同时发现,随着通入CO2量的递增,三条曲线中pH依次明显呈递减趋势,说明在一定量的水中,通入CO2量越多,反应越充分。接着振荡,pH减小,再次表明振荡增加了两者的接触频率,促进部分溶解在水中的CO2与水发生反应。紧接着,pH急回升,推知碳酸不稳定分解了,发生的反应是: H2CO3H2O+CO2↑。随后pH又不变,说明CO2与水反应生成碳酸和碳酸的分解又建立了新的平衡。
(4) 从图12中拟合的三个压强与时间的线性方程y=-7.8x+154.4(对应60mL水)、y=-4.76x+134.92(对应40mL水)、y=-2.47x+117.45(对应20mL水)分析,斜率的绝对值越大,CO2减少量也就越大,说明一定温度下,CO2气体溶解量的大小与压强大小有关。
3.3.2 定量分析
为验证本实验数据的准确性,以便能更合理、更科学地得出实验结论,下面从理论上作进一步定量分析印证。
(1) 根据公式PV=nRT,结合注水时体系内n(CO2)和T不变,可得:
P1(max)=P(初)V(初)V(初)-V(水)(1)
结合公式: 实验误差=实验值-理论值理论值×100%=P(max)-P1(max)P1(max)×100%(2)
其中V(水)和P1(max)分别表示注水体积与注水后最高点压强的理论计算值,V(初)=188mL(等于三颈烧瓶容量),把表2中三组初始气压数据分别代入(1)式求出P1(max),通过(2)式求得实验误差,并进行误差分析。现把计算与分析结果汇总于表3。
(2) 根据PV=nRT推出:
n(初)=P(初)V(初)RT(3)
由于CO2溶于水速率很慢,故可忽略注水瞬间CO2可能溶于水而引起其物质的量减少情况,故P(max)所对应的n(CO2)与n(初)是相等的。根据PV=nRT,结合注水后V(CO2)、T不变,可推出:
n(终)=P(终)n(初)P(max)
(4)
n(溶)=n(初)-n(终)(5)
其中n(溶)表示整个过程中溶解的CO2物质的量。
已知初始温度约为25℃(即T=298K),V(初)=188mL,R=8.314Pa·m3/(mol·K)。把表2中相关数据代入(3)和(4)式进行计算,再把计算结果代入(5)式,求出n1(溶)=6.30×10-4mol,n2(溶)=1.02×10-3mol,n3(溶)=1.51×10-3mol,可见n(溶)>0,说明CO2能溶于水。统一换算成100mL水,得出25℃时106.4kPa、 113.3kPa和117.8kPa三种状态下CO2的溶解度分别是0.1386g、 0.1122g和0.1107g。从表3实验误差结果分析可知,第(1)组偏大、第(3)组偏小,以第(2)组最佳。故推测,在25℃时106.4kPa状态下CO2的溶解度应比113.3kPa状态下溶解度0.1122g要小,而117.8kPa状态下其溶解度应比113.3kPa状态下溶解度0.1122g要大。这说明了压强越大,CO2气体的溶解度也就越大。再统一换算成101.3kPa(常压),可得出三组实验中CO2的溶解度计算值分别是0.1320g、 0.1003g和0.0952g,则三组溶解度计算平均值为0.1092g。通过查表,25℃常压下CO2的溶解度为0.1449g(理论值),可求出本实验误差为24.63%,则准确率为75.37%。分析原因,主要可能是由于实验时间太短了(只有5min),CO2没有最大限度地溶解在水中(CO2溶解很慢)。若延长实验时间,可能CO2的溶解度实验计算值会更接近于理论值的(有待进一步研究)。
3.4 实验结论
综合以上分析得出以下结论:
(1) 用注射器向集满CO2的密閉容器中注水,容器内的压强先变大后变小,且振荡会加速压强变小;此过程CO2不但会溶于水,而且还会与水发生反应,二者共同作用致体系压强减小,但压强减小的程度始终都小于注水引起气压增大的程度。该变化过程中,热量变化不明显。
(2) 本实验环境条件下测出25℃、 101.3kPa时100mL水中约能溶解0.1092g CO2,且随着压强的增大,CO2的溶解度也会增大。
(3) 振荡不但促进CO2的溶解,还促进部分溶解的CO2与水充分反应。同时,CO2与水反应生成碳酸和碳酸分解建立了平衡关系。
(4) 实验结果以数据、图表形式呈现,各组数据相互匹配,相互印证,经过定性与定量分析,说明实验结果具有一定的说服力[6]。
3.5 实验注意事项及说明
(1) 由于CO2在水中虽有少量溶解,但溶解很慢,且气体损失不大,故实验1中可用排水法收集CO2,既能得到较纯净的CO2,又能使气体温度与注水时水温接近,减小实验误差。
(2) 实验中用饱和碳酸钠溶液和稀硫酸反应制取CO2,方便注射器收集到较纯净的CO2(除H2O外),避免因用盐酸造成CO2中含有HCl而影响实验2中pH的测定。
(3) 实验中用蒸馏水不用自来水,减少自来水中含有的杂质对实验造成干扰。
(4) 实验中振荡时注意手不要碰到容器壁,以免手的温度造成实验误差。
(5) 通过多次实验得出多组数据,便于进行多组数据对比,让实验结果更准确、更严谨、更科学。
4 实践价值
4.1 有效促进学生的深度学习
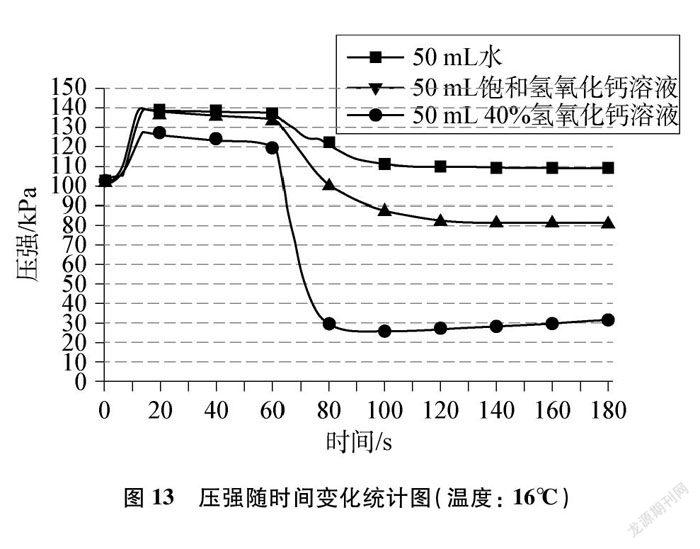
参与实验的学生反馈,他们“看到”了CO2溶于水以及与水反应的细微变化本质,通过变化过程“可视化”加深了对该性质的理解。笔者顺势引导学生利用手持技术来探究CO2的其他性质: 按图2所示,向集满CO2的密闭的三颈烧瓶中分别注入50mL水、50mL饱和氢氧化钙溶液和50mL质量分数为40%的氢氧化钠溶液,所得实验数据汇总整合,绘制出压强随时间变化的统计图(见图13)。
根据上述实验结论,结合图13识别与推理发现: CO2既能与水、氢氧化钙溶液反应(有白色浑浊),还能与氢氧化钠溶液反应,且较浓的氢氧化钠溶液对CO2的吸收效果优于水和氢氧化钙溶液,这就不难理解在实验室中,要成功“捕捉CO2”选择氢氧化钠浓溶液和“鉴定CO2”选用氢氧化钙溶液的道理。手持技术实验得到的曲线和数据,扫除了学生的理解障碍,加深了对物质微观变化的认识,从而促进了深度学习。
4.2 有效增进教师对学科知识的理解
本案例实践不仅为教师备课、教学提供了参考,还让化学实验教学更加多样化。通过本实验得到的结论: 用注射器向集满CO2的密闭容器中注水引起气压增大的程度大于CO2溶于水、与水反应致压强减小的程度,解除了多年来教师无法准确解释“用注射器向集满CO2的密闭软塑料瓶中注水振荡后出现软塑料瓶不变瘪”的困惑,加深了对化学学科知识的理解。
参考文献:
[1]王晶,郑长龙. 义务教育教科书·化学(九年级上册)[M]. 北京: 人民教育出版社,2012: 117~118.
[2]李德前,张羿,吴国庆. “基于化学实验素养的二氧化碳的性质复习课”[J]. 中国现代教育装备,2019,(8): 42~44.
[3]张晓燕. 初三化学“二氧化碳性质”公开课的实验设计[J]. 化学教学,2015,(9): 57~58.
[4]王荣桥. “基于定量实验促进学生深度学习二氧化碳的性质”[J]. 中学化学教学参考,2020,(4): 29~30.
[5]江世忠,谭显华,邓峰,等. 利用手持技术探究甲烷的温室效应[J]. 化学教育,2006,(12): 40~41.
[6]张磊,王璇,孙美华. 基于传感器检测探究盐酸与碳酸钠溶液的反应[J]. 化学教学,2021,(6): 74~77.
