自然水体沉积物对Pb2+和Cu2+吸附研究
2022-04-02袁宇杰王吉龙周雨桐张田田
袁宇杰,杨 英,储 明,王吉龙,吴 亮,周雨桐,张田田
(安徽建筑大学环境与能源工程学院,安徽 合肥 230601)
随着工业化的加速,工业废水不断地排入自然水体,重金属是工业废水中的一类难以去除的污染物,如果不能将其去除,它将严重威胁生态环境系统和人类健康安全[1]。生物吸附法吸附是一种成本较低,去除效率高的方法[2],与传统的重金属去除法相比,无二次污染[3]。自然水体沉积物对水环境中重金属有的迁移、转化,富集的作用,并且作为一种新兴重金属吸附材料近年来得到了广泛关注[4]。自然水体沉积物主要由生物膜、沉垢、有机物和无机盐等组成,自然水体沉积物由于其成分和结构复杂且多孔隙结构特点,对水中的重金属具有明显的富集和吸附作用[5]。
本文用巢湖自然水体沉积物,研究了其吸附重金属的过程。通过改变pH、反应时间、温度等因素,讨论了Pb2+、Cu2+与吸附剂的吸附等温线及反应动力学,建立了相应的数学模型[6]。借助FTIR、XRD 探讨了沉积物吸附Cu2+和Pb2+机理,为生物吸附技术在重金属废水处理中的应用提供了一种思路[7]。
1 材料与方法
1.1 实验药品与仪器
实验药品有硝酸铅、硝酸铜、浓硝酸、氢氧化钠、Pb(Ⅱ)标准溶液、Cu(Ⅱ)标准溶液等均为实验分析纯;实验仪器有高速台式离心机(TGL-15B)、真空冷冻干燥机(LGJ-10)、倍达浦实验室超纯水机(BDP-40TC)、雷磁多功能pH 计(DZB-712-C)、恒温振荡培养箱(HZQ-F160)、千分之一天平(AR2333CN)、傅里叶红外光谱仪(Nicolet iS10)、电感耦合等离子体光谱仪(Optima8000)等。
1.2 体沉积物的制备
从安徽合肥巢湖水域石壁提取天然水沉积物,取样深度10 cm~30 cm[8],用50 ml 的离心管采集样品带回实验室,用高速台式离心机对其进行离心处理,离心时间3 分钟,转速3000 转,离心后倒出上清液,用-60℃真空冷冻干燥机将沉积物的样品冷冻干燥至恒重,放入研钵内研磨,之后经60 目筛,得到深绿色粉末,在室温下保存以作后续试验
1.3 Pb2+、Cu2+溶液配制
采用Pb2+、Cu2+标准溶液,用10%的硝酸作为溶剂,分别稀释为1 mg/L、2 mg/L、3 mg/L、4 mg/L、5 mg/L,配成标准溶液作为备用,用电感耦合等离子体发射光谱仪测量了被稀释的重金属离子溶液,在220.353 nm 处测量了铅离子的浓度,在324.752 nm 处测量了铜离子的浓度,绘制标准曲线,并将每一次实验得到的标准曲线的相关性保持在0.999 以上[9]。
分别称取1.599 g 硝酸铅、2.9375 g 硝酸铜,溶解于装有少量硝酸的烧杯中,用去离子水溶解后定容至1000 mL,从而得到1000 mg/L 的Pb2+和Cu2+的标准储备液。
2 吸附实验
2.1 pH 值对吸附实验的影响
将25 ml,100 mg/L 的Pb2+和Cu2+溶液置于50 ml 离心管中投加0.1 g 的吸附剂,调节初始溶液pH 值范围为3~6,温度30 ℃、转速150 r/min振荡6 h。用0.45µm 针式滤头过滤得到滤液,稀释后得到待测样品之后使用电感耦合等离子体光谱仪检测其浓度。
从图1 中可以看出,当pH 大于6 时溶液中OH-易于金属离子形成难溶的M(OH)2沉淀,不利于吸附的进行,当体系中的pH 小于3 时,H+浓度增大,会使得体系中的H+与Pb2+和Cu2+形成竞争吸附,这与静电斥力有关[10]。因此实验选取pH 的范围为3~6,自然水体沉积物对Pb2+和Cu2+的吸附量随着pH 的增加也在增长,缓流水体沉积物吸附Pb2+和Cu2+的最佳pH 均为6。
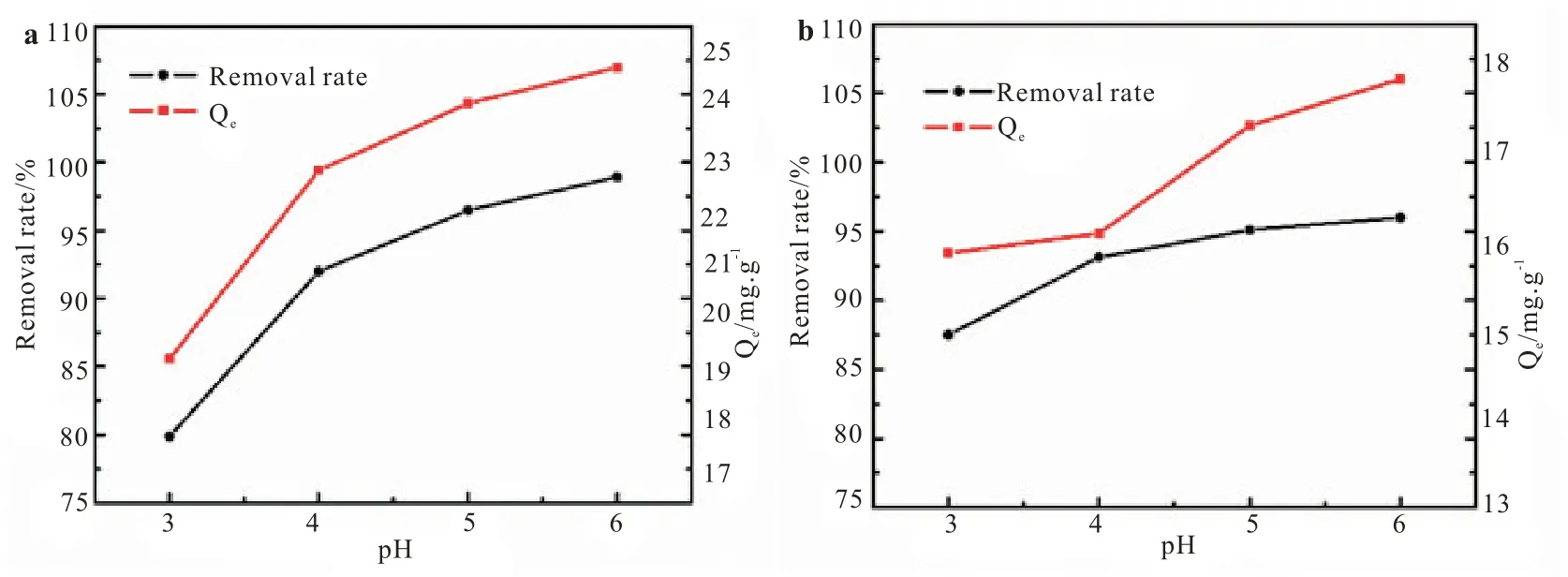
图1 初始pH 对自然水体沉积物吸附Pb2+(a)、Cu2+(b)的影响
2.2 吸附时间对实验的影响
将200 ml,100 mg/L 的Pb2+和Cu2+溶液于500 ml 锥形瓶中投加0.8 g 的吸附剂,在温度30 ℃、转速150 r/min 的恒温振荡培养箱振荡,在0 min~450 min 内取样。用0.45µm 针式滤头过滤得到滤液,稀释后得到待测样品之后使用电感耦合等离子体光谱仪检测其浓度。
从图2 中可以看出0~100min 由于沉积物和重金属的浓度较高,沉积物对重金属的吸附的效果处在快速阶段,在100~200min 由于沉积物和重金属含量较低,吸附速率明显变慢,之后的时间达到平衡吸附容量。
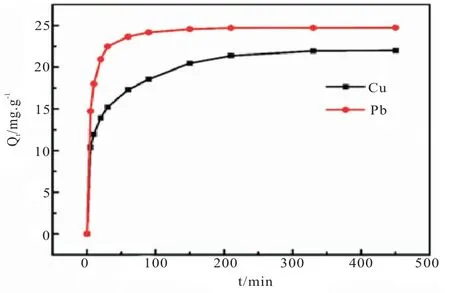
图2 自然水体沉积物对Pb2+、Cu2+吸附的动力学曲线
2.3 投加量对吸附实验的影响
将25 ml,100 mg/L 的Pb2+和Cu2+溶液置于50 ml 离心管中、投加量分别为0.025 g、0.05 g、0.1 g、0.15 g 和0.2 g,在温度30 ℃、转速150 r/min的恒温振荡培养箱中振荡6 h。用0.45 µm 针式滤头过滤得到滤液,稀释后得到待测样品之后使用电感耦合等离子体光谱仪检测其浓度。
从图3 可以看出,当初始浓度均为100 mg/L时,沉积物对Pb2+、Cu2+的去除率随初始投加量的增大而增大,但吸附能力却逐渐下降。在低投加量条件下,沉积物表面能吸附位点数较少,去除率较低,但单位质量下,因为吸附位点的利用率很高,沉积物吸附的Pb2+、Cu2+较多;当投加量较多时,沉积物存在饱和状态,吸附量反而减少。综上所述,考虑到吸附剂与吸附量的关系,避免了对吸附剂的浪费,吸附剂在4g/L 为宜。

图3 吸附剂投加量对沉积物吸附Pb2+(a)、Cu2+(b)的影响
2.4 吸附动力学实验
分别用拟一级动力学模型和拟二级动力学模型对实验数据进行拟合,通过拟合程度判断吸附反应速度[11]。
拟一级动力学方程

式中
Qt:t时沉积物对重金属离子的吸附量(mg∕g);
Qe:吸附平衡时重金属离子的吸附量(mg∕g);
k1:拟一级动力学模型速率常数;
t:吸附实验的时间(min)。
拟二级动力学方程

式中
k2:拟二级动力学模型速率常数;
Qt:t时沉积物对重金属离子的吸附量(mg∕g);
Qe:吸附平衡时重金属离子的吸附量(mg∕g);
t:吸附实验的时间(min)。
自然水体沉积物对Pb2+、Cu2+的吸附动力学实验结果可以从表1 和表2 中得出,在拟一级、二级动力学模型中自然水体沉积物对Pb2+的吸附量明显优于Cu2+。拟一级动力模型中Pb2+和Cu2+的平衡吸附量分别为24.74 mg/g、21.99 mg/g,拟二级动力学模型中Pb2+和Cu2+平衡吸附量分别为24.94mg/g 和22.47mg/g。拟二级动力模型R2均大于拟一级动力学模型R2,此外拟二级动力学模型算得的Qe,cal值也更加接近于Pb2+和Cu2+吸附的Qe,exp值。因此拟二级动力学模型能更好的描述自然水体沉积物对Pb2+和Cu2+的吸附过程,同时表明吸附速率是受化学吸附机理控制的[12]。

表1 自然水体沉积物吸附Pb2+的动力学模型参数
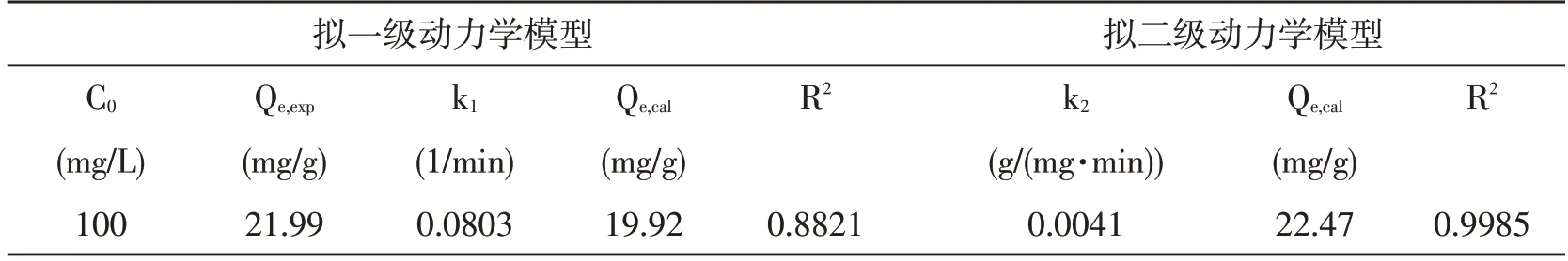
表2 自然水体物吸附Cu2+的动力学模型参数
2.5 吸附等温线实验
吸附剂的吸附量可用吸附等温线表示,判断吸附剂对吸附质的吸附性能,本实验采用Langmuir[13]和Freundlich 吸附等温模型[14]。
Langmuir 等温吸附模型的线性表达式

式中
Qe:吸附平衡时重金属离子的吸附量(mg/g);
Qm:实验最大吸附容量(mg/g);
Ce:
吸附平衡时溶液中重金属离子的浓度(mg∕L);
KL:吸附平衡常数。
Freundlich 等温吸附模型的线性表达式

KF:Freundlich 常数;
1/n:Freundlich 模型下与吸附容量和吸附强度有关的系数。
自然水体沉积物对Pb2+和Cu2+的吸附经历了 快速吸附、慢速吸附、平衡吸附的过程[15]。从表3、表4 得出,Langmuir 等温模型算得的Pb2+和Cu2+的最大吸附容量Qmax分别为40.00 mg/g 和33.22 mg/g,自然水体沉积物对Pb2+的吸附性能明显优于Cu2+。缓流水体沉积物对Pb2+和Cu2+在20。C、30。C 和40。C 温度下的吸附实验均有Langmuir吸附等温模型算得的R²值大于Freundlich 吸附等温模型R2的情况,这说明Pb2+和Cu2+在缓流水体沉积物上的吸附更适合用Langmuir 吸附等温模型来描述。因此自然水体沉积物对Pb2+和Cu2+的吸附以均匀的单分子层吸附为主,同时存在着化学吸附[16]。Freundlich 吸附等温模型说明在不同温度下的吸附平衡常数KL均处于0~1 之间,这说明自然水体沉积物对Pb2+和Cu2+的吸附是利于发生的且KF值都随着温度的升高而逐渐增大,这说明温度的升高也有利于反应的进行,Freundlich系数1/n 的值同样均处于0~1 之间,这也表明该吸附过程较容易发生。
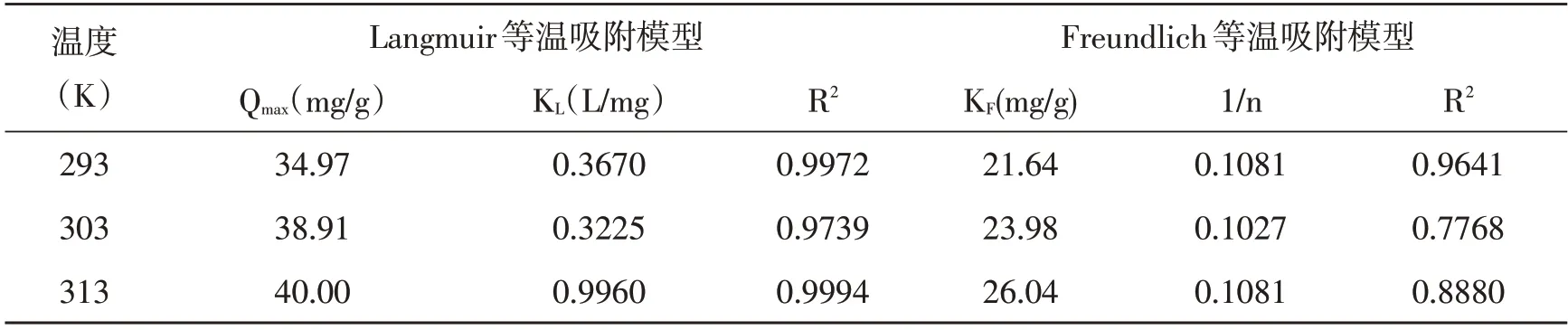
表3 自然水体沉积物吸附Pb2+的Langmuir 和Freundlich 等温模型参数
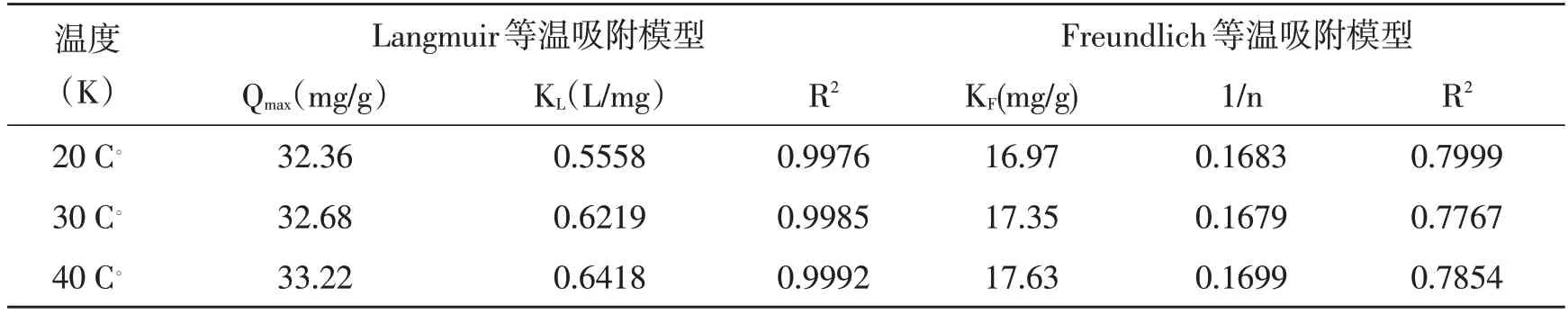
表4 自然水体沉积物吸附Cu2+的Langmuir 和Freundlich 等温模型参数
3 结果分析
3.1 傅里叶红外光谱结果分析(FTIR)
采用型号Nicolet 330 的傅里叶红外光谱仪对自然水体沉积物进行分析,将自然水体沉积物吸附Pb2+、Cu2+溶液与原样,用冷冻干燥机干燥成粉末状。将粉末与烘干的光谱纯KBr 按照1∶100质量混合,在玛瑙研钵中研磨后制成压片[17],将波长范围设为:400~4000 cm-1。
在图4 中可以看到自然水体沉积物在吸附Pb2+和Cu2+前后的红外光谱图,沉积物Pb2+和Cu2+吸附前后沉积物的FTIR 图基本一致,表明吸附前后自然水体沉积物的整体结构没有发生变化,但有少许峰位发生偏移,强度发生变化,说明部分官能团在吸附反应中发挥作用。OH 伸缩振动峰出现在3620cm-1处,且在吸附后峰位置均发生右移;在吸附Pb2+和Cu2+后,缓流水体沉积物在吸附Pb2+和Cu2+时发生了轻微的左移,表明-NH2官能团参与了吸附。在1645cm-1~1653cm-1处出现的峰是由双键C=O 的伸缩振动引起的,而在吸附Pb2+和Cu2+前后出现的峰则是由双键C=O 的伸缩振动引起的,这表明在吸附过程中羰基官能团参与,在吸附前后出现了强化偏移。Cu2+吸附1036cm-1处出现的峰是C=O 伸缩振动引起的,同时Pb2+吸附时峰的强度明显增强,而Cu2+吸附时峰的强度则发生了右移。该峰出现于797cm-1处,是由Si-OSi 的不对称伸缩振动所致,并在吸附后发生了左移。由图还可以看出,当Pb2+和Cu2+吸附到指纹区(<1000 cm-1)后,指纹区内的硫和磷基团峰有不同程度的增强和减弱。由FTIR 分析结果可知,缓流水体沉积物中存在羟基、氨基、烷基、含氧基团,并可能含有硫、磷基团,这对Pb2+和Cu2+的吸附起着重要作用。

图4 自然水体沉积物吸附Pb2+和Cu2+的红外光谱图
3.2 XRD 结果分析
将原样和吸附Pb2+和Cu2+后的粉末样品用玛瑙研钵研磨均匀,用型号为SmartLab 9kw X 射线衍射仪,测定缓流水体沉积物的晶型结构[18]。
从图5 中可以看出缓流水体沉积物的衍射谱峰出现在2θ=20.848°、23.101°、26.624°、29.466°、36.039°、36.527°、39.441°、42.430°、43.244°、47.325°、48.615°、50.109°、59.925°处,与SiO2、Ca-CO3的X 射线衍射标准卡JCPDS(70-3755)、(85-1108)的图谱特征峰无明显的差别,因此可以得出缓流水体沉积物表面的物质为SiO2、CaCO3。

图5 自然水体沉积物的XRD 图
4 结论
(1)自然水体沉积物对Pb2+和Cu2+的吸附反应最佳pH 为6 左右,综合去除率与投加量之间的关系,以4 g/L 的投加量作为吸附实验中最优投加量,反应时间在300 min 左右达到平衡。
(2)拟二级动力学模型能更好的反映出自然水体沉积物对Pb2+和Cu2+的吸附行为,吸附以化学吸附为主,Langmuir 等温模型能更好的反映了自然水体沉积物对Pb2+和Cu2+的吸附行为,表明Pb2+和Cu2+在缓流水体沉积物吸附过程中主要是单分子层吸附,包含化学吸附和物理吸附[19]。
(3)FTIR 说明自然水体沉积物对Pb2+、Cu2+的吸附主要受羟基、氨基、烷基、含氧基团等官能团络合等影响,硫、磷基团也参与了反应[20],XRD 显示自然水体沉积物表面物质为SiO2和CaCO3。
