西瓜子叶离体再生体系的建立
2022-04-02张晨光张思远谢露露高建昌李美阳
牛 波 张晨光 刘 阳 张思远 谢露露 高建昌,3* 李美阳*
(1 中国农业科学院蔬菜花卉研究所,北京 100081;2 延边大学农学院,吉林延吉 133002;3 中国农业科学院寿光蔬菜研发中心,山东寿光 262704)
西瓜()属于葫芦科(Cucubitaceae)西瓜属,是世界十大水果之一,也是一种重要的蔬菜经济作物。我国是世界上西瓜种植面积和产量最大的国家,年产量为世界总产量的70%左右(联合国粮食及农业组织,2020),同时也是西瓜的最大消耗国。目前我国西瓜品种选育的基础研究较为薄弱,加之西瓜资源的遗传背景相对狭窄,常规育种手段周期长、效率低,难以获得具有可以稳定遗传的优良农艺性状的新品种。近年来,现代分子育种技术的高速发展为西瓜种质资源创新提供了新的途径。在西瓜组织培养方面,主要是通过子叶(张娜,2015;谢永红,2016;张曼 等,2020)、下胚轴(Andrus et al.,1971)获得再生植株,除此之外,未成熟胚(董焱 等,2014)、果实(Zamora,1988)、茎尖(潘琼玉 等,2018)等也被用于植株再生。总体而言,西瓜细胞工程研究体系的培养效率不高,受基因型、外植体类型以及培养基配比等多种条件的限制,缺乏相对完善统一的体系。
本试验以小果型西瓜品种香秀为试验材料,研究建立高效西瓜子叶离体再生培养体系,以此实现植株离体快繁,有助于缩短植物生长周期,进而加快育种进程,促进优良西瓜品种的选育;同时为西瓜转基因技术体系的建立提供一定的科学依据和技术支撑。
1 材料与方法
1.1 植物材料
试验于2020 年5—10 月在中国农业科学院寿光蔬菜研发中心进行。供试材料为小果型西瓜品种香秀,由中国农业科学院蔬菜花卉研究所西瓜遗传育种课题组自主选育。
1.2 种子萌发与培养
取完整饱满的香秀种子约300 粒,55 ℃温水浸泡种子6 h 后剥壳,对种子进行消毒:先用75%乙醇浸泡30 s,之后用6.5%次氯酸钠浸泡15 min(浸泡过程中应不断摇晃),无菌水冲洗4~5 次,每次1 min,然后用无菌滤纸吸干后接种至1/2MS 培养基(2.16 mg·LMS 粉,30 mg·L蔗糖,8 mg·L琼脂)上,暗处理3 d,移至光下(16 h 光照,光照强度2 000 lx,8 h 黑暗)培养。
1.3 外植体的获得
种子培养4~5 d、子叶刚刚由黄转绿时,用解剖刀在超净工作台上小心地切除下胚轴,然后横切去除子叶远轴端约1/3,取近下胚轴的2/3 子叶,将2 片子叶分开,作为西瓜再生体系的外植体,将其背面朝下平铺于不定芽诱导培养基上。
1.4 不定芽的诱导及伸长培养
将外植体接种于不同6-BA 和NAA 浓度的MS 培养基上,置于25 ℃光照16 h、黑暗8 h、光照强度2 000 lx(光源为飞利浦LED 灯)条件下进行培养。不定芽诱导培养基分别设置6-BA 浓度梯度2.00、2.25、2.50、2.75、3.00 mg·L和NAA浓度梯度0、0.1、0.2 mg·L,共15 个组合。每个处理20 个培养皿,每个培养皿接种6 个外植体,3 次重复。培养28 d 后统计外植体再生情况,计算不定芽诱导率。
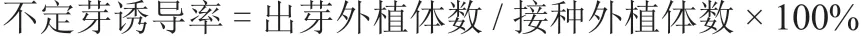
诱导的不定芽达到1~2 cm 时移至MS 伸长培养基,分别设置6-BA 浓度梯度0.5、1.0、1.5 mg·L和IAA浓度梯度0.25、0.50、0.75、1.00 mg·L,共12 个组合。每个处理40 瓶,每瓶接种3 个不定芽,3 次重复。培养7 d,观测不定芽的伸长状态,并使用游标卡尺测量不定芽的伸长 高度。
1.5 生根与炼苗
将3~4 cm 的不定芽移至1/2MS 生根培养基,分别设置IBA 浓度梯度0.5、1.0、1.5 mg·L,每个处理40 瓶,每瓶接种3 个不定芽,3 次重复。培养20 d 后统计生根情况。

将生根苗移至消过毒的基质中,每株分别罩保鲜膜,放置于人工气候培养箱中,首先黑暗处理0、24、48 h(16 h 30 ℃,8 h 25 ℃,湿度60%);然后30 ℃16 h,光照强度1 000 lx,25 ℃ 8 h,黑暗;48 h 后将光照强度调至2 000 lx,除去保鲜膜,4 d后即可正常管理。
1.6 数据统计与分析
使用SPSS 25.0 和WPS Office(11.1.0.102 28)软件进行数据分析和图表制作。
2 结果与分析
2.1 不同激素浓度配比对西瓜不定芽诱导率的影响
不定芽的诱导是植株再生过程中最重要的一步,不定芽的诱导率直接影响植株再生率。由表1 可知,单独添加6-BA 能诱导西瓜子叶不定芽的产生,随着6-BA 浓度增加,出芽外植体数和不定芽诱导率呈现先增加后下降的趋势,6-BA 浓度为2.25 mg·L时,出芽外植体数和诱导率达到最高值,分别为96.00 个和80.00%。在添加6-BA 的情况下加入低浓度的NAA(0.1 mg·L)能提高出芽外植体数和诱导率,其中当6-BA 浓度为2.25 mg·L时,添加0.1 mg·LNAA,出芽外植体数和诱导率提高幅度最大,比不添加NAA 的处理分别提高12.67 个和10.56 百分点,诱导率显著高于不添加NAA 的处理和添加0.2 mg·LNAA 的处理;当6-BA 浓度较低(2.00~2.50 mg·L)时,添加 较高浓度的NAA(0.2 mg·L)在一定程度上抑制了不定芽的诱导。MS+2.25 mg·L6-BA+0.1 mg·LNAA为不定芽诱导的最适培养基,其平均出芽外植体数和诱导率分别为108.67 个和90.56%,诱导率显著高于其他处理。6-BA 浓度为3.00 mg·L时诱导率最低,为34.72%~38.89%,均显著低于其他6-BA 浓度处理。可以认为,6-BA是诱导不定芽产生的关键激素。

表1 不同浓度6-BA 与NAA 配比对西瓜不定芽诱导率的 影响
2.2 不同激素浓度配比对西瓜不定芽伸长的影响
由表2 可知,过高或过低浓度的6-BA 和IAA对不定芽的伸长效果均较差。在6-BA 浓度一定时,随着IAA 浓度的升高不定芽平均伸长高度呈先上升后下降趋势。在IAA 浓度一定时,随着6-BA浓度的升高不定芽平均伸长高度呈先上升后下降趋势。其中当6-BA 浓度为1.0 mg·L、IAA 浓度为0.50 mg·L时,不定芽的平均伸长高度最高,为4.08 cm,显著高于其他处理,不定芽迅速生长。表明MS+1.0 mg·L6-BA+0.50 mg·LIAA为不定芽伸长的最适培养基。不定芽生长至3~5 cm时,可移至生根培养基进行生根培养。所有处理均可获得达到生根要求的不定芽。但考虑实际情况下,株高较高、生长势较好的不定芽,生根率和成活率更高。
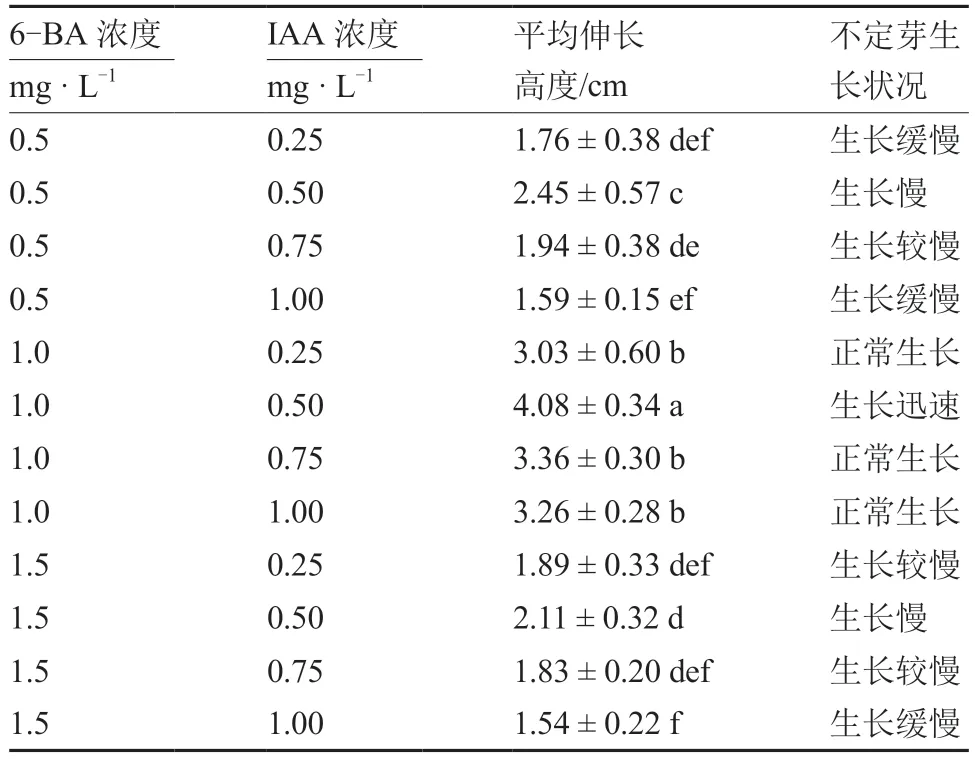
表2 不同浓度6-BA 与IAA 配比对西瓜不定芽伸长的影响
2.3 不同浓度IBA 对西瓜再生苗生根的影响
再生苗的生根相对容易,添加少许生长素即可。由表3 可以看出,1/2MS 培养基中添加1.0 mg·LIBA 时,再生苗的生根率和平均根数均达到最大值,生根率为93.33%,平均根数为4.27 根,平均根数显著高于添加0.5 mg·L和1.5 mg·LIBA的处理。

表3 不同浓度IBA 对西瓜再生苗生根的影响
2.4 炼苗及移栽
高温高湿环境是保证再生植株存活和正常生长发育的关键因素之一。炼苗时首先将生根苗移至经过消毒的基质中,每株罩保鲜膜;置于人工气候培养箱中,浇足够的水,保证高温高湿环境。从图1中可以看出,首先黑暗处理24 h 的生根苗存活率为98.33%,显著高于不经黑暗处理的存活率。黑暗处理48 h 时,生根苗存活率为95.56%,与黑暗处理24 h 时无显著差异。黑暗处理24~48 h 均可得到较高的存活率,考虑到节省时间成本,认为黑暗处理24 h 更适用于炼苗。暗处理可以降低植物蒸腾作用,为刚刚转换生长环境的再生苗提供一个缓冲时间,不经过暗处理的再生苗容易失水萎蔫,生根苗存活率仅有85.83%。
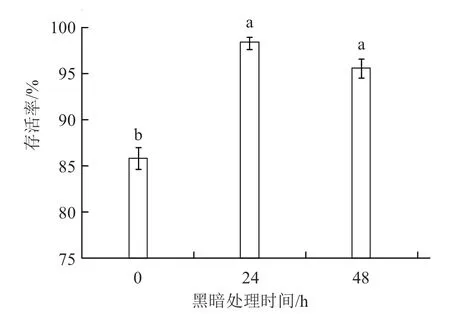
图1 黑暗处理时间对西瓜生根苗存活率的影响
2.5 西瓜子叶离体再生体系
切取2/3 的培养4~5 d、子叶刚刚由黄转绿时的近轴端西瓜子叶,接种于不定芽诱导培养基(含2.25 mg·L6-BA 和0.1 mg·LNAA 的MS 培养基)中(图2-A,2-B)。3~5 d 后,子叶颜色转变为翠绿色,且发生明显生长。2 周左右后靠近胚轴的切口处逐渐膨大形成愈伤组织(图2-C),而后由愈伤组织处开始产生不定芽簇(图2-D),从接种子叶到不定芽簇生长至1~2 cm 需25~28 d;此时小心切除多余子叶,将其移至不定芽伸长培养基(含1.0 mg·L6-BA 和0.50 mg·LIAA 的MS培养基)中(图2-E),7~10 d 可见明显伸长;不定芽伸长至3~5 cm 时(图2-F),将其转入生根培养基(含1.0 mg·LIBA 的1/2MS 培养基)中,再生芽比较容易生根(图2-G),生根率相对较高。约20 d后,对无菌苗进行炼苗和移栽(图2-H,2-I)。西瓜离体再生苗从子叶接种到获得可移栽的再生植株约需要63 d。

图2 西瓜子叶离体再生体系
3 讨论与结论
通过西瓜外植体途径获得再生植株的研究较多,技术相对成熟,通常认为子叶节是比较理想的外植体(马绍鋆,2017)。西瓜再生体系的建立受基因型、外植体类型、激素配比及浓度等诸多因素的影响(牛美丽 等,2015)。6-BA 是西瓜不定芽诱导的关键激素。大部分研究中西瓜不定芽诱导培养基中添加的6-BA 浓度为1~3 mg·L之间(Srivastava et al.,1989;Choi et al.,1994;谢 永红,2016)。本试验不定芽诱导培养基添加了2.25 mg·L6-BA,获得了相对较高的诱导率90.56%。过高浓度的6-BA 容易导致畸形芽(Rakhi &Bhatnagar,2001)和玻璃化现象(谢永红,2016)的发生。
本试验结果还表明,添加低浓度的NAA(0.1 mg·L)较单独使用6-BA 不定芽诱导率有所升高,这可能是因为低浓度NAA 诱导了更多不定芽的分化,详细机制尚不清楚。外植体都是通过愈伤组织间接形成不定芽,不定芽周围也易产生新的不定芽,形成不定芽簇,其机理还需进一步探究。
综上所述,在西瓜子叶再生过程中,以1/2 MS 培养基为种子萌发培养基,采用培养4~5 d 近轴端的2/3 子叶为外植体,将其接种于不定芽诱导培养基上,不定芽诱导培养基的最佳配比是MS+2.25 mg·L6-BA+0.1 mg·LNAA,诱导率可达到90.56%。然后经过不定芽伸长培养和生根培养获得完整再生植株,不定芽伸长的最佳培养基配比是MS+1.0 mg·L6-BA+0.50 mg·LIAA,培养7~10 d 可达到生根要求;生根的最佳培养基配比是1/2MS+1.0 mg·LIBA,生根率可达到93.33%。最佳的炼苗方法是将生根苗移至消过毒的基质中,每株分别罩保鲜膜,放置于人工气候培养箱中,首先黑暗处理24 h(16 h 30 ℃,8 h 25 ℃,湿度60%),然后30 ℃ 16 h 光照,光强1 000 lx,25 ℃ 8 h 黑暗,48 h 后将光强调至2 000 lx,4 d 后即可正常管理,再生苗的存活率为98.33%。该再生体系过程大约需63 d。再生体系的建立为西瓜转基因体系的建立、加快育种进程和优良品种选育以及抗逆砧木选育提供了科学依据和技术支持。
