X射线调强放疗与电子线放疗对早期乳腺癌保乳术后血清肿瘤标志物和T细胞亚群的影响*
2022-03-31梁巧媚郑报张晓葳陈磊
梁巧媚, 郑报, 张晓葳, 陈磊
(安徽医科大学附属阜阳医院 肿瘤放疗科, 安徽 阜阳 236000)
乳腺癌的患病率约为10%,多见于育龄期女性,可严重影响患者的生活质量[1]。保乳术及术后放疗是早期乳腺癌的有效治疗方式之一,可有效清除微小病灶,降低肿瘤的复发及转移,提高患者生存率[2-3],目前临床对放疗的瘤床补量方式存有争议。电子线放疗及X射线调强放疗都是临床常见瘤床补量方式,电子线放疗方案照射剂量分布不均匀、多集中于心脏及患侧,而X射线调强放疗靶区剂量分布均匀[4-5]。有研究报道电子线及X射线调强放疗在乳腺癌局部肿瘤控制率的效果相当,但临床关于2种瘤床补量方式在乳腺癌患者术后血清肿瘤标志物、T细胞亚群及副反应上存在一定差异[6-7]。基于此,本研究探讨X射线调强放疗与电子线放疗对乳腺癌术后血清肿瘤标志物、T细胞亚群及副反应的影响,为改善乳腺癌预后提供参考,报告如下。
1 资料和方法
1.1 一般资料
选取2018年9月—2021年1月在本院进行X射线调强放疗的早期乳腺癌术后患者48例为观察组,另按照年龄、手术方式为配伍原则,收集同期行电子线放疗的早期乳腺癌术后患者42例为对照组。入选标准:(1)符合《中国抗癌协会乳腺癌诊治指南与规范》[8]、且经病理学确诊者;(2)均为女性单侧乳腺癌、且接受乳腺癌保乳术治疗者;(3)临床分期Ⅰ~Ⅱ期;(4)患者或家属均知情同意者。排除标准:(1)重要脏器功能不全者;(2)存在精神障碍;(3)有其他恶性肿瘤病史;(4)有免疫系统疾病;(5)有血液系统疾病者。观察组中,年龄38~52岁,平均(42.05±5.12)岁;体质量指数(BMI)19~28 kg/m2,平均(23.54±2.18)kg/m2。对照组中,年龄36~54岁,平均(41.26±4.76)岁;BMI 19~28 kg/m2,平均(23.36±2.52)kg/m2。本研究获医院医学伦理委员会批准,批准文号为2019(17)。
1.2 方法
两组患者均行乳腺癌保乳术治疗,完整切除肿瘤后,放疗前均行表阿霉素或紫杉醇为主的化疗方案。保乳术后1个月内对患者进行全乳照射50 Gy/25次,若患者出现腋窝淋巴结转移,进行同侧锁骨上下淋巴引流区照射,放疗剂量(DT)=50 Gy/25次。对照组瘤床补量行电子线放疗:以手术切口向外延伸20 mm为瘤床靶区,并确保90%剂量线在胸壁上;同时设置固定的源皮距照射,在皮肤表面垂直照射8~10 MeV电子线,剂量为10~16 Gy/5~8次。观察组瘤床行X射线调强放疗:将CT图像术中标记、手术瘢痕及术后勾画的改变区设为瘤床靶区,以瘤床区域向外延伸3 mm,后界不超过胸肌前缘为计划靶区,处方剂量为10~16Gy/5~8次。
1.3 观察指标
1.3.1照射剂量 (1)瘤床靶区,95%、105%、110%以上的相应处方剂量射线照射瘤床体积百分比V95%、V105%、V110%;(2)心脏、患侧肺照射剂量。
1.3.2肿瘤标志物 于放疗前、放疗后1个月、3个月时抽取患者静脉血3 mL, 3 000 r/min离心10 min,分离血清检测癌胚抗原(CEA,采用放射免疫法)及糖类抗原15-3(CA153,采用化学发光法)。
1.3.3T细胞亚群 于放疗前、放疗后1个月、3个月采用SC流式细胞仪(美国,贝克曼)测定患者的CD3+、CD4+、CD4+/CD8+值。
1.3.4副反应 放疗期间观察患者恶心呕吐、口腔黏膜炎、放射性皮肤损伤、放射性食管炎、放射性肺炎、心脏毒性、血液毒性等。毒副反应以WHO不良反应分级为标准[9]:0级,未出现不良反应;Ⅰ级,不良反应为轻度;Ⅱ级,不良反应为中度;Ⅲ级,不良反应为重度;Ⅳ级,严重不良反应。
1.4 统计学处理

2 结果
2.1 一般资料
两组患者一般资料比较差异无统计学意义(P>0.05)。见表1。
表1 两组乳腺癌患者一般资料比较Tab.1 Comparison of general data of breast cancer patients between two groups
2.2 照射剂量
两组患者靶区V95%比较,差异无统计学意义(P>0.05);但观察组靶区V105%、V110%量、心脏及患侧肺照射剂量均低于对照组(P<0.05)。见表2。

表2 两组乳腺癌患者术后瘤床补量照射剂量比较Tab.2 Comparison of postoperative tumor bed supplemental radiation doses between two groups
2.3 肿瘤标志物水平
结果显示,放疗前两组患者CEA及CA153水平比较,差异无统计学意义(P>0.05);放疗后,两组CEA及CA153水平均随放疗时间延长而降低,但观察组均低于对照组(P<0.05)。见表3。
2.4 T细胞亚群
结果显示,放疗前两组患者CD3+、CD4+及CD4+/CD8+比较,差异无统计学意义(P>0.05);放疗后,两组患者CD3+、CD4+及CD4+/CD8+均随放疗时间延长而降低,但观察组均高于对照组(P<0.05)。见表4。

表4 两组乳腺癌手术患者放疗前后T细胞亚群比较Tab.4 Comparison of T cell subsets before and after radiotherapy between two groups
2.5 副反应
两组乳腺癌手术后患者瘤床放疗补量治疗后,恶心呕吐、口腔黏膜炎、放射性皮肤损伤、放射性食管炎、放射性肺炎及心脏毒性等毒副反应多集中发生在Ⅰ~Ⅱ级患者中,且两组患者毒副反应比较,差异无统计学意义(P>0.05)。见表5。
3 讨论
近年来乳腺癌的发病率不断提升,乳房疼痛、乳腺肿块、乳头溢液是其常见症状,若未及时进行治疗可严重影响患者的生活质量及健康[10]。保乳术后放疗加瘤床补量方案对乳腺癌的治疗效果已得到临床证实,其可有效杀死残留病灶,降低术后复发及转移率,提高患者预后[11]。临床资料显示,瘤床靶区剂量的均匀分布是瘤床补量的关键,其可进一步提高乳腺癌患者的肿瘤控制率[12-13]。电子线瘤床补量虽对乳腺癌患者的治疗效果确切,但由于乳腺组织厚度不均、表面呈曲线形变化,瘤床位于乳房边缘时可影响电子线照射剂量的不均匀分布,可能对靶区正常组织、患侧肺及心脏造成损伤[14-15];X射线调强放疗属于精确放疗技术,其剂量分布均匀且穿透性强,对位置较深、形状不规则的瘤床靶区补量治疗有效[16]。本研究中,观察组靶区V105%、V110%量、心脏及患侧肺照射剂量均显著低于对照组,提示X射线调强放疗靶区剂量均匀性分布优于电子线放疗,且其对正常组织的照射剂量少,降低了放射过程中正常组织的损伤。
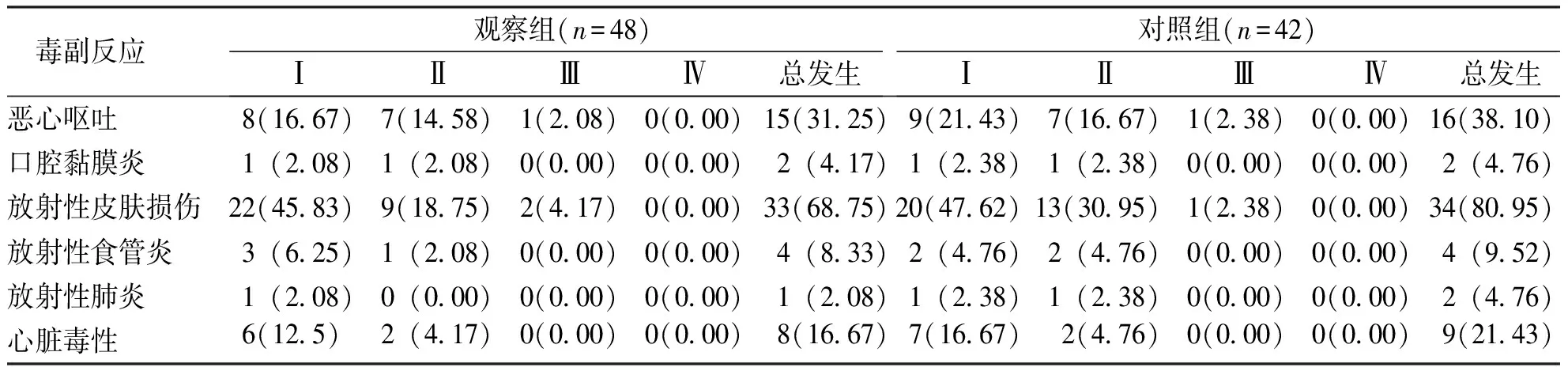
表5 两组乳腺癌手术患者瘤床补量治疗后副反应比较[n(%)]Tab.5 Comparison of side effects after tumor bed supplementation therapy between two groups[n(%)]
血清肿瘤标志物水平与乳腺癌疾病的发展密切相关[17]。CEA为糖蛋白,主要存在于肿瘤细胞表面,研究指出,乳腺癌患者CEA水平较高,可参与淋巴及血液循环,且黏附能力强[18]。CA153是乳腺癌特异性标志物,其不仅可减低细胞黏附性,促使癌细胞脱落转移,且其含量变化与乳腺癌治疗效果密切相关[19]。本研究中,放疗前两组患者CEA、CA153水平均较高、放疗后均降低,但观察组低于对照组,提示X射线调强放疗对癌细胞的杀灭作用更明显,可降低CEA的分泌,可用于乳腺癌预后状况的监测。
减少对瘤床靶区正常组织及心脏的照射剂量,以降低患者正常组织放射性损伤是保乳术后放疗的重要目的[20-21]。放疗对机体的负向损伤作用虽不可避免,但如何降低放疗造成的放射性损伤仍是临床研究的重点[22]。本研究中的两组乳腺癌手术患者放疗补量治疗后血液CD3+、CD4+及CD4+/CD8+均随放疗时间延长而降低,提示放疗的免疫抑制效果显著高于肿瘤消失对机体免疫抑制的解除效果,且观察组患者的CD3+、CD4+及CD4+/CD8+高于对照组,提示X线调强放疗对患者免疫功能的影响较电子线电放疗小,分析原因可能与X线调强放疗瘤床靶区剂量的均匀分布及正常组织放射性损伤少有关。
放疗过程中会不可避免的对机体造成负向损伤,两组乳腺癌手术患者放疗补量治疗后恶心呕吐、口腔黏膜炎、放射性皮肤损伤、放射性食管炎、放射性肺炎及心脏毒性等毒副反应多集中发生在Ⅰ~Ⅱ级的乳腺癌患者中,该结果与国内外较多报道相符[23-25],提示X线调强放疗与电子线放疗对乳腺癌患者的毒副作用均较小,这可能与放疗技术的相对成熟及放疗中不良反应的预防有关。
