机械通气导致小鼠认知障碍时对自噬和NLRP3炎症小体的影响*
2022-03-31张晗陈婷陈畅唐李娟陈莹莹钟琦张宗泽
张晗, 陈婷, 陈畅, 唐李娟, 陈莹莹, 钟琦, 张宗泽
(武汉大学中南医院 麻醉科, 湖北 武汉 430071)
机械通气是危重症患者呼吸道管理的重要手段,可导致机械通气相关性肺损伤(ventilator-induced lung injury, VILI)和包括脑在内的远隔器官功能障碍[1]。自噬是维持细胞内环境稳定的一种自我保护机制,用于隔离和降解细胞溶质大分子和受损细胞器,最近的研究证实巨噬细胞自噬参与炎症反应的精细控制[2]。Nod样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体是一种存在于细胞质中的蛋白复合物,可触发效应蛋白半胱氨酸天冬氨酸酶-1(caspase-1)的激活从而促进促炎细胞因白细胞介素(interleukin,IL)1β和IL-18的成熟和释放,并引起炎症反应[3]。本课题组前期研究证实,机械通气6 h后即刻小鼠脑组织自噬水平增强[4];也有研究表明,机械通气时NLRP3炎症小体被激活,可放大肺部炎症级联反应[5];创伤性脑损伤模型中,NLRP3炎症小体会被激活[6],同时阻断自噬增强了 NLRP3炎症小体通路的激活[7]。对自噬调控NLRP3炎症小体在机械通气致认知障碍中的作用值得探讨,本研究拟评价机械通气导致小鼠认知障碍时对自噬和NLRP3炎症小体的影响,为明确其机制提供参考。
1 材料与方法
1.1 材料
1.1.1实验分组与处理 SPF级健康雄性C57BL/6小鼠110只,8~12周龄,体质量20~25 g,由武汉大学动物实验中心提供。110只小鼠采用随机数字表法分为4组:对照组(C组,n=26)、机械通气组(MV组,n=28)、机械通气+雷帕霉素处理组(Rap组,n=28)、机械通气+6-氨基-3-甲基嘌呤处理组(3-MA组,n=28),MV组小鼠腹腔注射1%戊巴比妥0.05 mg/g麻醉后机械通气6 h;Rap组和3-MA组小鼠在机械通气前1 h分别给予0.001 mg/g自噬激动剂PaP和0.015 mg/g自噬抑制剂3-MA、再腹腔注射1%戊巴比妥0.05 mg/g麻醉后机械通气6 h,C组小鼠腹腔注射等量1%戊巴比妥后自主呼吸6 h。
1.1.2主要试剂及仪器 TOPOTM动物呼吸机(美国Kent Scientific公司),PhysioSuite动物血氧监控仪(美国Kent Scientific公司),22 G静脉留置针(美国 B.Brun Melsungen公司),雷帕霉素(美国Selleck公司),6-氨基-3-甲基嘌呤(美国Selleck公司),SuperMaze 旷场动物行为视频分析系统(上海欣软信息科技有限公司),水迷宫动物行为视频分析系统(上海吉良软件科技公司),倒置相差显微镜和普通正置显微镜(日本Olympus公司);抗体、NLRP3一抗、凋亡相关微粒蛋白(advanced synthesis & catalysis,ASC)一抗和离子钙接头蛋白抗原(ionized calcium bindingadaptor molecule-1,IBA-1)一抗(美国abcam公司)、自噬相关蛋白p62一抗和微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)一抗(美国CST公司)、Caspase-1一抗(美国santa公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的免疫球蛋白G(immunoglobulin G,IgG)二抗(美国Aspen公司),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染液(中国Aspen公司),4%多聚甲醛缓冲液(碧云天生物有限公司)。
1.2 研究方法
1.2.1小鼠机械通气模型的制备[8]腹腔注射1%戊巴比妥0.05 mg/g,待小鼠翻正反射消失,仰卧位固定,取头高后肢低位,用镊子将舌头推向一侧,然后用自制弧形压舌板将舌头向上提拉暴露声门,同时,将照射灯垂直照射于颈部声门处,22 G静脉留置针插入气管内,拔除针芯,确定双肺通气良好,胶布固定,连接TOPOTM动物呼吸机,采用压力控制模式进行机械通气,吸入氧浓度50%,通气频率130次/min,吸气峰压13~15 cmH2O(1 cmH2O=0. 098 kPa),连接PhysioSuite动物血氧监控仪测脉搏血氧饱和度和脉率。根据通气情况,追加戊巴比妥维持麻醉,每2 h腹腔注射乳酸林格溶液0.1 mL;机械通气6 h,气管拔管后观察无异常放回笼常规饲养。
1.2.2旷场实验 于机械通气结束后第1 和第3天,每组取8只小鼠,参照文献[9]的方法行旷场实验。旷场实验分析箱为有机板制成白色无顶不透明的空箱(40 cm×40 cm×40 cm),四壁涂黑,将其分为16(4×4)个大小均等的方格,中间的4个方格为中央区。实验前,动物在测试房间适应10 min以上。实验时,每只小鼠均从中间放入空箱中,允许其在箱中自由探索5 min,采用视频监测分析系统(SuperMaze 系统分析软件)记录运动总路程、中央区停留时间、跨格次数。实验后用75%酒精擦拭实验箱,以避免残留气味对后续实验小鼠的影响。
1.2.3Morris水迷宫实验 于机械通气结束后第1 天,每组取8只小鼠,参照文献[10]的方法行Morris水迷宫实验。圆形水池直径120 cm,高60 cm,平台高50 cm,直径10 cm,水池内注水使平台低于水面1 cm,屏蔽剂为脱脂奶粉。水池分为4个象限,选择其中一个象限作为目标象限并置入平台,水池中心上方1.5 m处放置摄像机用于追踪小鼠游泳路径。水迷宫实验共进行6 d,第1~5天为定向航行实验:小鼠分别从水池4个对称位置面向池壁入水,间隔20 min开始下一个象限,记录每次入水到找到平台的时间,若60 s内未找到平台,则引导其找到平台,并在平台上停留15 s,时间记为60 s,取4次测试结果的平均值为逃避潜伏期;第6天为空间探索实验:去除平台,将小鼠头朝池壁从原平台象限对侧缓慢放入水中,记录60 s内运动轨迹,记录目标象限停留时间,计算目标象限停留时间百分比。
1.2.4Western blot检测 于机械通气结束后第1和第3 天,每组取6只小鼠,戊巴比妥麻醉后断头冰上取脑,再分离双侧海马组织,放入液氮保存。采用Western blot法检测p62、LC3-Ⅱ、LC3-Ⅰ、NLRP3、ASC、Caspase-1。取液氮冻存的海马组织,加入相应体积裂解液,匀浆后离心,取上清,BCA法测定蛋白浓度。取40 μg蛋白样品加入样品孔中,SDS-PAGE凝胶电泳分离蛋白,分离蛋白质电转印至PVDF膜,室温下封闭液孵育1 h,分别加入内参GADPH抗体 (1 ∶10 000)、p62一抗 (1 ∶1 000)、LC3一抗(1 ∶1 000)、NLRP3一抗(1 ∶500)、Caspase-1一抗(1 ∶500)、ASC一抗(1 ∶2 000),4 ℃孵育过夜。TBST洗膜3次,每次15 min,洗膜后加入HRP标记的山羊抗兔二抗(1 ∶10 000),室温孵育30 min,TBST室温摇床洗4次,每次5 min,暗室内加入显色发光液曝光、扫描。采用Image J软件处理系统进行分析光密度值,并计算p62、NLRP3、Caspase-1、ASC与内参GADPH的比值和LC3-Ⅱ与LC3-Ⅰ表达的比值(LC3-Ⅱ/LC3-Ⅰ),以反映目的蛋白的表达水平。
1.2.5免疫荧光检测 于机械通气结束后第1和第3 天,每组随机取4只小鼠,戊巴比妥麻醉后固定,暴露心脏,将灌注装置的针尖插入小鼠左心室,剪开右心耳,生理盐水冲净血液,然后用冰的4%多聚甲醛灌注小鼠,灌注成功标志为小鼠尾巴翘起,取小鼠海马组织,4%多聚甲醛固定,石蜡包埋,连续冠状面切片3张,片厚5 μm。石蜡切片置于65 ℃烘箱中烘片2 h,脱蜡复水后,置于EDTA缓冲液中微波修复。切片经PBS漂洗3次、每次5 min,正常山羊血清室温封闭1 h,PBS漂洗后,加入一抗IBA-1抗体(1 ∶50),4 ℃孵育过夜,加入相应的FITC标记的IgG二抗(1 ∶100),室温孵育50 min,PBS洗涤3次、每次5 min,DAPI染液室温避光孵育5 min后PBS漂洗3次、每次5 min,抗荧光淬灭封片剂封片,在BX-51荧光显微镜下观察、拍片。在海马CAl区采集各指标免疫荧光图像,并观察细胞形态,离子钙接头蛋白-1(IBA-1)呈红色荧光,采用Image Pro Plus图像分析系统计数IBA-1阳性细胞数,反映小胶质细胞的活化水平。每只小鼠随机切取3张切片,每张切片3个视野。
1.3 统计学方法

2 结果
2.1 运动总路程、中央区停留时间及跨格次数
与C组比较,MV组小鼠各时点中央区停留时间延长,跨格次数减少(P<0.05);与MV组比较,Rap组小鼠各时点中央区停留时间缩短,跨格次数增加(P<0.05),3-MA组各时点中央区停留时间延长,跨格次数减少(P<0.05)。各组小鼠的运动总路程比较差异无统计学意义(P>0.05)。见表1。
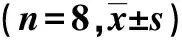
表1 四组小鼠机械通气结束后各时点的旷场实验结果Tab.1 Comparison of the results of the open field experiment at each time point after the mechanical ventilation of the four groups of
2.2 逃避潜伏期与目标象限停留时间百分比
与C组比较,MV组小鼠各时点逃避潜伏期延长,目标象限停留时间百分比降低(P<0.05);与MV组比较,Rap组小鼠各时点逃避潜伏期缩短、目标象限停留时间百分比升高(P<0.05),3-MA组小鼠各时点逃避潜伏期延长、目标象限停留时间百分比降低(P<0.05)。见表2和表3。
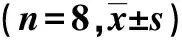
表2 四组小鼠机械通气结束后第1天逃避潜伏期和目标象限停留时间百分比Tab.2 Comparison of the 1st day escape latency and the percentage of stay time in the target quadrant after the end of mechanical ventilation in the four groups of
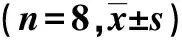
表3 四组小鼠机械通气结束后第3天逃避潜伏期和目标象限停留时间百分比的比较Tab.3 Comparison of the 3rd day escape latency and the percentage of stay time in the target quadrant after the end of mechanical ventilation in the four groups of
2.3 海马组织自噬相关蛋白p62和LC3-Ⅱ/LC3-Ⅰ的表达
与C组比较,MV组小鼠各时点海马组织p62表达降低,LC3-Ⅱ/LC3-Ⅰ表达增加(P<0.05);与MV组比较,Rap组小鼠各时点海马组织p62表达增加、LC3-Ⅱ/LC3-Ⅰ表达降低(P<0.05),3-MA组小鼠各时点海马组织p62表达降低、LC3-Ⅱ/LC3-Ⅰ表达增加(P<0.05)。见图1。
2.4 海马 NLRP3、ASC、Caspase-1的表达
与C组比较,MV组小鼠各时点海马组织NLRP3、ASC、Caspase-1表达增加,差异有统计学意义(P<0.05);与MV组比较,Rap组小鼠各时点海马组织NLRP3、ASC、Caspase-1表达降低,3-MA组各时点海马组织NLRP3、ASC、Caspase-1表达增加,差异有统计学意义(P<0.05)。图2。
2.5 海马小胶质细胞IBA-1的表达
与C组比较,MV组小鼠各时点小胶质细胞标记物IBA-1阳性细胞数增加,差异均有统计学意义(P<0.05);与MV组比较,Rap组小鼠各时点海马小胶质细胞标记物IBA-1阳性细胞数减少,3-MA组小鼠各时点小胶质细胞标记物IBA-1阳性细胞数增加,差异均有统计学意义(P<0.05)。见图3。
3 讨论
机械通气是一种至关重要的生命支持工具,但它也可能对肺、膈肌和大脑等远端器官造成损伤,有证据表明机械通气是脑损伤的促成因素,通过诱发全身炎症或改变与神经炎症和神经元死亡相关的迷走神经信号导致认知障碍[11]。自噬与炎症反应密切相关,自噬可负向调控NLRP3炎症小体的激活,应用自噬激动剂雷帕霉素可促进自噬诱导,增加NLRP3炎症小体降解[12]。有研究提出在小鼠动物实验中330 min为长时间机械通气[13],也有研究表明90 min高气道压机械通气就可通过迷走多巴胺通过发挥作用引起海马凋亡发生率增加[13]。前期研究证实,小鼠机械通气6 h,可引起海马神经元凋亡,导致早期学习记忆功能下降[14],因此本研究选择机械通气时间为6 h。术后长期机械通气的患者急性脑功能障碍通常发生在机械通气结束后1~3 d[15],因此本研究在机械通气后第1和第3天评价海马炎症反应。参照文献[16-17]选择3-MA的剂量为0.015 mg/g,RaP的剂量为0.001 mg/g,于机械通气前1 h腹腔注射。
旷场实验用于评价动物自主行为、探索行为及紧张度[18],主要观察动物在开阔环境中的行为学变化。Morris水迷宫实验作为评价龋齿类动物空间学习记忆的经典方法,主要包括定向航行实验和空间探索实验[19]。本研究结果显示,小鼠机械通气6 h后中央区停留时间延长,跨格次数减少,运动总路程差异无统计学意义,提示小鼠探索行为减少,对新环境认知能力降低,但运动能力无明显变化;逃避潜伏期延长,目标象限停留时间百分比降低,提示小鼠海马相关记忆功能减退。以上结果表明,机械通气小鼠认知障碍模型制备成功。与MV组比较,Rap组各时点中央区停留时间缩短,跨格次数增加,逃避潜伏期缩短,目标象限停留时间百分比升高;3-MA组各时点中央区停留时间延长,跨格次数减少,逃避潜伏期延长,目标象限停留时间百分比降低,提示自噬激动剂RaP减轻了机械通气导致的脑损伤,自噬抑制剂3-MA加重了机械通气导致的脑损伤。
机械通气时导致的神经认知障碍主要是基于肺脑交互机制,外周(肺)与中枢神经系统(CNS)之间通过体液、神经和细胞这3条途径进行沟通。体液途径即在肺中募集的单核细胞或巨噬细胞增加了炎症介质如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-1β,这些介质可以通过体液途径室周器官(OCV)直接到达中枢神经系统,而无需穿过血脑屏障(BBB),还有其他主动运输机制会在大脑水平产生前列腺素E2(PGE2)和一氧化氮;神经途径即迷走神经通路的传入通过孤束核(NTS)到达大脑;细胞途径即由肺中的TNF-α直接调节,这会刺激大脑水平的单核细胞-1(MCP-1)的释放,反过来又能够增加CNS和外周激活单核细胞的募集[20]。NLRP3炎症小体是由NLRP3、ASC和Caspase-1组成,是系列炎症反应的核心。NLRP3炎症小体的降解可抑制小胶质细胞的炎症反应,减少炎性介质的分泌,在神经退行性病变中发挥作用[21]。有研究表明,大潮气量机械通气急性期促发肺部异常自噬活跃,自噬标志物LC3-Ⅱ表达过度上调,肺泡巨噬细胞形成自噬小体增多,激活NLRP3炎症小体,导致肺组织病理损伤增加,IL-1β等炎症介质表达增加[16]。有研究表明,慢性脑缺血损伤诱导小胶质细胞过度激活,阻断自噬可能有助于激活NLRP3炎症小体,进一步加剧神经炎症的发生[7]。在阿尔茨海默病中,小胶质细胞的自噬激活可降解和清除细胞外β-样淀粉蛋白,并调节β-淀粉样蛋白诱导的NLRP3炎症小体激活[22]。本研究中,与C组相比,MV组各时点海马组织p62表达降低,LC3-Ⅱ/LC3-Ⅰ、NLRP3、ASC、Caspase-1表达增加,提示机械通气可能通过激活NLRP3炎症小体导致小鼠的神经认知障碍。与MV组相比,Rap组各时点海马组织p62表达增加,LC3-Ⅱ/LC3-Ⅰ、NLRP3、ASC、Caspase-1表达降低;3-MA组各时点海马组织p62表达降低,LC3-Ⅱ/LC3-Ⅰ、NLRP3、ASC、Caspase-1表达增加,提示RaP通过增强自噬减轻了机械通气导致的炎症反应,3-MA通过抑制自噬加重了这种炎症反应。
IBA-1在神经系统特异表达在小胶质细胞表面,激活小胶质细胞可大幅上调IBA-1表达。小胶质细胞激活是神经炎症的标志,持续的小胶质细胞激活可能会促进NLRP3炎症小体的过度激活[23]。研究表明,外周炎症刺激激活脑内小胶质细胞活化参与脓毒症所致谵妄[24]。本课题组前期研究证实,MV激活海马小胶质细胞、引起凋亡级联通路,导致认知功能障碍[25]。本研究中,与C组比较,MV组各时点海马小胶质细胞IBA-1阳性细胞数增加;与MV组比较,Rap组各时点海马小胶质细胞IBA-1阳性细胞数减少,3-MA组各时点小胶质细胞IBA-1阳性细胞数增加,提示机械通气过程中自噬增加、NLRP3炎症小体激活可能与小胶质细胞的激活有关。
综上所述,机械通气可导致小鼠神经认知功能障碍,NLRP3炎症小体介导了机械通气相关性脑损伤的发生、发展过程,可能与自噬水平减弱及NLRP3炎症小体激活有关。增强自噬可通过增加NLRP3炎症小体的降解来减轻这种炎症反应,从而改善认知障碍。
