黄芪多糖通过抑制钙蛋白酶1/NF- κB信号通路减轻低氧诱导的肺动脉高压小鼠肺炎症反应和纤维化
2022-03-31邓海艳田小雪孙鹤宁刘晓健王洪新
刘 欢,邓海艳,田小雪,孙鹤宁,刘晓健,王洪新
(锦州医科大学辽宁省心脑血管药物重点实验室,辽宁 锦州 121001)
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺血管阻力和肺动脉压升高为特征的一组临床综合征,是慢性心力衰竭和慢性阻塞性肺疾病最常见的并发症之一[1]。有研究表明,炎症是PAH的显著病理特征之一,PAH患者中肺组织促炎细胞因子增加[2]。同时据报道,PAH可能加重肺纤维化,严重PAH患者也可能患有肺纤维化。在PAH发展过程中,肺血管重构是由特发性肺纤维化引起的,促纤维化因子的分泌可使细胞外基质蛋白增加,从而加剧肺血管重构或肺损伤,导致PAH[1],基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、转化生长因子 β1(transforming growth factor-β1,TGF-β1)和羟脯氨酸(hydroxyproline,HYP)等均参与肺纤维化的形成和发展[3-4]。缺氧是PAH发病机制中的一个危险因素[5]。到目前为止,由于缺乏有效的治疗方法,PAH患者的死亡率仍然很高[6]。因此,寻找新的PAH治疗药物并揭示其潜在的分子机制具有重要意义。
钙蛋白酶1属非溶酶体半胱氨酸蛋白酶家族,主要通过细胞内Ca2+浓度的增加而激活,与许多慢性血管性疾病有密切联系[7-9]。NF-κB是控制炎症信号及先天性和适应性免疫的转录调节剂,能够上调多种炎症因子表达,在包括PAH在内的多种疾病发生发展中具有重要作用[10-11]。有研究表明,在低氧缺血状态下,组织细胞可表现出细胞内Ca2+超载,从而激活钙蛋白酶1[12]。而活化钙蛋白酶1能够激活NF-κB,进而使其下游因子表达增多,如TNF-α,IL-1β,MMP-9和TGF-β1等[13-14],产生炎症反应和纤维化反应,加剧PAH的发展。
黄芪多糖(Astragalus polysaccharides,APS)是我国传统中药黄芪的主要成分之一,具有抗炎、抗凋亡、抗病毒和抗氧化作用,并对心血管疾病有很好的治疗作用[15-16]。有实验表明,APS对野百合碱诱导的PAH有保护作用[17],但对低氧诱导的PAH的作用尚未见文献报道。本研究旨在探讨APS对低氧诱导小鼠PAH的影响及其作用机制。
1 材料与方法
1.1 药物、试剂和仪器
APS(纯度95%)(南京景竹生物科技有限公司);BAY11-7082和MDL-28170(上海蓝木化工有限公司);兔抗小鼠钙蛋白酶1和NF-κB P65多克隆抗体、兔抗小鼠β肌动蛋白单克隆抗体(武汉三鹰生物技术有限公司);兔抗小鼠磷酸化NF-κB P65(phosphorylated NF-κB P65,p-NF-κB P65)和TGF-β1多克隆抗体(万类生物有限公司);兔抗小鼠MMP-9多克隆抗体,辣根过氧化物酶标记山羊抗兔IgG抗体(二抗)(武汉爱博泰克生物科技有限公司);ELISA试剂盒(上海酶联生物科技有限公司);HE染色试剂盒(碧云天生物技术研究所)。Masson染色液(北京雷根生物技术有限公司);胎牛血清(美国Sigma公司);高糖DMEM(美国Gibico公司);CCK-8试剂盒(上海奥默生物技术有限公司)。低温高速离心机(美国Thermo Fisher公司);BL-420S生物机能实验系统(成都泰盟科技有限公司);凝胶成像仪和半干转印仪(美国Bio-Rad公司);Leica DMI 3000B倒置显微镜(德国Leica公司)。
1.2 动物、模型制备和分组给药
野生型雄性C57BL/6小鼠40只,6~9周龄,体重20~30 g(辽宁生物技术股份有限公司),动物许可证编号:SYXK(辽)2019-0007;雄性钙蛋白酶1敲除(calpain-1knockout,Capn1 EK684 FN-/-)型小鼠16只,6~9周龄,体重15~30 g(广州赛业生物科技有限公司),动物许可证编号:SYXK(辽)2017-0003。小鼠自由摄食饮水,预适应7 d后进行分组处理。采用低氧舱(10% O2,90% N2)内饲养制备肺动脉高压模型小鼠。野生型小鼠分为5组,每组8只:正常对照组、低氧模型组、模型+APS 200和400 mg·kg-1组(ig给予,每日1次),模型+BAY11-7082 5 mg·kg-1(ip给予,每周3次);Capn1 EK684 FN-/-小鼠分为敲除对照组和敲除低氧模型组。正常对照和敲除对照组小鼠饲养于正常环境中,其余组均置低氧舱内,持续低氧饲养28 d,舱内用无水氯化钙吸收水蒸气和CO2。
1.3 右心室收缩压和右心室肥厚指数检测及样本制备
28 d后,小鼠ip给予10%水合氯醛(3.5 mL·kg-1)麻醉,采用经肋间肌穿刺法检测小鼠右心室收缩压(right ventricular systolic pressure,RVSP)。眼球取血液后立即取双肺和心脏,血液694×g离心15 min,取上清液,置-20℃冰箱备用。称全心重量及右心室重量,计算右心肥厚指数(right ventricular hypertrophy index,RVHI),RVHI=右心室重量(g)/(左心室重量+室间隔重量)(g);右肺置于-80℃冰箱中保存,用于HYP水平检测和Western印迹法实验;左肺置于4%多聚甲醛中固定24 h,后续进行HE染色和Masson染色。
1.4 HE染色观察肺小血管重构
取1.3用4%多聚甲醛固定的左肺组织,石蜡包埋,制成厚度5μm的切片,进行HE染色。采用Image-Pro Plus程序收集和分析图像,计算血管壁厚度比和血管壁面积比。血管壁厚度比(%)=(血管外径-血管内径)/血管外径×100%;血管壁面积比(%)=(血管总面积-管腔面积)/血管总面积×100%。
ERP发展至今,作为一个目前被广泛认可的、能体现企业管理理念的信息平台,它主要突出表现在:从人治到法治的规范化管理;流程透明,信息畅通;对内、外部环境的变化响应及时;数据提供实时;强化企业上下游之间的信息沟通。
1.5 Masson染色观察肺组织胶原纤维沉积
取1.3制备的左肺组织,石蜡包埋,切片,常规脱蜡至水,加Bouin固定液固定2 h,天青石蓝染色液进行染色,水洗;苏木精染色,盐酸乙醇溶液分化,蒸馏水洗涤,丽春红酸品红溶液染色,蒸馏水洗涤,1%磷钼酸染色,无需水洗直接滴加苯胺蓝溶液,弱酸处理。之后快速脱水,二甲苯透明,中性树胶封片。采用Image-Pro Plus分析图像,计算胶原纤维沉积面积百分数(即胶原纤维面积/总面积×100%)。
1.6 肺动脉平滑肌细胞的培养
分离野生型C57BL/6小鼠肺动脉,用含1%青、链霉素的PBS冲洗数次,直至液体清亮。纵向剪开肺动脉,将内外膜刮去,所得的中膜转移到含20%胎牛血清的DMEM培养基中。把分离的肺动脉切成1 mm×1 mm×1 mm小块,将其转移到培养瓶中,加入培养液。瓶底朝上,静置于37℃、5% CO2的细胞培养箱中孵育4~5 h,待组织块干涸后,翻转培养瓶,让培养液慢慢浸润组织块。待细胞长到80%~90%时可进行细胞传代。倒去培养瓶中旧培养基,加PBS充分清洗细胞面。倒去PBS加0.25%胰蛋白酶1 mL,37℃消化1 min细胞收缩变圆形,立即加入含血清培养基终止消化。反复吹打细胞使其脱落,1∶3分瓶接种。
1.7 细胞分组
取1.6培养的细胞,制备成2×107L-1细胞悬液,取100 μL细胞悬液接种于96孔中37℃,5% CO2恒温细胞培养箱中24 h。根据预实验结果,确定APS浓度为0.6 g·L-1。细胞分为细胞对照组、低氧组、低氧+APS 0.6 g·L-1、低氧+BAY11-7082 10 μmol·L-1、低氧+MDL-28170 10 μmol·L-1组。除细胞对照组外,其余组加药后直接置低氧培养箱(3% O2、97% N2)培养24 h。收集细胞并转移至离心管内,2775×g,离心3 min,弃上清,加入细胞裂解液重悬细胞,每隔5 min振荡20 s,共6次。静置30 min后15 984×g,离心20 min,取上清。
1.8 CCK-8法检测肺动脉平滑肌细胞存活率
取1.7分组的细胞,每个孔中加入10 μL CCK-8试剂,并在恒温培养箱中孵育3 h,最后在450 nm处测定吸光度(A450nm)值,计算细胞存活率。细胞存活率(%)=(实验组A450nm-空白孔A450nm)/(细胞对照组A450nm-空白孔A450nm)×100%。
1.9 ELlSA检测小鼠血清和肺动脉平滑肌细胞中lL-1 β和TNF- α水平及肺组织中HYP水平
取1.3制备的小鼠血清和1.7分组的细胞,按ELISA试剂盒说明检测小鼠血清和细胞中IL-1β和TNF-α水平及1.3制备的肺组织中HYP水平。
1.10 Western印迹法检测小鼠肺组织和肺动脉平滑肌细胞中钙蛋白酶1,TGF- β1和MMP-9蛋白表达水平和NF- κB P65蛋白磷酸化水平
取1.3制备的肺组织,加1%PMSF的RIPA缓冲液分离出总蛋白以及取1.7制备的细胞进行蛋白定量。将等量的蛋白质样品经SDS-PAGE(10%~12%聚丙烯酰胺凝胶)分离后转移到硝酸纤维素滤膜上,用1%BSA室温封闭1.5 h,然后在4℃下与一抗〔钙蛋白酶1(1∶1000)、NF-κB P65(1∶1500)、p-NF-κB P65(1∶800)、TGF-β1(1∶800)、MMP-9(1∶1500)和 β肌动蛋白(1:3000)〕孵育过夜。TBST洗涤3次,然后在室温下与二抗(1∶10 000)孵育2 h。用Bio-Rad凝胶成像系统进行图像采集,Image J软件进行半定量分析,用目的蛋白条带和内参蛋白条带积分吸光度值的比值表示目的蛋白相对表达水平,p-NF-κB P65与NF-κB P65条带吸光度值的比值表示NF-κB P65磷酸化水平。
1.11 统计学分析
2 结果
2.1 黄芪多糖对低氧诱导的肺动脉高压小鼠右心室收缩压及右心室肥厚指数的影响
如表1所示,与野生型正常对照组比较,低氧模型组小鼠RVSP和RVHI显著升高(P<0.05);与低氧模型组相比,模型+APS组、模型+BAY11-7082组和敲除低氧组的RVSP和RVHI显著降低(P<0.05)。

Tab.1 Effect of Astragalus polysaccharides(APS)on right ventricular systolic pressure(RVSP)and right ventricular hypertrophy index(RVHl)of mice with pulmonary arterial hypertension(PAH)induced by hypoxia
2.2 黄芪多糖对低氧诱导的肺动脉高压小鼠肺小血管重构的影响

Tab.2 Effect of APS on vascular wall thickness ratio(WTR)and wall area ratio(WAR)of mice with PAH induced by hypoxia
2.3 黄芪多糖对低氧诱导的肺动脉高压小鼠肺组织纤维化的影响
Masson结果(图2)显示,野生型正常对照组小鼠肺组织中胶原纤维渗出较少,低氧模型组小鼠肺组织胶原纤维渗出增多;模型+APS组、模型+BAY11-7082和敲除低氧组小鼠肺组织胶源纤维渗出减少。Masson图像分析结果(表3)显示,与野生型正常对照组比较,低氧模型组小鼠胶原沉积面积指数显著升高(P<0.05);与低氧模型组相比,模型+APS组、模型+BAY11-7082组和敲除低氧组小鼠肺组织胶原沉积面积指数显著降低(P<0.05)。

Tab.3 Effect of APS on collagen fiber deposition area in lung tissue of mice with PAH induced by hypoxia
2.4 黄芪多糖对低氧诱导的肺动脉平滑肌细胞存活率的影响
CCK-8检测结果(表4)显示,与细胞对照组比较,低氧模型组细胞存活率显著升高(P<0.05),说明低氧可诱导PASMC增殖;与低氧模型组相比,低氧+APS组、低氧+MDL-28170组、低氧+BAY11-7082组细胞存活率均下降(P<0.05),说明APS对PASMC增殖有抑制作用。

Tab.4 Effect of APS on viability of pulmonary artery smooth muscle cells(PASMCs)treated with hypoxia
2.5 黄芪多糖对低氧诱导的肺动脉高压小鼠血清及肺动脉平滑肌细胞中lL-1 β和TNF- α水平的影响
2.5.1 小鼠血清
ELISA结果(表5)显示,与野生型正常对照组比较,低氧模型组小鼠血清中IL-1β和TNF-α的水平显著升高(P<0.05);与低氧模型组相比,模型+APS组、敲除低氧组和模型+BAY11-7082组小鼠血清中的IL-1β和TNF-α水平显著降低(P<0.05)。

Tab.5 Effect of APS on interleukin-1 β(lL-1 β)and tumor necrosis factor(TNF- α)levels in serum of mice with PAH induced by hypoxia
2.5.2 肺动脉平滑肌细胞
ELISA结果(表6)显示,与细胞对照组比较,低氧组的PASMC中IL-1β和TNF-α的水平显著升高(P<0.05);与低氧组相比,低氧+APS组、低氧+MDL-28170组和低氧+BAY11-7082组PASMC中IL-1β和TNF-α的水平显著降低(P<0.05)。

Tab.6 Effect of APS on levels of lL-1 β and TNF- α in PASMCs treated with hypoxia
2.6 黄芪多糖对低氧诱导的肺动脉高压小鼠肺组织HYP水平的影响
ELISA结果(表7)显示,与野生型正常对照组比较,低氧模型组小鼠肺组织HYP水平显著升高(P<0.05);与低氧模型组相比,模型+APS组、模型+BAY11-7082组和敲除低氧组小鼠肺组织HYP水平显著降低(P<0.05)。
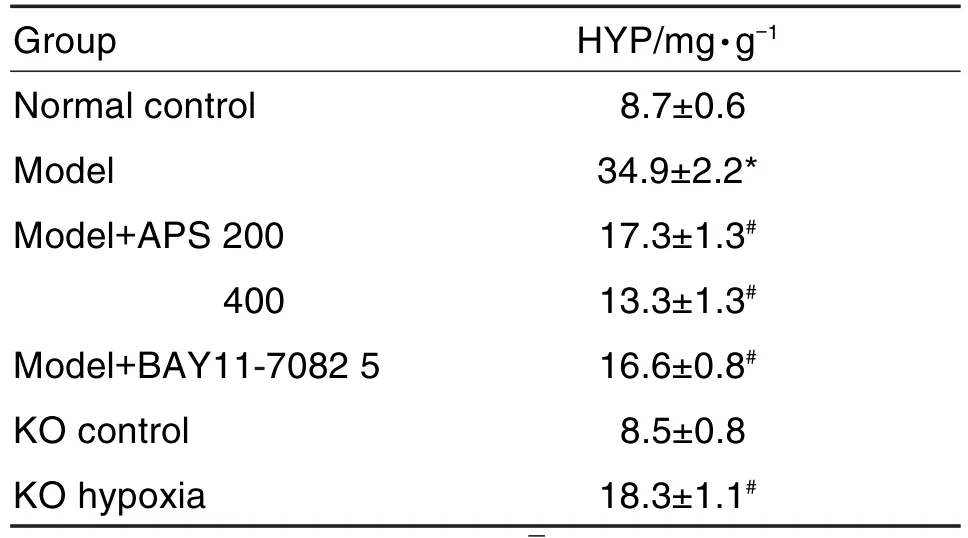
Tab.7 Effect of APS on level of hydroxyproline(HYP)in lung tissue of mice with PAH induced by hypoxia
2.7 黄芪多糖对低氧诱导的肺动脉高压小鼠肺组织及肺动脉平滑肌细胞MMP-9和TGF- β1蛋白表达水平的影响
2.7.1 小鼠肺组织
Western印迹结果(图3)显示,与野生型正常对照组比较,低氧模型组小鼠肺组织MMP-9和TGF-β1蛋白表达水平显著升高(P<0.05);与低氧模型组相比,模型+APS组、模型+BAY11-7082和敲除低氧组小鼠肺组织MMP-9和TGF-β1蛋白表达水平显著降低(P<0.05)。
2.7.2 肺动脉平滑肌细胞
Western印迹结果(图4)显示,与细胞对照组比较,低氧组PASMC中MMP-9和TGF-β1蛋白表达水平显著升高(P<0.05);而与低氧组相比,低氧+APS组、低氧+MDL-28170组、低氧+BAY11-7082组PASMC中MMP-9和TGF-β1蛋白表达水平显著降低(P<0.05)。
2.8 黄芪多糖对低氧诱导的肺动脉高压小鼠肺组织及肺动脉平滑肌细胞中钙蛋白酶1蛋白表达水平和NF- κB P65蛋白磷酸化水平的影响
2.8.1 小鼠肺组织
Western印迹结果(图5)显示,与野生型正常对照组比较,钙蛋白酶1敲除型正常对照组小鼠钙蛋白酶1表达水平显著降低(P<0.05),说明敲除钙蛋白酶1成功。与野生型正常对照组比较,低氧模型组小鼠钙蛋白酶1蛋白表达水平和NF-κB P65蛋白磷酸化水平显著升高(P<0.05);与低氧模型组相比,模型+APS组、模型+BAY11-7082组和敲除低氧组钙蛋白酶1蛋白表达水平和NF-κB P65蛋白磷酸化水平显著降低(P<0.05)。
2.8.2 肺动脉平滑肌细胞
Western印迹结果(图6)显示,与细胞对照组比较,低氧组PASMC中钙蛋白酶1蛋白表达水平和NF-κB P65蛋白磷酸化水平显著升高(P<0.05);与低氧模型组相比,低氧+MDL-28170组、低氧+BAY11-7082组、低氧+APS组PASMC钙蛋白酶1蛋白表达水平和NF-κB P65蛋白磷酸化水平显著降低(P<0.05)。
3 讨论
PAH作为一种临床常见疾病和多发病,其主要的临床病理特征包括肺血管阻力升高和肺血管重构,并伴随着右心室前后负荷增加,右心功能障碍,严重者可导致右心室衰竭,甚至死亡。因此正确评价右心室功能对PAH的临床诊断具有一定的参考价值,其中RVSP和RVHI是评价PAH重要的指标[18-19]。本研究结果发现,低氧诱导的PAH小鼠肺小血管增厚,RVSP和RVHI显著升高。而APS可以显著抑制肺小血管的重塑,降低PAH小鼠的RVSP和RVHI,提示APS对低氧诱导的PAH小鼠具有保护作用。
PAH是肺纤维化严重的并发症之一,同时严重的PAH患者也伴随着肺纤维化[20]。有研究发现,PAH模型小鼠肺组织纤维化,减轻肺纤维化对PAH有显著改善作用[21]。Zhang等[16]研究发现,APS可以显著降低肺组织HYP水平,并抑制TGF-β1表达,减轻肺组织纤维化。本研究体内实验结果表明,低氧诱导的PAH小鼠肺组织中胶原纤维沉积面积增大,MMP-9和TGF-β1蛋白表达显著上调,且肺组织中HYP水平显著升高,而APS可显著减少小鼠肺组织胶原纤维沉积面积,降低MMP-9和TGF-β1蛋白表达及HYP水平。体外实验结果同体内实验结果一致,低氧诱导的肺动脉平滑肌细胞中MMP-9和TGF-β1蛋白表达显著升高,经APS干预后MMP-9和TGF-β1的蛋白表达显著下降。本研究结果与上述文献报道结果相符,说明APS能够改善低氧诱导的肺动脉高压所产生的肺纤维化。
低氧诱导的PAH会发生炎症反应。在PAH患者和模型动物的肺组织中发现大量炎症细胞在重构的肺血管周围积累并向血管内浸润,并在局部产生大量的促炎细胞因子如IL-1β和TNF-α等,炎症因子会促进血管细胞过度收缩与增殖,导致肺血管重构[22]。研究表明,APS能够减轻野百合碱诱导的PAH大鼠的炎症反应[17],还可以通过NF-κB丝裂原活化蛋白激酶通路减轻脂多糖诱导的炎症[15],有明显的抗炎作用。本研究体内、外实验结果发现,在低氧条件下,PAH小鼠血清和PASMC中IL-1β和TNF-α水平显著升高,而APS可明显降低IL-1β和TNF-α水平,表明APS可通过抗炎对低氧诱导的PAH起保护作用。
有研究发现,肺动脉高压动物模型中钙蛋白酶1和NF-κB表达显著上调,通过抑制钙蛋白酶1和NF-κB的活性,可显著改善肺动脉高压的症状[23-24]。研究结果显示,钙蛋白酶1敲除鼠及使用NF-κB抑制剂可以降低低氧诱导的PAH小鼠的RVSP和RVHI,减少肺血管重构和肺纤维化面积以及降低致纤维化因子MMP-9、HYP和TGF-β1及炎症因子IL-1β和TNF-α的表达。同时,使用钙蛋白酶1抑制剂及NF-κB抑制剂可以降低低氧诱导的PASMC中致纤维化因子MMP-9和TGF-β1及炎症因子IL-1β和TNF-α的表达。此结果表明,钙蛋白酶1敲除鼠、钙蛋白酶抑制剂和NF-κB抑制剂可以改善低氧诱导PAH的症状。
本研究体内、外实验结果表明,低氧诱导的PAH小鼠肺组织及PASMC中钙蛋白酶1表达水平和NF-κB P65磷酸化水平显著升高,而经敲除或抑制钙蛋白酶1、使用NF-κB抑制剂及APS干预后,钙蛋白酶1表达水平和NF-κB P65磷酸化水平显著降低。因此,APS可以通过调控钙蛋白酶1/NF-κB通路对低氧诱导的PAH小鼠起到保护作用。
综上所述,APS可降低低氧诱导的PAH小鼠的RVSP和RVHI,抑制肺小血管的重塑,并改善炎症反应和肺纤维化,对低氧诱导的PAH小鼠具有明显的保护作用。其作用机制可能与抑制钙蛋白酶1/NF-κB信号通路的激活有关。
