Bcl-2结合抗凋亡基因家族在泛癌中的作用
2022-03-31李雅娴李永翔
李雅娴,李永翔
Bcl-2结合抗凋亡基因(Bcl-2-associated athanogenes,BAGs)家族编码的蛋白是一个多功能的协同蛋白聚糖组,其编码蛋白与Bcl-2家族蛋白无氨基酸同源序列,是一种新的非Bcl-2家族的Bcl-2结合蛋白,与已知在细胞存活和细胞死亡途径中起作用的不同结合配偶体相互作用[1]。6个BAG家族成员共享一个进化保守序列——“BAG结构域”,这些编码蛋白通过该结构域各自与分子伴侣——70 ku热休克蛋白(heatshockprotein70,HSP70)相互作用[2]。事实上,虽然BAG蛋白可以与Bcl-2相互作用,增强其抗凋亡作用,但是其主要功能仍然是作为HSP70的辅助伴侣控制蛋白质稳态。此外,由于BAG蛋白可以与Bcl-2相互作用并增加其抗凋亡能力,所以可以进一步推测BAG具有致癌作用[3],因此,BAGs成为目前癌症研究的焦点,对该家族的研究可能会有助于推进未来癌症的靶向治疗发展。
1 材料与方法
1.1 数据下载与处理2021年4月8日,从UCSC Xena数据库的GDC TCGA集中下载了包括33种肿瘤类型的11 057例样本数据,其中包括该基因家族的表达谱、表型信息以及存活数据[4]。另外,从数据库中获得了所有患者的人口统计学资料、肿瘤信息和随访数据。在本研究中,TCGA肿瘤的33种类型和缩写采用国际通用说法。
1.2 肿瘤与正常组织中BAGs的差异表达分析和共表达分析对于下载的原始数据,本研究使用“ggpubr”R包通过Wilcox 检验对肿瘤和正常组织之间的差异表达进行分析,在呈现的热图结果中,6个BAG家族基因在泛癌中的表达差异以log2倍变化的形式呈现。另外,本研究利用“corrplot” R包在转录水平上对BAG家族基因之间进行共表达分析[5],阐明每两个BAG基因之间的潜在表达模式。
1.3 临床相关性分析根据下载的原始数据中的中位表达水平,将患者分为高表达组和低表达组,再利用R包分析表达高水平和低水平BAGs基因的患者之间的总体生存结果的差异,从而生成了泛癌中BAGs基因的生存分析图(Kaplan-Meier plots)。同时,应用Cox比例风险回归来评估每个肿瘤类型中BAG1、BAG2、BAG3、BAG4、BAG5和BAG6的风险比。
1.4 免疫亚型分析根据肿瘤的6种免疫亚型(C1~C6):伤口愈合型(C1)、IFN-γ主导型(C2)、炎症型(C3)、淋巴细胞殆尽型(C4)、免疫静默型(C5)和TGF-β主导型(C6),评估了TGCA肿瘤类型中6种不同免疫亚型的BAG家族的mRNA表达水平,并用Kruskal检验进行了差异表达分析。
1.5 干细胞指标与泛癌微环境使用“estimate”R包和“limma”R包在6个BAG基因的表达水平和基质细胞得分之间进行Spearman相关分析[6],并使用一类逻辑回归(one-class logistic regression ,OCLR)算法计算了TCGA肿瘤样本的干细胞指数,并基于基因表达和干细胞指数进行了Spearman 相关分析[7],干细胞指数包括DNAss和RNAss[8]。具体而言,本研究应用了RNAss、DNAss、基质细胞得分、免疫细胞得分和综合得分(基质细胞得分和免疫细胞得分的代数和),分析与PPAR转录表达的相关性。
1.6 统计学处理利用R 软件4.0.3进行分析,热图以logFC的变化值表示,生存分析图用Kaplan-Meier plots表示,风险比用Cox比例风险回归评估,差异表达分析用Kruskal检验表示,Spearman相关分析用OCLR表示,在箱式图、生存曲线图和Cox风险比例回归图中,P<0.05 为差异有统计学意义。
2 结果
2.1 肿瘤与正常组织中BAGs家族基因的差异表达分析和共表达分析图1的箱式图显示了BAGs家族基因表达,图2、3采用秩和检验对肿瘤和正常组织之间的6个BAG基因进行差异表达分析,结果表明,这6个基因在所有类型的肿瘤中表达有高有低,但是BAG6在绝大多数类型肿瘤中高表达。由图2、3可知,与正常组织比较,BAG6只有在KICH中低表达,在其他肿瘤中均高表达;同时,除了BAG3在CHOL中低表达,其他BAG家族基因在CHOL中均呈现高表达。另外,值得注意的是,在肿瘤与正常组织表达差异比较分析中发现,肾部肿瘤KIRC和KIRP在BAG1、BAG2、BAG3、BAG4中均呈现低表达,但是在BAG6中却表现出高表达。而且,肺部肿瘤LUAD和LUSC在BAG2、BAG3、BAG4、BAG6中均高表达,但在BAG1中却是低表达。

图1 BAGs家族基因表达箱式图

图2 BAG基因家族在肿瘤中表达热图
图4的共表达分析表明,BAG基因家族两两之间都存在正相关性,BAG5和BAG6之间的相关系数为0.73,这说明两者有较强相关性。同时,BAG1和BAG6、BAG2和BAG5、BAG3和BAG6、BAG3和BAG5、BAG4和BAG5、BAG5和BAG6也都表现出较强的相关性。
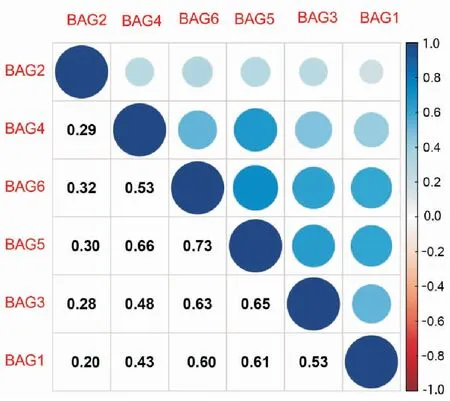
图4 BAG基因家族共表达相关系数图
2.2 临床相关性分析本研究对TCGA中的33种肿瘤进行了BAGs家族基因的生存分析(Kaplan-Meier analysis),由图5可知,BAG1的低表达与KIRC患者的不良预后显著相关 (P<0.001),相对应地,BAG1在KIRC中肿瘤较正常组织低表达。相反,BAG2表达升高与LIHC 患者的较差临床结果相关(P<0.001),这也与肿瘤与正常组织差异表达结果相一致。由于通常Cox比例风险回归可用于检测基因在肿瘤中的预后作用,并将危险比>1的基因视为一个危险预后因素,所以BAG1对于PCPG是一个危险预后因素,BAG2对于KICH、THCA和UVM是危险预后因素。见图6。

图5 肿瘤中BAG高表达和BAG低表达的生存曲线图
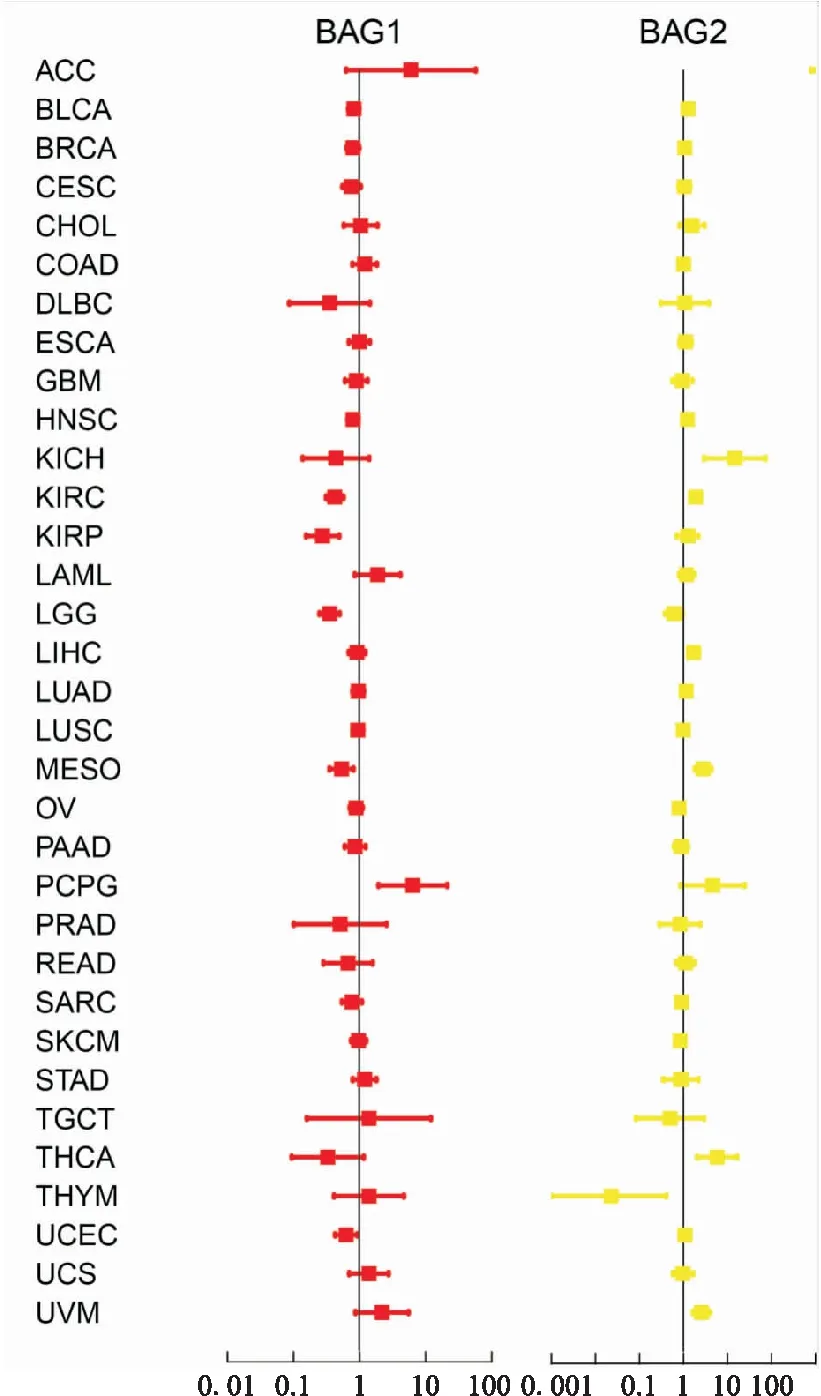
图6 Cox风险比例回归图
2.3 免疫亚型分析通过对肿瘤的6种免疫亚型中BAGs家族基因表达进行差异表达分析可知,BAG1、BAG2、BAG3、BAG4、BAG5和BAG6的表达模式在泛癌中的6种免疫亚型中存在差异(均P<0.001)。结果显示,BAG6在C1~C6的整体表达水平上排名第一,BAG2在C1~C6的整体表达水平最低。见图7。

图7 C1~C6免疫亚型中BAGs的转录表达图
2.4 干细胞指标与肿瘤微环境对于DNAss、LGG和BAG家族基因之间普遍存在负相关,如,BAG1(r=-0.246,P<0.001)、BAG4(r=-0.200,P<0.001)、BAG6(r=-0.197,P<0.001)均与LGG呈负相关。另外,THYM和不同的基因相关情况有所不同,BAG1(r=-0.320,P<0.001)和BAG6(r=-0.529,P<0.001)与THYM呈负相关,BAG3(r=0.503,P<0.001)和BAG4(r=0.347,P<0.001)与THYM呈正相关。见图8A。

图8 BAG家族与干细胞指数和微环境评分的相关分析结果图
对于RNAss,TGCT和BAGs之间普遍存在相关性,TGCT RNAss和BAG1(r=-0.448,P<0.001)呈负相关,和BAG2(r=0.296,P<0.001)、BAG4(r= 0.464,P<0.001)、BAG5(r=0.282,P<0.001)以及BAG6(r=0.335,P<0.001)均呈正相关。另外,LUSC RNAss和BAG之间也存在普遍正相关性,LUSC RNAss和BAG1(r=0.154,P<0.001)、BAG2(r=0.286,P<0.001)、BAG4(r=0.270 ,P<0.001)和BAG5(r=0.196 ,P<0.001)均呈现正相关。见图8B。
本研究发现BAG2的表达与多种肿瘤类型呈正相关,包括BLCA、BRCA、CHOL、COAD、ESCA、GBM、HNSC、KICH、KIRC和PAAD等,这表明BAG2的高表达与多种肿瘤的低纯度有关。同时,BAG2和BAG6与肿瘤纯度的关系存在显著差异,BAG2的高表达与绝大多数肿瘤的高肿瘤纯度相关,而BAG6的模式相反。见图8C。
3 讨论
本研究探讨了BAGs家族的表达转录与泛癌的一系列相关性,包括肿瘤微环境、临床意义、免疫亚型和干细胞微环境。在对包括TCGA的33个肿瘤的数据进行分析后发现,各个BAG基因在不同肿瘤中的表达存在差异,在后续生存分析中显示,在某些肿瘤中,高表达的BAG基因和低表达的BAG基因患者生存时间存在有统计学意义的差异,这说明了BAG基因很有可能可以作为一个肿瘤临床预后指标。此外,根据研究者先前确定的C1~C6免疫亚型[9],本研究通过代表性免疫特征对肿瘤样本进行分类,发现它们都具有差异表达,这些免疫特征与细胞外基质、肿瘤脉管系统和肿瘤细胞一起构成了肿瘤微环境(tumor microenvironment,TME)的概念,其异质性高度影响治疗反应和临床预后[10]。因此,本研究通过基质细胞得分、免疫细胞得分和综合得分,进一步获得了33种TCGA肿瘤样本中基质细胞和免疫细胞的分数,结果说明这些TME特征与BAG1~6的表达水平相关。据报道[11],细胞干性可以用来描述肿瘤细胞的干细胞样特征:自我更新和去分化,而且在许多肿瘤进展中发现了干细胞样特性的获得[12],因此,在本研究中利用了OCLR方法计算肿瘤样本的RNAss评分和DNAss评分,然后将其与BAGs的转录特征相关联,表明BAGs基因可能在高干细胞维持中起作用。
已有研究[13]表明,BAGs家族可以与Bcl-2蛋白相互作用并增加其抗凋亡能力,故其在肿瘤生成、发展以及预后过程中均可能发挥作用。由本研究的结果可知,BAG基因对一些肿瘤的预后和生存有指导意义,说明其可能可以作为这些癌症的临床生物标记物,给癌症的诊断和治疗提供可视化帮助。另外,本研究中BAGs家族与肿瘤微环境和基质细胞之间的关系提示后续相关研究可以从体外研究入手,从而将对BAG蛋白有效的化疗药物或者放疗方法通过纳米载体等方式直接作用于肿瘤组织,达到事半功倍的治疗效果。此外,研究[12]表明,BAGs家族蛋白可调节细胞的增生、转录和迁移,结合本研究中该家族中不同蛋白在不同免疫亚型中的表达不同这一结果,启发未来相关研究者可以通过检测不同的免疫亚型分子来对该家族基因进行合理检验,从而使肿瘤在早期得以诊断。
综上所述,通过对BAG1~6的多维分析揭示了BAGs家族在泛癌水平上的各种表达模式,表明了BAG基因可能可作为多种癌症的潜在诊断和预后评估标志物,并可能会为患者术后个体化治疗提供理论支持。
