咖啡酸对阿霉素心肌细胞损伤的保护作用及机制研究
2022-03-31叶鹏林朱杨杰高恶斌
唐 炜,叶鹏林,刘 坤,朱杨杰,高恶斌
阿霉素(adriamycin,ADM)是一种蒽环类抗生素,抗癌效果显著,是目前最常用最重要的抗癌药物之一[1]。然而,长期给药会对心脏、骨髓、肾脏造成不可逆毒性作用,严重阻碍其临床应用[2]。ADM可在体内形成多种氧自由基,导致心肌细胞及亚细胞结构改变,破坏细胞膜引起钙超载,进而引起心肌细胞凋亡。因此,深入探讨ADM诱导心肌毒性的内在机制,并探究有效的心肌保护剂,对解决ADM诱导致毒问题十分必要。咖啡酸(caffeic acid,CA)是酚酸类化合物,广泛存在于植物体内,具有抗炎、抗菌、抗病毒等药理作用。最近有研究[3]表明,CA对心血管疾病如动脉粥样硬化等具有保护作用。但其对ADM心肌损伤的保护作用及具体机制尚不清楚。因此,该研究通过建立ADM诱导大鼠心肌细胞损伤模型,探讨CA对心肌损伤的保护作用及相关机制。
1 材料与方法
1.1 材料
1.1.1细胞与培养 实验细胞为大鼠H9c2细胞系,江苏大学生命科学学院中心实验室保存。在含有10%胎牛血清(FBS)的DMEM培养基培养,置于37 ℃含5% CO2恒温培养箱中常规传代培养。
1.1.2药品与试剂 CA(纯度≥99%)购自美国Acros Organics公司,MTT细胞增殖及细胞毒性试剂盒购自上海碧云天生物科技有限公司,ADM、乳酸脱氢酶(lactate dehydrogenase, LDH)活性检测试剂盒和活性氧(reactive oxygen species, ROS)检测试剂盒购自北京索莱宝科技有限公司,JC-1线粒体膜电位检测试剂盒购自上海翊圣生物科技有限公司,线粒体Na+-K+-ATP酶和Ca2+-ATP酶活性试剂盒购自南京建成生物科技有限公司,NF-κB和β-actin抗体购自英国Abcam公司。
1.2 方法
1.2.1细胞培养与处理 用DMEM+10%FBS培养基培养H92c心肌细胞,细胞密度至80%左右时吸取多余培养基,用PBS冲洗2次,0.25%胰酶消化3 min后加入培养基中和,轻轻吹打至细胞脱落,按照1 ∶3传代数次至细胞状态稳定。
取对数生长期H92c心肌细胞,按每孔5×103个细胞接种于96孔板中,每组平行设置5个复孔,待细胞贴壁后,分别加入相关药物干预。首先进行ADM浓度的筛选。H9c2心肌细胞分别加入0(对照组)、1.0、2.0、3.0、4.0 μmol/L ADM(使DMSO 最终浓度<0.1%)作用12 h,选择接近其半抑制浓度(half maximal inhibitory concentration,IC50)值的浓度进行后续研究。其次进行给药模型的建立。在最适ADM浓度处理心肌细胞后,分别用0.5、1.0、2.0、4.0、8.0 μmol/L CA处理24 h,置于37 ℃、5% CO2环境中培养。设置ADM处理组为模型组(ADM组)、不同浓度CA干预组为治疗组(ADM+CA组)及空白对照组(Control组)。
在处理后,每孔加入终浓度为5 mg/ml的MTT 10 μl,培养4 h后添加100 μl DMSO溶液,在450 nm处测定吸光值,每组重复3次,计算细胞存活率和IC50。
1.2.2细胞内LDH水平检测 收集Control组、ADM组和ADM+CA组培养24 h后的H9c2细胞,按照LDH活性检测试剂盒说明书测定上清LDH含量,并根据相关公式计算LDH活力变化。
1.2.3细胞内ROS水平检测 分组同上所述,收集各组细胞,加入10 μmol/L DCF-DA,孵育20 min后用荧光显微镜观察ROS荧光强度。荧光强度的高低反映细胞内ROS的水平。
1.2.4线粒体膜电位检测 分组同上所述,在各组样本中加入JC-1使其达到所需终浓度,避光,37 ℃孵育15 min,再用PBS洗去多余的染料后测定。
1.2.5线粒体Na+-K+-ATP酶、Ca2+-ATP酶活性检测 分组同上所述,收集各组细胞后用PBS悬浮细胞并破碎,离心取上清液,测定吸光度。操作步骤严格按照线粒体Na+-K+-ATP酶、Ca2+-ATP酶活性检测试剂盒进行。
1.2.6Western blot法检测NF-κB蛋白表达情况 分组同上所述,提取各组细胞总蛋白。取50 μg蛋白样本进行Western blot检测,以β-actin为内参,用Multi-analyst image成像系统检测蛋白条带,并用Image J软件定量。
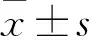
2 结果
2.1 ADM诱导H9c2心肌损伤模型的建立与Control组比较,1.0、2.0、3.0和4.0 μmol/L ADM处理都会引起H9c2心肌细胞存活率的显著下降,并且随处理剂量增加细胞活力显著降低,具有剂量依赖效应。其中1.0 、2.0 μmol/L ADM处理与Control组比较差异有统计学意义(P<0.05),3.0、4.0 μmol/L ADM处理与Control组比较差异更显著(P<0.01)。ADM对心肌细胞的损伤与浓度呈正相关,当ADM浓度为2.0 μmol/L时对细胞的损伤量约在50%,为药物IC50,因此选择2.0 μmol/L ADM处理作为后续实验条件。见图1。

图1 不同浓度ADM处理细胞后的MTT细胞活力统计图
2.2 CA对大鼠心肌组织损伤的保护作用不同浓度的CA对ADM诱导的心肌细胞损伤有一定保护作用,0.5 μmol/L CA即对ADM诱导的心肌损伤呈现保护效应(P<0.05),并且心肌细胞的存活率随CA浓度增加显著提高,具有剂量依赖性。当CA浓度为4.0 μmol/L时对H9c2保护效果最佳。因此,取2.0 μmol/L ADM和4.0 μmol/L CA作为治疗组进行后续实验。见图2。
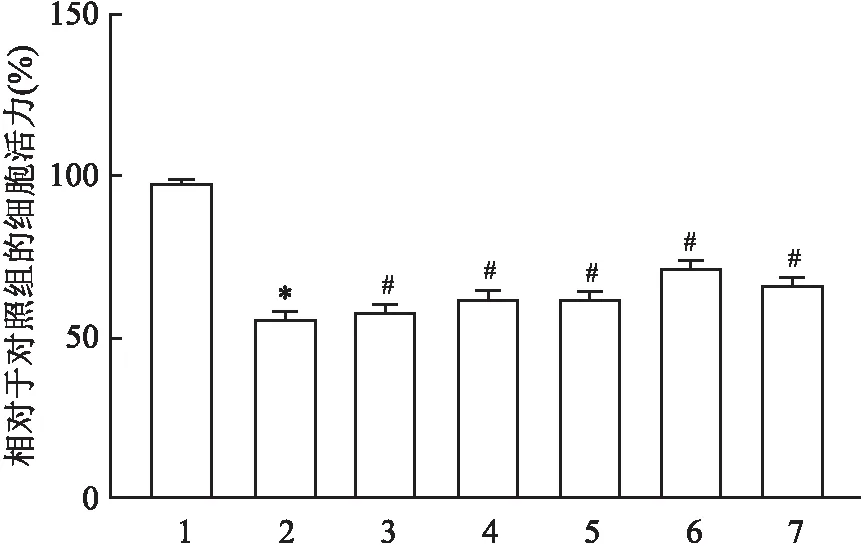
图2 不同浓度CA保护损伤细胞后的MTT细胞活力统计图
HE染色结果显示,Control组心肌细胞排列整齐致密、细胞形态正常。与Control组比较,ADM组心肌呈片状坏死、空泡性变性、心肌纤维增多、心肌细胞片状溶解,心肌松散,细胞间隙增宽。而,ADM+CA组中心肌纤维化、变性等较轻,肌纤维变性减少。见图3。

图3 CA对H9c2心肌细胞形态的影响
2.3 CA对ADM损伤的心肌细胞内LDH水平的影响与Control组比较,ADM组中的LDH水平显著提高;而加入CA后治疗组中LDH水平明显降低,表明CA可以抑制细胞内LDH在损伤后的显著提高。见图4。
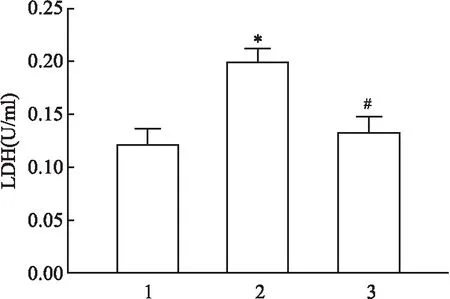
图4 各组心肌细胞上清的LDH活力水平统计图
2.4 CA对ADM损伤的心肌细胞内活性氧水平的影响在荧光显微镜下观察各组细胞内荧光强度,通过荧光强度的强弱反映ROS水平的高低。Control组内平均荧光强度为(63.110±2.223),而ADM组中的平均荧光强度为(132.098±7.117),与Con-trol组比较明显升高。而ADM+CA组细胞内平均荧光强度为(103.582±4.992),较ADM组显著下降;利用单因子方差分析结果显示,各组间均差异有统计学意义(P<0.000 1,F=223.9)。结果表明,CA可以抑制ADM诱导心肌细胞中ROS激增过程。见图5。
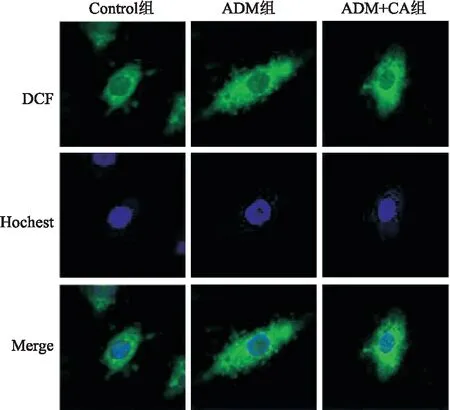
图5 激光共聚焦显微镜下各组心肌细胞ROS水平 ×400
2.5 CA对ADM损伤的心肌细胞内线粒体膜电位的影响同样利用荧光强弱反映线粒体膜电位的水平。与Control组比较,ADM组细胞内红色荧光强度明显下降,由(207.876±5.072)降为(90.918±4.649);而ADM+CA组中红色荧光强度为(105.200±3.501)。one-way ANOVA统计分析结果显示,各组间均差异有统计学意义(P<0.01,F=1 025)。结果表明,ADM能够引发心肌细胞线粒体膜电位下降,而加入CA则可以改善该过程。见图6。

图6 荧光显微镜下各组细胞线粒体膜电位水平 ×200
2.6 CA对ADM损伤的心肌细胞内线粒体Na+-K+-ATP酶、Ca2+-ATP酶活性的影响与Control组比较,ADM组心肌细胞H9c2中线粒体Na+-K+-ATP酶、Ca2+-ATP酶的活性均呈现显著降低(P<0.05);而与ADM组比较,ADM+CA组线粒体Na+-K+-ATP酶、Ca2+-ATP酶的活性则有了明显升高(P<0.05)。表明ADM造成了心肌细胞中线粒体Na+-K+-ATP酶和Ca2+-ATP酶活性的降低,而加入CA则能改善这种损伤。见图7。

图7 各组心肌细胞内Na+-K+-ATP酶和Ca2+-ATP酶活性水平
2.7 CA对ADM损伤的心肌细胞内NF-κB信号通路影响Western blot结果显示,与Control组比较,ADM组p65蛋白的表达水平明显增高,而加入CA的治疗组中,p65蛋白的表达量则有所降低。见图8。
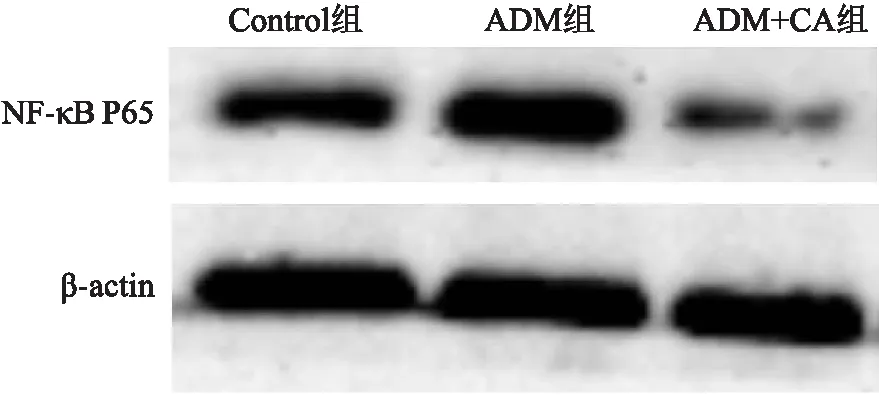
图8 Western blot检测各组心肌细胞中NF-κB p65蛋白表达量
3 讨论
ADM是一种高效的蒽醌类抗肿瘤药物,可以通过抑制肿瘤细胞DNA复制过程起到抗肿瘤作用。然而长期使用ADM会造成心肌细胞不可逆损伤[4],这严重限制了ADM抗肿瘤的临床应用。目前,ADM导致心脏毒性的机制尚不明确[5],因此探寻ADM对心肌细胞的损伤机制,并开发相应的保护药物具有重要的临床意义。
研究表明[6],ADM会诱发心肌细胞产生大量的ROS,从而导致心肌细胞处于氧化应激状态,本研究中,ADM诱导的损伤ADM组中ROS水平高于Control组,与前人研究结果吻合[7]。此外,心肌细胞含有较多的线粒体,线粒体内膜含有大量的Na+-K+-ATP酶和Ca2+-ATP酶,以维持电位稳定,释放细胞正常生命活动所需要的能量。有报道称ADM对线粒体膜具有很强的亲和性,可能是通过还原性辅酶Ⅱ或内皮型一氧化氮合酶转化为半醌ADM,并进一步转化为C7自由基,破坏细胞膜或细胞器膜,从而导致心肌细胞的损伤[8-9]。本研究结果显示,ADM会引起心肌细胞氧化应激水平增高、心肌细胞线粒体膜电位和线粒体Na+-K+-ATP酶、Ca2+-ATP酶活性降低,表明ADM是通过改变膜电位、影响线粒体膜的稳定性损伤心肌细胞。
NF-κB作为一种核转录因子,与免疫和炎症相关。当机体受到损伤及ROS增多时,细胞内的NF-κB进入细胞核,与特异性位点结合,调控靶基因表达。NF-κB参与了ADM诱导心肌损伤的过程,能引起NF-κB p65蛋白表达增多[10-11]。因此NF-κB p65很有可能是ADM造成心肌损伤通路中的重要环节。本研究中检测了ADM组、Control组与ADM+CA组细胞中NF-κB p65的表达量,结果表明CA能够抑制ADM引发的NF-κB p65蛋白表达量增高过程,CA可能通过NF-κB p65通路发挥对心肌细胞的保护作用。然而本研究缺少对NF-κB 通路中其他蛋白表达水平的检测,尚未进一步深入阐明CA在NF-κB通路中的保护机制。
CA是一类天然酚类化合物,具有强抗氧化性。CA有多种药理作用,如抗菌、抗毒、抗炎、抗癌、抗动脉粥样硬化、抗HIV、抗氧化等[3]。研究[12-13]表明,CA对淋巴细胞、脑、肾、肝等组织的氧化损伤也有一定的保护作用。本研究中,CA治疗组中心肌细胞中ROS水平较ADM组显著降低,表明CA可能通过清除H9c2心肌细胞内ROS发挥了保护作用。此外,本研究显示,CA可以提高ADM诱导心肌损伤后线粒体Na+-K+-ATP酶和Ca2+-ATP酶的活性,能够稳定线粒体膜电位,这表明除清除ROS之外,CA还有可能通过保护线粒体膜稳定性发挥其保护作用。这与CA能降低心肌细胞线粒体脂质的浓度,保护线粒体,在异丙肾上腺素诱导心肌细胞梗死模型中发挥保护作用的机制相似[14]。
