白藜芦醇抑制PI3K/AKT通路诱导子宫内膜癌Ishikawa细胞自噬的作用研究
2022-03-31范懿隽史于传
范懿隽,史于传,李 君,董 振,詹 磊
子宫内膜癌是女性生殖道三大恶性肿瘤之一,约占全部生殖道恶性肿瘤的20%~30%,2018年全球新发病例有38万例左右[1]。不同地区的发病率不同,但均随着人口老龄化有逐步增加的趋势[2]。外科手术结合放化疗是目前最常见的子宫内膜癌临床治疗方法,铂类和紫杉醇联合治疗是一线化疗方案[3]。但是,子宫内膜癌尤其是晚期患者的诸多放化疗并发症以及不良预后严重困扰着临床医生,亟待寻找新的药物和改良治疗方法以提高患者的生存率。研究[4]发现,某些天然药物能够通过多种途径如介导AMKP磷酸化增强等来调控子宫内膜癌细胞自噬,细胞自噬的增强能够抑制癌细胞的生长并促进癌细胞凋亡。白藜芦醇是一种多酚,在葡萄和浆果等植物中自然产生。有研究[5]发现,白藜芦醇在人体可发挥多种功能,如抗炎、改善葡萄糖代谢和提高胰岛素敏感性等。它还具有心脏保护、神经保护、抗血栓和抗癌作用。目前对于白藜芦醇在子宫内膜癌中的作用研究较少,该研究拟通过观察其对于子宫内膜癌细胞自噬的调控作用,探讨白藜芦醇在子宫内膜癌治疗中的潜在价值。
1 材料与方法
1.1 主要试剂白藜芦醇购于美国Sigma公司,Beclin1、LC3B、PI3K、P-PI3K、AKT和P-AKT抗体购于美国Abcam公司,HRP标记的二抗购于美国Affinity公司,PVDF膜购于上海Biosharp公司,ECL购于美国Pierce公司、CCK-8试剂盒购于日本Dojindo公司,高糖DMEM培养基和胎牛血清购于美国Gibco公司,LC3 引物序列由南京金斯瑞生物科技有限公司合成,其它常规试剂购于武汉博士德生物工程有限公司或美国Sigma公司。
1.2 细胞培养与分组人子宫内膜癌Ishikawa细胞株(美国Sigma公司)由安徽医科大学第二附属医院实验室保存,将细胞培养于含10%胎牛血清、1% 青-链霉素的DMEM培养基中,细胞在含有5% CO2、37 ℃、饱和湿度的恒温培养箱中培养,每3天换液1次。细胞消化处理并种植于6孔板中,待其生长至70%~80%随机分为对照组、白藜芦醇组和白藜芦醇+PI3K激动剂(740Y-P)组,其中白藜芦醇浓度为100 μmol/L。继续培养24 h后进行相关检测。
1.3 白黎芦醇对Ishikawa细胞的增殖抑制作用本研究采用梯度浓度(0、25、50、100、200 μmol/L)的白藜芦醇分别处理Ishikawa细胞24、48、72 h,通过CCK-8实验检测白藜芦醇对Ishikawa细胞增殖能力的影响。具体步骤如下:将0、25、50、100、200 μmol/L白藜芦醇处理的Ishikawa细胞分别于24、48、72 h接种在96孔板中,每孔2×103个细胞,每组3个复孔,待细胞贴壁后每孔中加10 μl的CCK-8溶液,置于培养箱内继续孵育4 h,用酶标仪测定450 mm处吸光度值表示各组细胞的增殖情况,实验重复3次,以实验测得的均值为实验结果。
1.4 电镜观察自噬小体Ishikawa细胞接种于6孔板中,三组细胞处理后培养24 h,用细胞刮刀收集细胞样本,经过戊二醛锇酸固定、梯度乙醇丙酮脱水、浸透、包埋、高温聚合、修块、半薄切片、染色、定位、超薄切片和醋酸铀柠檬酸铅染色等过程,将细胞样本制作成为超薄切片,置于透射电子显微镜下,观察细胞内自噬体的变化并拍照记录。
1.5 Western blot法使用RIPA裂解液裂解细胞,提取细胞总蛋白,使用BCA法测定蛋白浓度,配置10%或15%的10孔胶,每孔加入10 μl的样,电泳、转膜、5%的脱脂奶粉封闭,然后TBST洗膜3次,每次10 min。按说明书孵一抗过夜,TBST洗膜3次,每次10 min,按说明书孵二抗1 h,TBST清洗3次,每次10 min,ECL发光,显影,以GAPDH为内参,观测各蛋白的相对表达量。
1.6 qRT-PCR法收集加药培养后的细胞,按照说明书使用TRIzol试剂提取细胞总RNA,测定RNA 浓度,再利用提取RNA逆转录成cDNA。使用SYBR Green试剂盒开始qRT-PCR,每组样本重复3次。GADPH 引物序列上游引物:5′-GGTTGAGCAGGTACTTT-3′,下游引物:5′-AGCAAGAGCACAAGAGGAAG-3′;Beclin1 引物序列上游引物:5′-AGCACCATGCAGGTGAGCTT-3′,下游引物:5′-TGACACGGTCCAGGATCTTG-3′;LC3 引物序列上游引物:5′-AGCAGCATCCAACCAAAATC-3′,下游引物:5′-CTGTGTCCGTTCACCAACAG-3′。
1.7 免疫荧光Ishikawa细胞接种于6孔板中,三组细胞处理后培养24 h,然后开始细胞爬片,接着使用丙酮固定,固定后用PBS洗涤2次,每次10 min,山羊血清封闭,滴加抗LC3抗体过夜孵育,PBS清洗后滴加荧光二抗,使用抗荧光淬灭剂固封,最后在激光共聚显微镜下摄片。
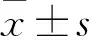
2 结果
2.1 白黎芦醇抑制Ishikawa细胞增殖在50 μmol/L浓度的白藜芦醇培养下,Ishikawa细胞的增殖能力与对照组相比下降(P<0.01);100 μmol/L和200 μmol/L白藜芦醇作用下的Ishikawa细胞增殖能力与同一时段50 μmol/L组比较,差异有统计学意义(P<0.05),但100 μmol/L和200 μmol/L白藜芦醇对细胞的抑制作用比较差异无统计学意义(P>0.05);表明培养基中添加白藜芦醇对Ishikawa细胞的增殖有抑制作用,并且在浓度为100 μmol/L培养24 h抑制率最高,经计算白藜芦醇的半数抑制浓度(the half maximal inhibitory concentration,IC50)为94.35 μmol/L,因此,本研究采用100 μmol/L的浓度培养细胞24 h用于后续实验。见图1。
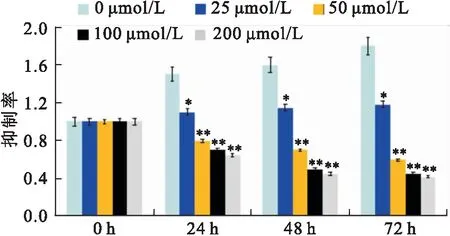
图1 Ishikawa细胞白藜芦醇作用敏感性检测
2.2 白藜芦醇处理可引起Ishikawa细胞自噬白藜芦醇组细胞超微结构可见细胞核皱缩,胞质可见自噬小体,小体内包裹即将被降解的细胞器,而对照组未见细胞核皱缩和自噬小体。见图2。
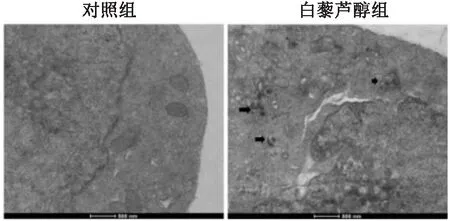
图2 Ishikawa细胞超微结构 ×13 500
2.3 白藜芦醇上调自噬相关蛋白Beclin1和LC3 mRNA水平与对照组比较,白藜芦醇组Ishikawa细胞Beclin1(t=2.533,P<0.05)和LC3 mRNA水平升高(t=9.131,P<0.01)。见图3。

图3 两组Beclin1与LC3 mRNA水平比较
2.4 白藜芦醇上调自噬相关蛋白Beclin1和LC3-Ⅱ蛋白水平Wester blot检测发现,与对照组比较,白藜芦醇组Ishikawa细胞Beclin1(t=6.258,P=0.003)和LC3-Ⅱ(t=7.489,P=0.002)蛋白水平也升高,见图4。采用免疫荧光法检测Ishikawa细胞LC3蛋白荧光强度,结果发现,白藜芦醇组Ishikawa细胞质LC3蛋白红色荧光强度强于对照组,见图5。
图4 两组Beclin1与LC3-Ⅱ蛋白水平比较
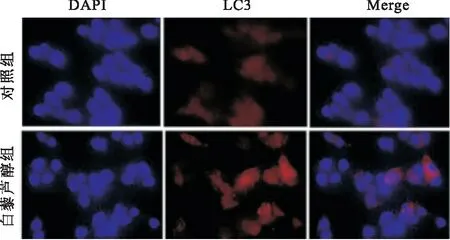
图5 两组LC3-Ⅱ蛋白表达比较 ×400
2.5 白藜芦醇下调P-PI3K和P-AKT蛋白水平Wester blot检测发现,白藜芦醇组Ishikawa细胞P-PI3K(t=3.937,P=0.017)和P-AKT(t=3.502,P=0.025)蛋白水平低于对照组。见图6。
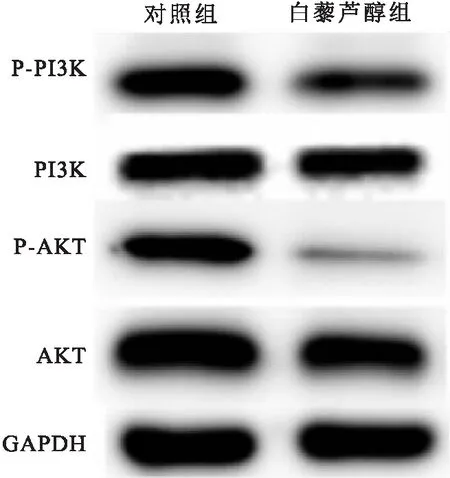
图6 两组PI3K、P-PI3K、AKT和P-AKT 蛋白水平比较
2.6 740Y-P抑制白藜芦醇诱导的自噬与白藜芦醇组比较,白藜芦醇+740Y-P组Ishikawa细胞Beclin1(t=8.439,P<0.001)和LC3 mRNA水平降低(t=7.860,P<0.01),见图7。进一步的检测发现,白藜芦醇+740Y-P组Ishikawa细胞Beclin1(t=6.817,P=0.002)和LC3-Ⅱ(t=7.846,P<0.01)蛋白水平也低于白藜芦醇组,见图8。白藜芦醇组细胞超微结构可见细胞核皱缩,胞质可见自噬小体,小

图7 三组Beclin1与LC3 mRNA水平比较
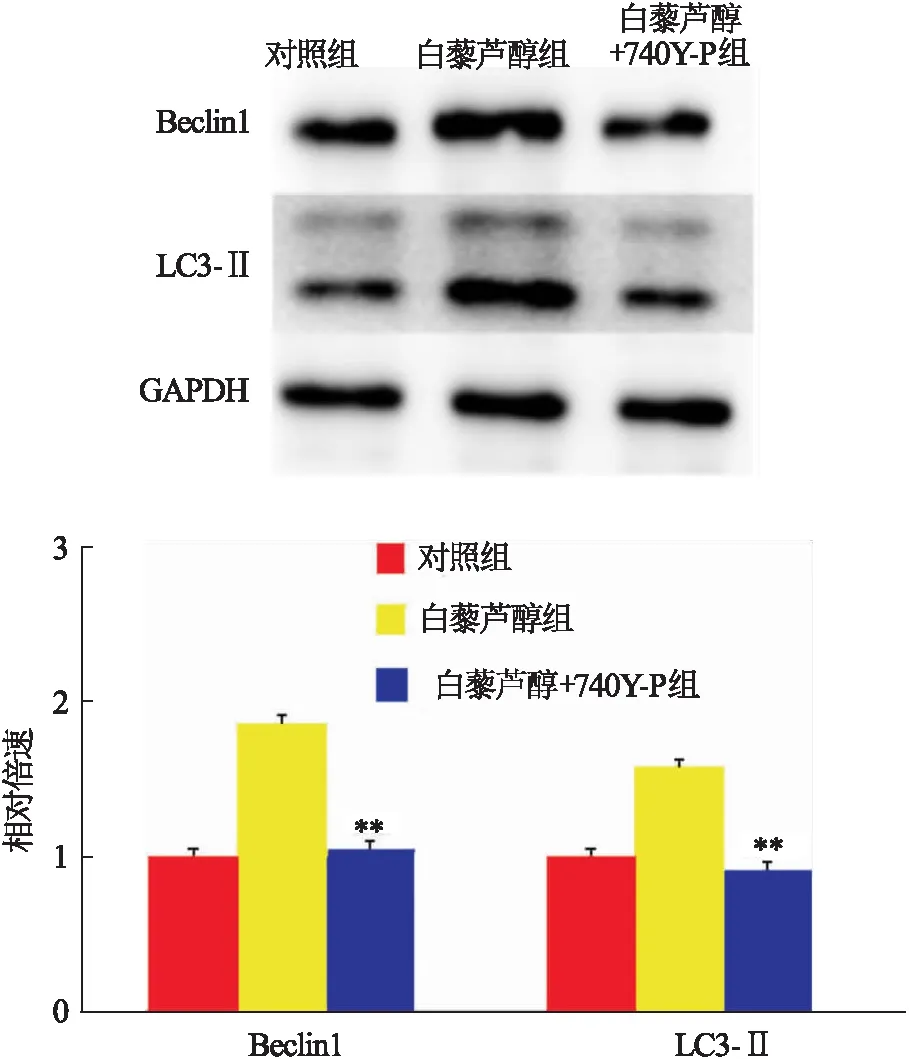
图8 三组Beclin1与LC3-Ⅱ蛋白水平比较
体内包裹即将被降解的细胞器,而白藜芦醇+740Y-P组未见细胞核皱缩和自噬小体,见图9。采用免疫荧光法检测Ishikawa细胞LC3蛋白荧光强度,结果发现,白藜芦醇组Ishikawa细胞质LC3蛋白红色荧光强度强于白藜芦醇+740Y-P组,见图10。

图9 Ishikawa细胞超微结构 ×13 500
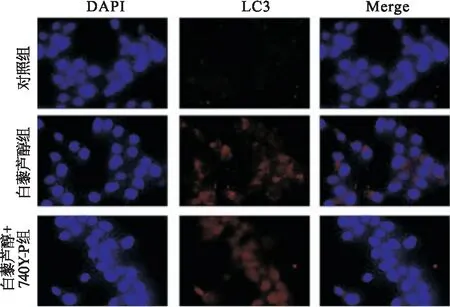
图10 三组LC3-Ⅱ荧光水平比较 ×400
3 讨论
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,肥胖、糖尿病、多囊卵巢综合征、不孕、初潮年龄早和绝经年龄晚是潜在的危险因素。子宫内膜癌的主要发病人群是围绝经期和绝经后妇女[5]。因子宫内膜癌筛查方法的局限性及部分患者症状易与围绝经期异常子宫出血相混淆,未及时就诊导致在中晚期才被发现,传统的外科手术结合放化疗并不能满足晚期患者治疗的需要[1]。天然分子在癌症化学疗法中越来越受到关注,因其与靶位点的结合作用更强,对正常细胞的毒性更小[6]。
自噬是一种保护性的分解代谢过程,通过回收细胞器和大分子来维持细胞环境的稳态[7]。在这个过程中,有缺陷或老化的细胞器和其他细胞质成分被包裹在双囊泡内形成自噬体。自噬体与溶酶体融合,囊泡内容物被溶酶体酶降解为氨基酸、脂类和碳水化合物。降解产物被重新利用产生新的蛋白质和细胞器[8]。Beclin1是一种自噬形成过程中的信号蛋白,通过与第三类磷酸肌醇3激酶复合物的相互作用,在自噬体前体形成的过程中,发挥着巨大的作用[9]。LC3通常有LC3-Ⅰ和 LC3-Ⅱ两种形式,可溶性的LC3-Ⅰ通过转化形式LC3-Ⅱ来参与自噬囊泡转运相关的过程[10]。研究[11]表明,自噬在各种疾病的病理过程中发挥重要作用,包括神经退行性疾病、心血管疾病、肿瘤、感染和免疫缺陷等。因此,将自噬作为治疗靶点在多种疾病中具有潜在意义。重要的是,已有研究[12]表明自噬对子宫内膜癌细胞的生长有抑制作用。因此,寻找促进自噬水平的方法将有利于子宫内膜癌治疗。
作为一种抗毒素多酚,白藜芦醇能够参与多种生理和病理过程,有研究[13]表明白藜芦醇可以抑制白血病的发生和发展,更重要的是,在有效的抗癌剂量下,白藜芦醇对体内外正常组织的细胞毒性作用很小,这反映了白藜芦醇在癌症治疗中的潜在价值。然而白藜芦醇对子宫内膜癌是否有治疗作用尚不明确。本研究发现,白藜芦醇可降低Ishikawa细胞的增殖速度,随着白藜芦醇浓度的增加和其作用时间的延长,其对细胞生长抑制作用也逐渐增加,说明白藜芦醇对子宫内膜癌细胞具有杀伤效应,且其作用呈现浓度与时间依赖性。通过进一步研究发现,白藜芦醇组与对照组比较,细胞中自噬相关蛋白和其RNA 水平增加;通过细胞免疫荧光检测,白藜芦醇作用于Ishikawa细胞后,细胞核内的LC3蓝色荧光未见区别,而细胞质LC3红色荧光强度增强,提示自噬可能参与了白藜芦醇的抗肿瘤作用,作用靶点主要位于细胞质。然而白藜芦醇调控自噬的机制未明。有研究[14]表明,白藜芦醇能够通过PI3K/AKT信号通路对细胞的增殖迁移等活动进行调控。PI3K/AKT信号通路作为调控细胞生长的主要通路,其上调和下调对细胞的增殖等方面有着重要的意义。而且,PI3K/AKT信号通路的激活也会抑制自噬的发生[15-16]。因此,猜测在子宫内膜癌中白藜芦醇可能通过影响PI3K/AKT通路的激活调控自噬的水平进而发挥抗肿瘤作用。通过加入白藜芦醇的实验组与对照组比较,白藜芦醇作用于Ishikawa细胞后,细胞中P-PI3K和P-AKT蛋白水平下降,提示白藜芦醇可以抑制PI3K/AKT信号通路的激活。联合使用PI3K激动剂(740Y-P)后发现,740Y-P能够降低白藜芦醇诱导的自噬作用,通过Western Blot 、qRT-PCR、免疫荧光和电镜等实验方法对其进行了验证。这说明白藜芦醇可以通过抑制PI3K/AKT通路的激活来诱导Ishikawa细胞的自噬,进而抑制子宫内膜癌细胞的增殖。
综上所述,本研究证实白藜芦醇通过抑制PI3K/AKT信号通路,促进子宫内膜癌细胞发生自噬,从而导致增殖抑制,给子宫内膜癌治疗提供了新的思路,未来可能成为子宫内膜癌辅助治疗的新药物。
