骨髓间充质干细胞在缺血性脑卒中的治疗作用
2022-03-31付丽环江小霞毛更生
付丽环,江小霞,毛更生
脑卒中是全球第二大死亡原因,也是导致成人残疾的主要原因之一,随着老龄化到来,其发病率目前仍在增加[1-2],其中缺血性脑卒中约占所有脑卒中的85%以上[3]。组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)是目前治疗缺血性脑卒中的有效药物之一[4],但缺血性脑卒中发作后脑细胞的快速损伤和死亡使得t-PA必须在发生缺血性脑卒中后4.5 h内使用,所以绝大多数患者得不到t-PA的及时救治[5]。目前这种局限性无法改变,所以关于缺血性脑卒中的研究策略已转向神经修复疗法,尤其强调各种干细胞的再生治疗。在各种类型的候选干细胞中,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是修复缺血性脑卒中的一种很有前途的干细胞类型,移植BMSCs可直接或间接修复局灶性缺血区,促进神经功能改善[6-7]。但BMSCs治疗缺血性脑卒中的机制目前还未完全明朗,亟需进一步研究。
1 材料与方法
1.1 材料
1.1.1实验动物 健康雄性SD大鼠,SPF级,10只体质量100~120 g和105只体质量250~280 g ,从北京斯贝福公司购买,许可证号为scxk(京)2019-0010 。动物饲养在标准条件下(约24 ℃温度和48% 湿度),术前12 h禁食不禁水。
1.1.2试剂与仪器 含EDTA的0.25%胰酶和α-MEM培养基购自美国Gibco公司;胎牛血清(Fetal Bovine Serum,FBS)购自澳大利亚Bovogen公司;FITC-CD90、PE-CD29、PE-CD45抗大鼠流式抗体购自美国Biolegend公司;抗微管相关蛋白-2(microtubule associated protein-2,MAP-2)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、生长相关蛋白-43(growth associated protein-43,GAP-43)和Caspase-3抗体均购自英国Abcam公司。日本NiKon倒置荧光显微镜;美国Bio-Rad ChemiDocTM成像系统 、美国Invitrogen半干式快速转印系统、BD流式细胞仪。
1.2 实验方法
1.2.1BMSCs的分离与鉴定 选取体质量100~120 g的SD大鼠,用颈椎脱臼法处死后立即用75%乙醇浸泡10 min,分离出完整的股骨和胫骨,PBS溶液冲洗后,再浸入完全培养基(10% FBS、α-MEM培养基、青-链霉素)中,剪去两端的干骺端,用无菌注射器吸取培养基反复冲洗骨髓腔,直到骨髓腔变白。离心、弃掉上清液,用完全培养基以106/ml的细胞浓度接种于培养瓶中,置37 ℃、5% CO2恒温培养箱中静置培养。3 d后半换液,5 d后全换液,每隔2 d换一次液。当细胞生长达到90%融合时即可传代,传至第3代用于后续实验。
1.2.2流式细胞仪鉴定BMSCs 选择生长达90%的P3代BMSCs,用PBS制成细胞浓度为1×107/ml的单细胞悬液。从细胞悬液中分别吸取100 μl至4支无菌EP管中,分别加入FITC-CD90、PE-CD29、PE-CD45流式抗体和PBS各1 μl,各管混匀后在冰上避光孵育30 min;用PBS重悬,混匀后避光置于冰上,用流式细胞仪进行检测。
1.2.3大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型的建立 改良的Zea Longa线栓法建立MCAO模型:大鼠腹腔麻醉,切开颈动脉中线,显露左侧的颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA),剥离动脉鞘,仔细分离CCA、ICA与迷走神经;用动脉夹短暂阻断CCA和ICA,并结扎ECA远端,在ECA近端留一活结,在两线之间的血管上做一切口,将线栓插进ECA中后进入CCA,剪断ECA上的切口,轻轻地将ECA残端拉与ICA相平行,顺势插入ICA中,当达到栓线标记点时,固定住线栓。缺血2 h后拔除线栓,缝合伤口。术中保持大鼠肛温恒定在37 ℃左右。假手术组不插入线栓,其余操作与模型组相同。
1.2.4动物分组与移植程序 5分制法:0分:无神经损伤症状;1分:不能完全伸展对侧前爪 ;2分:向对侧转圈 ;3分:向对侧倾倒 ;4分:不能自发行走,意识丧失。再灌注24 h后进行评分,将评分为2~3分的大鼠纳入接下来的实验。动物分为假手术组(尾静脉注射PBS 1 ml)、MCAO组(尾静脉注射PBS 1 ml)、BMSC组(尾静脉注射含3×106个BMSCs的PBS 1 ml),每组又分别在移植后的第3、7和14天进行神经功能评分和取材。所有注射均在MCAO模型构建术后24 h后进行,尾静脉缓慢注射。
1.2.5神经功能评分 采用mNSS评分法对移植后第3、7和14天的三组动物的运动、感觉、平衡和反射功能进行评分,如果得分的分值越高则说明神经功能的损伤情况越严重。
1.2.6TTC染色 麻醉后,取出完整脑组织,将脑组织按照2 mm厚切出6片冠状切片,将切片浸泡在2% TTC溶液中,置于37 ℃孵箱中避光孵育20 min,切片需定期翻转,以确保每片脑组织均匀暴露在染色溶液中,染色后将切片用4%多聚甲醛固定24 h,拍照。用ImageJ软件计算梗死体积。梗死体积百分率(%)=(正常侧脑组织体积-梗死侧正常脑组织体积)/正常侧脑组织体积×100%。
1.2.7免疫组织化学染色 心脏灌注取脑后,进行固定和脱水后将其进行包埋,制备出脑组织厚度为8 μm的冰冻切片。先后用1%Triton X-100和3%过氧化氢溶液处理脑片,再用血清封闭液封闭30 min,甩干;将切片在4 ℃下与GFAP抗体(兔抗,1 ∶800)孵育过夜,PBS洗涤后滴加二抗孵育1 h,PBS洗涤后用DAB显色剂孵育5 min,水洗;苏木精复染、脱水、透明,最后用中性树脂封片;光学显微镜下观察各组脑组织梗死区及周围的GFAP。
1.2.8免疫荧光染色 用1%Triton X-100、3%过氧化氢溶液和血清封闭液处理切片,再将切片在 4 ℃ 下分别与GFAP抗体(兔抗,1 ∶800)、MAP-2抗体(兔抗,1 ∶800)、Caspase-3(兔抗,1 ∶500)和GAP-43(兔抗,1 ∶800)孵育过夜,用PBS洗涤后分别选择FITC-山羊抗兔IgG和Cy3-山羊抗兔IgG避光孵育1 h,洗涤后用内含DAPI的封片液进行封片,用显微镜观察阳性细胞的表达。
1.2.9Western blot 试验 取缺血区脑组织50 mg,匀浆在500 μl含蛋白酶抑制剂的蛋白提取液中,冰上研磨后孵育30 min,离心取上清液进行蛋白定量检测。制备聚丙烯酰胺凝胶,进行电泳和PVDF转膜,转膜完成后,用5%脱脂牛奶封闭1 h,再分别将膜置于一抗(GFAP、MAP-2、GAP-43、Caspase-3和GADPH)中,4 ℃孵育过夜,TBST洗膜,室温孵育二抗1 h。再次洗膜后显影。
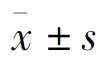
2 结果
2.1 BMSCs培养过程中的细胞形态的变化BMSCs原代培养在第3天半换液后,可见有大量的红细胞和其他造血细胞漂浮在培养基中,隐约可见部分BMSCs贴壁生长(图1A)。在第5天全换液后,可见大量细胞集落式贴壁生长,以梭形细胞为主,呈放射状排列,伸出长短不一、粗细不均的突起(图1B)。在第7~8天左右,BMSCs不断增殖分化,细胞逐渐融合(图1C);在第10~12天左右,细胞排列紧密,呈现旋涡式生长,达90%以上的融合度,达到传代标准(图1D)。
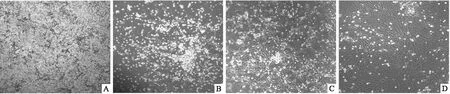
图1 大鼠BMSCs原代细胞的生长情况 ×100
2.2 流式检测BMSCs 表面标记物流式细胞仪检测第3代大鼠BMSCs结果显示,它们高表达CD29(+)、CD90 (+),低表达CD45(-)。见图2。
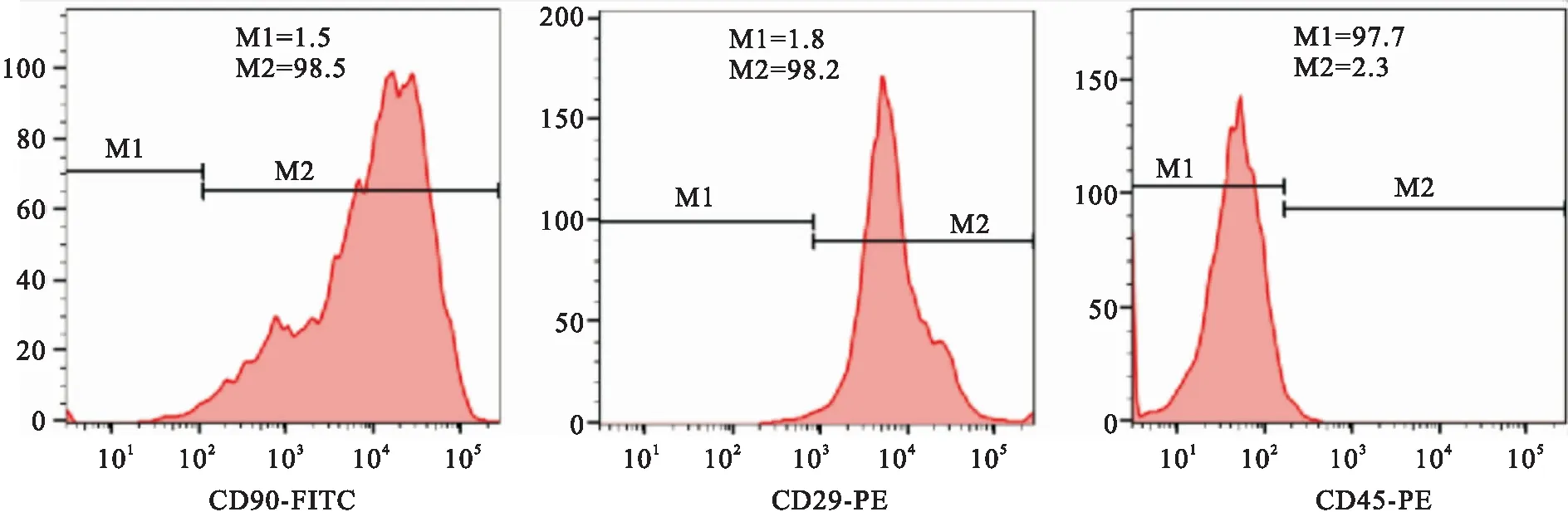
图2 P3代BMSCs的表面抗原鉴定
2.3 大鼠神经功能评分移植前和移植后第3、7和14天的mNSS评分,假手术组均为0分,BMSC组[(13.0±0.7)、(9.8±0.8)、(8.0±0.7)、(5.2±0.5)分]与MCAO组[(13.4±0.6)、(12.2±0.8)、(10.0±0.7)、(8.2±0.8)分]比较,移植前分数最高且差异无统计学意义,而移植后均降低(F=77.65,P<0.01),MCAO组和BMSC组移植后的mNSS评分与移植前比较,分值均下降,且随着移植时间的延长,mNSS评分逐渐降低,说明神经功能恢复越好。见图3。
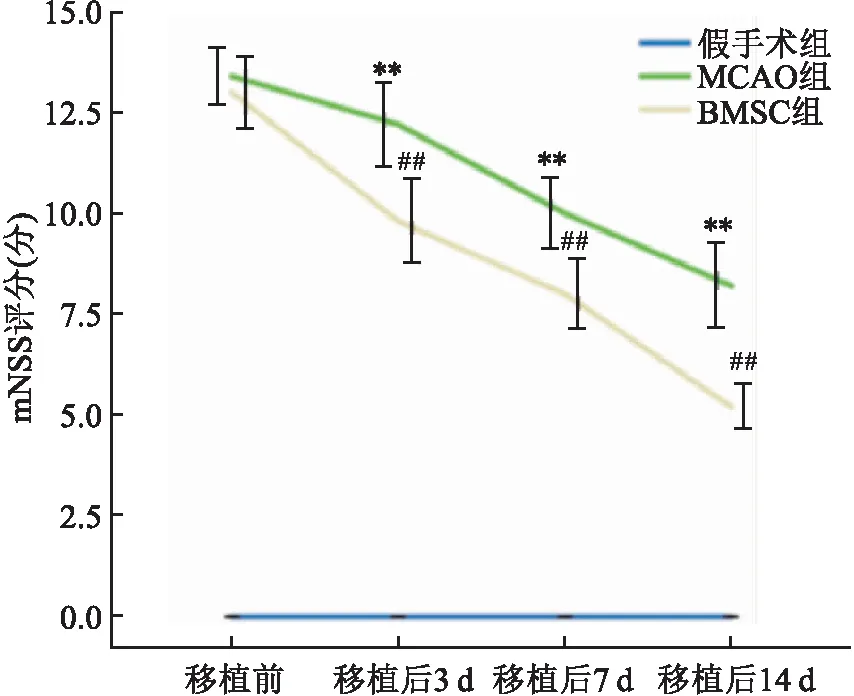
图3 各组大鼠的mNSS评分
2.4 大鼠的脑梗死体积采用TTC染液对脑组织进行染色,肉眼观假手术组整个脑组织未显现出苍白区,MCAO组脑组织可见梗死侧大面积出现白色,BMSC组较少局部可见白色(图4A),白色即梗死区域。MCAO组移植后第3、7和14天的大鼠脑组织梗死体积百分比分别为(44.9±1.2)%、(38.5±0.7)%、(28.2±0.8)%,与假手术组比较显著增高(P<0.01),而BMSC组移植后第3、7和14天的大鼠脑组织梗死体积百分比分别为(42.0±0.8)%、(33.4±0.9)%、(19.5±0.6)%,较MCAO组降低(F=623.79,P<0.01),且随着移植时间的延长,梗死体积逐渐缩小(图4B)。

图4 各组大鼠的TTC染色和梗死体积百分比
2.5 免疫组化染色检测GFAP的表达各组移植后第7天脑组织的GFAP免疫组化染色结果见图5。GFAP组化学染色呈现放射状的形态(图5D),在假手术组大鼠皮层区脑组织中GFAP阳性细胞数为(2.0±0.7)个,MCAO组为(6.0±1.0)个,BMSC组为(13.2±0.8)个,与MCAO组比较,BMSC组缺血区的GFAP阳性细胞增多,差异有统计学意义(F=219.64,P<0.01,图5E)。
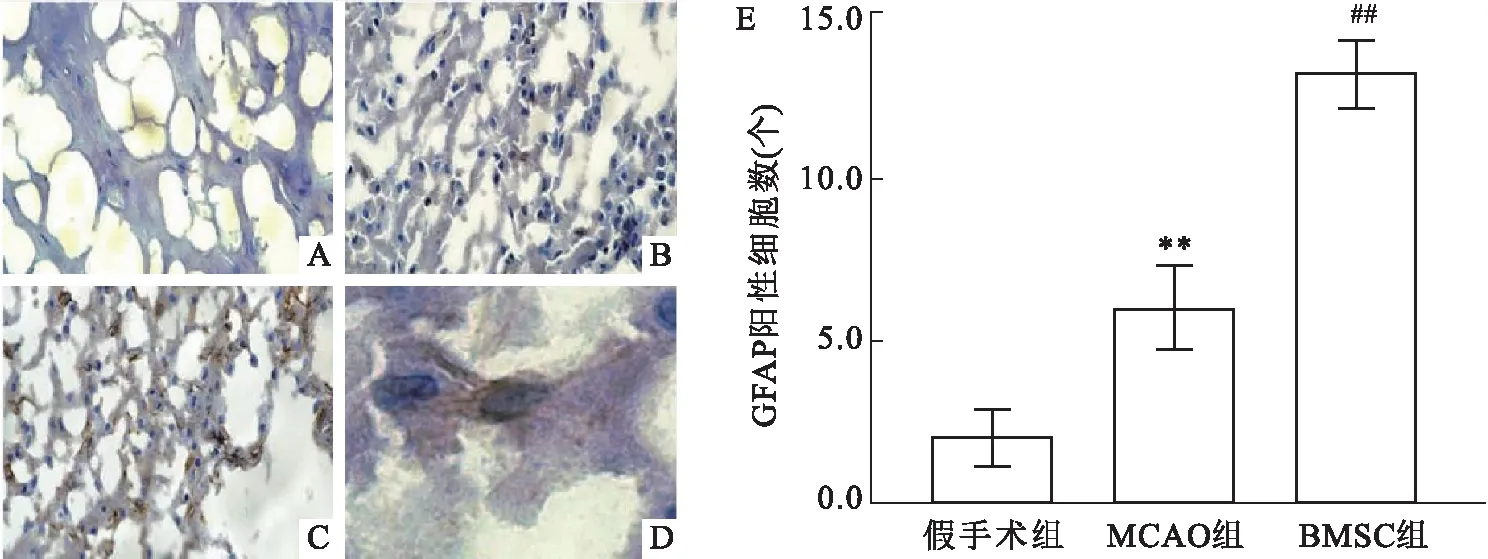
图5 各组移植后第7天脑组织的GFAP免疫组化染色
2.6 GFAP、MAP-2、Caspase-3和GAP-43的荧光表达三组大鼠移植后第7天的脑组织切片,用GFAP、MAP-2、Caspase-3、GAP-43分别与DAPI共染,结果发现:① GFAP阳性细胞呈现星型状,关于大鼠脑组织缺血及周围区的GFAP阳性细胞数,假手术组中为(9.6±1.1)个,MCAO组为(24.0±1.6)个,BMSC组为(27.4±2.2)个,MCAO组高于假手术组,BMSC组高于MCAO组(F=155.74,P<0.01,图6);② MAP-2阳性细胞在MCAO组[(9.2±0.8)个]低于假手术组[(22.8±1.6)个],BMSC组[(18.8±1.3)个]与MCAO组相比较,表达上调(F=143.69,P<0.01,图7);③ Caspase-3阳性细胞在假手术组、MCAO组、BMSC组的表达分别为(3.4±1.1)、(27.4±2.1)和(7.2±1.9)个,在假手术组中少见,在MCAO组中增多,BMSC组中其表达低于MCAO组,且差异有统计学意义(F=268.41,P<0.01,图8);④ GAP-43阳性细胞在MCAO组[(33.8±1.3)个]中多于假手术组[(24.4±1.1)个],而BMSC组[(44.4±1.1)个]中其表达上调,且差异有统计学意义(F=349.26,P<0.01,图9)。

图6 三组大鼠移植后第7天脑组织的GFAP免疫荧光染色

图7 三组大鼠移植后第7天脑组织的MAP-2免疫荧光染色

图8 三组大鼠移植后第7天脑组织的Caspase-3免疫荧光染色

图9 三组大鼠移植后第7天脑组织的GAP-43免疫荧光染色
2.7 Western blot检测Caspase-3、GAP-43、GFAP和MAP-2蛋白的表达Western blot结果分析:① 与假手术组比较,MCAO组脑组织高表达Caspase-3,而BMSC组在移植第7天和第14天时Caspase-3表达比MCAO组同时段下调,且差异有统计学意义(F=249.05,P<0.05),而第3天未出现下调(图10A、B);② 与假手术组比较,MCAO组GAP-43的表达上调,BMSC组较MCAO组也增高,差异有统计学意义(F=158.07,P<0.05),在移植BMSCs后的第7天表达最高(图10A、C);③ 与假手术组比较,MCAO组GFAP的表达增强,BMSC组较MCAO组也增强,差异有统计学意义(F=474.84,P<0.05,图10A、D);④ 与假手术组比较,MCAO组MAP-2表达降低,而BMSC组脑组织在移植后第3、7和14天表达均出现上调趋势,差异均有统计学意义(F=160.25,P<0.05,图10A、E)。
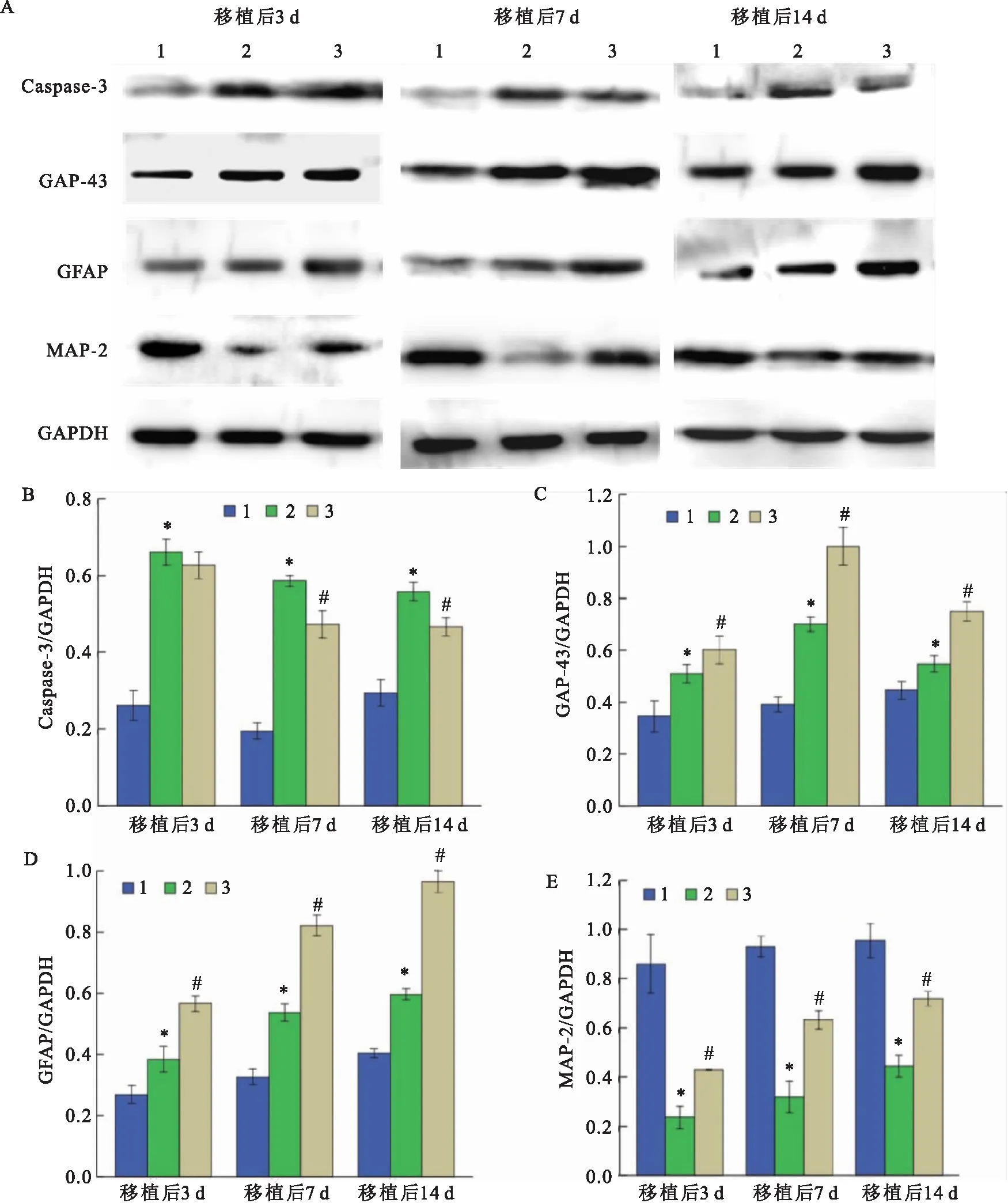
图10 Caspase-3、GAP-43、GFAP和MAP-2在三组脑组织中不同时间点的表达
3 讨论
BMSCs普遍高表达CD29和CD90,低表达造血干细胞标记物CD45,这与大鼠骨髓间充质干细胞的细胞表面标志物图谱相一致[8]。BMSCs有在非造血组织中自我更新的能力,也具有向各种组织分化的多能性,即分化为脂肪细胞、软骨细胞和骨细胞等中胚层细胞,除了中胚层系外,BMSCs还被证明了向神经细胞等神经外胚层谱系和肝细胞、胰腺细胞等内胚层谱系的转分化潜能,正是这种独特的分化为靶细胞的能力,突出了BMSCs在再生医学背景下的重要性。
本研究过程中发现BMSC组的大鼠的mNSS评分和脑梗死面积均低于MCAO组,说明BMSCs对脑梗死带来的神经功能损害有一定的治疗作用。另外发现梗死过程中可能存在一定的自我修复作用,因为随着时间的延长,脑卒中大鼠的神经功能得到了改善。MAP-2存在神经元的胞体和树突中,它对于脑缺血的反应比较敏感[9]。在本研究中,脑缺血时MAP-2表达减少,BMSCs移植后使其表达增强,这说明神经元系统的生长与修复的过程中,BMSCs可以通过增强MAP-2对缺血性脑卒中进行神经修复。星形胶质细胞一种标志性的特征就是GFAP蛋白,GFAP能够有效的参与到细胞骨架形成的过程中,并能够平衡张力[10]。脑缺血会使得星形胶质细胞的表达情况增强,并出现细胞增生的情况[11]。本研究中GFAP呈现星型或放射状,在脑缺血时高表达,且出现在缺血区周围,可能是在GFAP在脑缺血时反应性增多,参与自我修复过程。GAP-43是一种神经特异性的蛋白质,它维持突触稳定性和促进轴突再生的启动[12]。脑缺血时GAP-43表达增加,在缺血早期它处于病变的中心,随后在半影区表达,这表明GAP-43在组织的拯救和再生中起着早期的作用[13],而BMSCs移植后其表达上调,说明BMSCs有可能是通过调节GAP-43来修复缺血组织的。Caspase-3的激活在神经元凋亡中起着极其重要的作用,是一种促凋亡蛋白[14]。MCAO大鼠患侧梗死区脑组织大面积组织溶解和细胞坏死,呈现缺血区的凋亡趋势,MCAO大鼠Caspase-3表达较假手术组上调,荧光染色可见Caspase-3阳性细胞数增多,这些均说明缺血性脑卒中梗死区出现神经细胞的凋亡,而BMSC组的梗死区Caspase-3阳性细胞数减少,说明BMSCs移植具有抑制神经细胞凋亡的作用。
综上所述,BMSCs治疗缺血性脑卒中有成效,表现在梗死面积减小、神经行为改善、凋亡细胞受到抑制、局部轴突再生和神经胶质细胞增生等。本研究仅为临床上治疗缺血性脑卒中提供了理论依据,要想完全阐明其神经修复机制,还需进一步研究。
