LC-MS定量研究白桦脂酸的体外细胞摄取与转运
2022-03-30王美慧帅丽霞徐超群
陈 旺, 王美慧, 帅丽霞, 詹 雁, 谭 镭, 阮 佳, 徐超群
(1. 四川省中医药科学院,四川 成都 610041; 2. 成都中医药大学药学院,四川 成都 611137)
0 引 言
白桦脂酸 (betulinic acid,BA)是广泛存在于自然界的一种五环三萜类有机酸,研究发现马甲子[1-2]、酸枣仁[3-4]、白桦树[5-6]等多种植物中存在BA。BA具有广泛的抗肿瘤活性,对黑素瘤[7]、脑胶质瘤[8]、胃癌[9]、肺癌[10]、肝癌[11]等多种肿瘤细胞具有较高的细胞毒性,是对正常细胞毒性的5~7倍[12],尤其对黑素瘤细胞有选择杀伤作用而不杀伤健康细胞。此外,BA在抗炎[13]、抗菌[14]等方面均表现出良好的活性。但其水溶性差[15],口服生物利用低[16],这不仅限制了BA在临床的应用,对于其含量测定方法要求更高。目前,测定BA的常用方法是高效液相色谱法(HPLC)[17-19],但是HPLC灵敏度较低,无法满足生物样品中BA的微量检测。Caco-2细胞系来源于人结肠腺癌细胞,可在培养过程中自发形成具有与小肠上皮细胞相似的微绒毛和紧密连接的单细胞层,Caco-2细胞不仅在形态、生化特征与人小肠相似,还具有相似的转运体、代谢酶以及渗透特性[20],研究BA在Caco-2细胞的吸收和转运机理有助于揭示BA在肠吸收机制。本文采用液相色谱-质谱联用(LC-MS)技术,首次建立了BA在细胞中的含量测定方法,并对其方法学进行考察;通过细胞培养技术建立Caco-2细胞模型,并通过细胞形态特征、跨膜电阻值等指标筛选出可用模型,分别用于摄取和转运实验,测定细胞中BA含量,研究其摄取和转运特性,并考察转运体抑制剂维拉帕米和丙磺舒对其转运和摄取的影响。本实验首次建立了细胞样品中BA含量的LC-MS分析方法,能准确在细胞水平测定BA含量,可为其在Caco-2细胞的吸收和转运研究提供可靠分析方法。
1 材料与仪器
1.1 药品与试剂
BA(纯度≥98%,成都普瑞法科技开发有限公司,PRF10122722);BA对照品(中国食品药品检定研究院,111802-201703);齐墩果酸(中国药物生物制品检定所,110709-200304);甲醇(色谱纯,Fisher);其他试剂为分析醇,纯净水为怡宝纯净水。
1.2 仪器
1290高效液相色谱仪(Agilent,USA);6460 Triple Quad LC/MS( Agilent, USA) ; AC2-4S1 AirsteamII级 A2型生物安全柜(ESCO,Singapore);CO2培养箱(ESCO,Singapore);S40-SLIDER倒置光学显微镜(Leica Portugal,Germany);Varioskan LUX 酶标仪(Thermo Scientific,USA);L2-6K 台式低速离心机(湖南可成仪器设备有限公司,中国);细胞计数仪(Invitrogen);MERS00002细胞电阻仪(Millicell,USA);XS205 DualRange型分析天平(Mettler Toledo公司,瑞士);真空干燥箱(上海齐欣科学仪器有限公司,中国);3K15低温高速离心机(Sigma,Germany);T25细胞培养瓶(NEST);96孔板(NEST);细胞小室 Transwell培养板(Corning Inc,USA,12孔聚碳酸酯膜,孔径 0.4 μm)。
2 方 法
2.1 细胞转运
将Caco-2细胞接种于Transwell板中,按照常规培养条件和方法[21]培养20~22 d,测定计算其跨膜电阻值(TEER)以检测细胞膜的完整性,取TEER值大于450 Ω·cm2的孔,按跨膜转运实验要求[21]处理后进行药物跨膜转运实验,于实验后测定计算各孔TEER值,舍弃TEER值小于450 Ω·cm2的孔。
2.2 细胞摄取
取生长至对数期的Caco-2细胞,按摄取培养要求[22]处理后进行细胞摄取实验,以考马斯亮蓝法定量样品中蛋白含量,LC-MS定量样品中BA含量,结果以每毫克蛋白质药物摄取量(μg/mg)表示。
2.3 色谱质谱条件
色谱柱Agilent SB-C18(2.1 mm×50 mm,1.8 μm),柱温 35 ℃,流动相 0.1% 甲酸水-甲醇(22∶78,v/v),流量0.3 mL/min,进样量1 μL;检测模式:电喷雾离子化(ESI),采用选择性负离子检测方式,检测离子为 BA和齐墩果酸(m/z均为455.4),喷雾压力:40 psi(1 psi=6.895 kPa),干燥器流量:10 L/min,干燥器温度:350 ℃,检测电压:4 000 V。切入时间6 min,切出时间12 min。
2.4 溶液的制备
2.4.1 对照品和内标溶液制备
称取BA对照品8.40 mg,置于100 mL容量瓶中,甲醇溶解并定容,配成质量浓度84 μg/mL的BA储备液,-20 ℃储藏备用。使用时稀释成适当浓度的对照品工作液。称取齐墩果酸对照品9.60 mg,置于100 mL容量瓶中,甲醇溶解并定容,配成质量浓度96 μg/mL的齐墩果酸储备液,-20 ℃储藏备用。使用时稀释成终浓度为9.6 μg/mL的内标工作液。
2.4.2 空白细胞液制备
分别用HBSS缓冲液(含3%的泊洛沙姆188)和双蒸水孵育Caco-2细胞2 h即得。
2.4.3 对照与质控样品制备
取BA储备液,用甲醇稀释配制成质量浓度为8.4,16.8,33.6,84,168,252,504,840 ng/mL 系列溶液,取上述稀释溶液200 μL,50 ℃氮气吹干后再分别加入等体积的空白细胞液,混匀得对照品溶液,另取33.6,168,504 ng/mL BA溶液同法操作制得质控样品。
2.4.4 样品前处理方法
取200 μL细胞悬液样品于10 mL的离心管中,先加入 5 μL 内标的齐墩果酸(9.6 μg/mL),混匀后加入2 mL乙酸乙酯,涡旋15 min,8 000 r/min离心10 min,取上清液50 ℃氮气吹干,残渣加入200 μL甲醇溶液复溶,涡旋5 min,13 000 r/min冷冻离心10 min,取上清液进样,LC-MS测定。
2.5 统计学分析
本实验数据统计分析采用SPSS 21. 0,绘制作图采用GraphPad Prism 7.0统计软件,数据结果以平均值±标准差() 表示。用单因素方差分析比较多组之间的差异,*P<0.05为有统计学差异,**P<0.01为具有显著性差异。
3 结 果
3.1 方法学考察
3.1.1 专属性
取细胞摄取阴性溶液、细胞摄取供试品溶液、细胞转运阴性溶液、细胞转运供试品溶液以及混合对照品溶液,在本实验的LC-MS条件下分析,BA和内标齐墩果酸的保留时间分别为7.7 min和8.8 min,细胞中内源性物质不会对待测成分产生干扰,峰形良好,见图1。
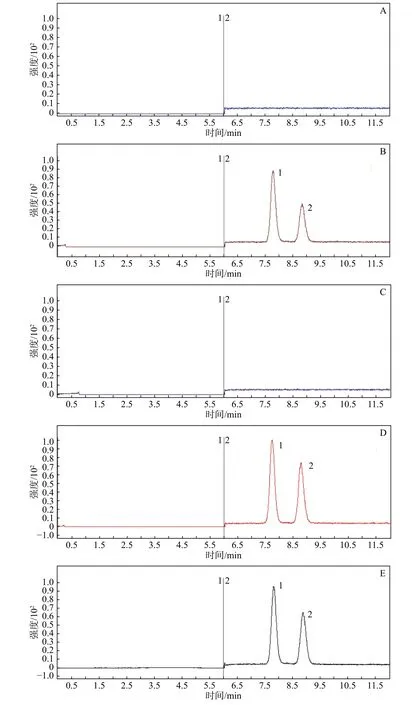
图1 细胞摄取阴性溶液(A)、细胞摄取供试品溶液(B)、细胞转运阴性溶液(C)、细胞转运供试品溶液(D)、混合对照品溶液(E)LC-MS图(1:BA;2:内标)
3.1.2 标准曲线与定量下限
精密吸取“2.4.3”项下的不同浓度的对照品溶液,按照“2.4.4”项下方法处理,进行LC-MS分析。采用加权最小二乘法(1/C),以BA峰面积与内标峰面积的比值(Y)和进样浓度(X)进行线性回归方程,计算标准曲线。摄取实验和转运实验的标准曲线方程分别为Y=0.007X+0.131(r=0.997),Y=0.007X+0.071(r=0.998),线性范围为 8.4~840 ng/mL,线性关系良好。
3.1.3 精密度与准确度
取“2.4.3”项下的 BA 质控样品,按照“2.4.4”项下方法处理,每个浓度平行6份,分别于第1天和第5天测定,计算日内精密度、日间精密度,以实测浓度和真实浓度相比得回收率表示准确度。实验结果显示BA和内标的日内、日间精密度 RSD 为3%~10%,回收率为 95%~110%,均符合生物样品分析的方法要求 (如表1所示)。
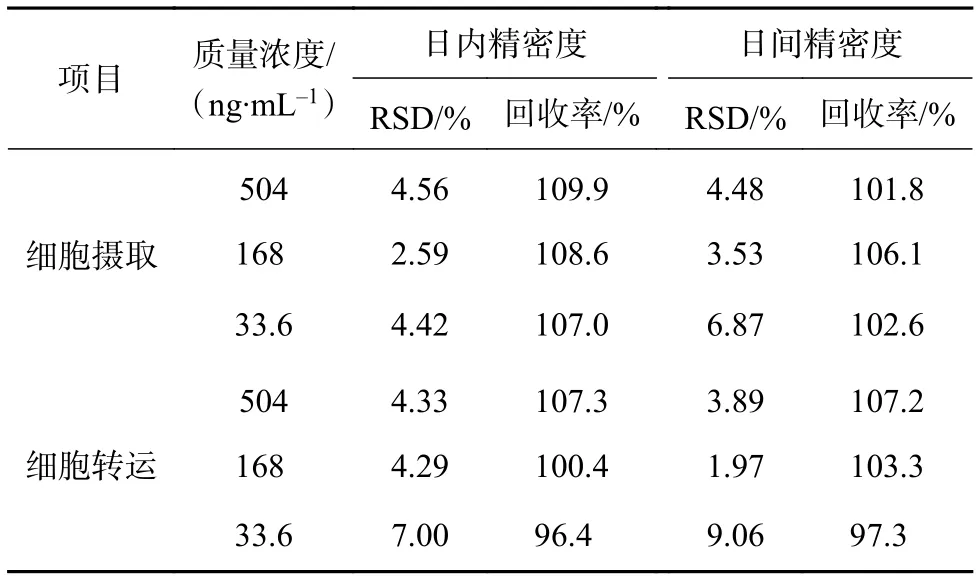
表1 精密度和准确度(n=6)
3.1.4 基质效应和提取回收率
取空白细胞液,不加内标按照“2.4.4”项下方法处理后向残留物中加入200 μL浓度为504,168,33.6 ng/mL BA溶液和5 μL内标溶液,50 ℃氮吹干燥后200 μL甲醇复溶,进样测定得峰面积A;取BA质控样品按“2.4.4”项下方法处理后进样测定得峰面积B;取 200 μL 浓度为 504,168,33.6 ng/mL BA溶液和5 μL内标溶液,50 ℃氮吹干燥后200 μL甲醇复溶后进样测定得峰面积C,每个浓度平行6个样品,基质效应=峰面积A/峰面积C×100%,提取回收率=峰面积B/峰面积A×100%。BA的基质效应及提取回收率分别在107.9%~114.5%和97.2%~103.0%范围内,RSD均<10%,符合生物样品分析要求(如表2所示)。
表2 基质效应和提取回收率(±S ,n=6)
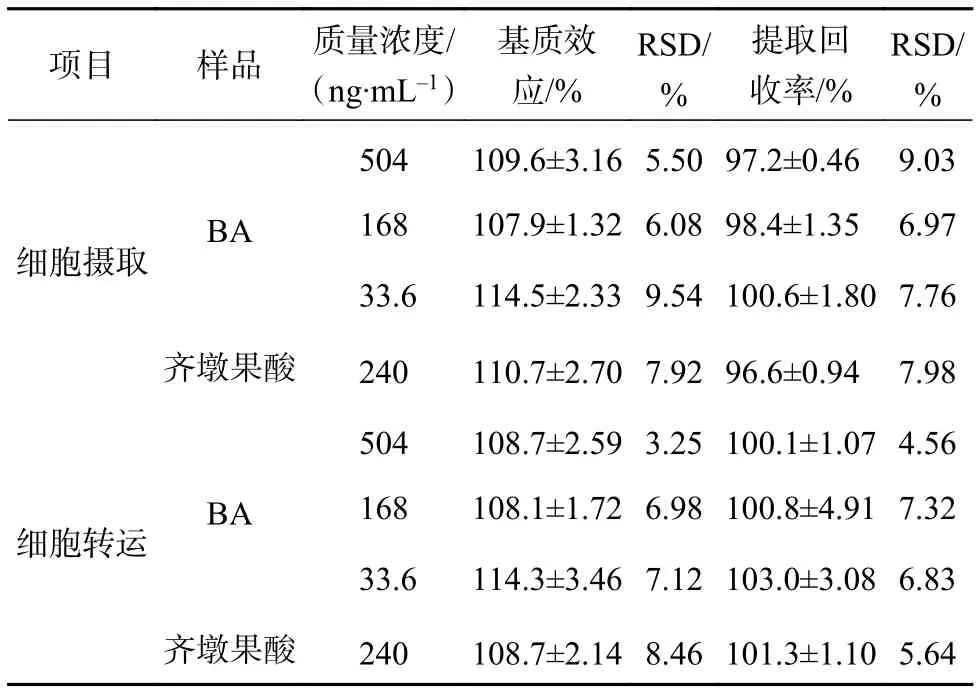
表2 基质效应和提取回收率(±S ,n=6)
项目 样品 质量浓度/(ng·mL-1)基质效应/%RSD/%提取回收率/%RSD/%细胞摄取 BA 504 109.6±3.16 5.50 97.2±0.46 9.03 168 107.9±1.32 6.08 98.4±1.35 6.97 33.6 114.5±2.33 9.54 100.6±1.80 7.76齐墩果酸 240 110.7±2.70 7.92 96.6±0.94 7.98细胞转运 BA 504 108.7±2.59 3.25 100.1±1.07 4.56 168 108.1±1.72 6.98 100.8±4.91 7.32 33.6 114.3±3.46 7.12 103.0±3.08 6.83齐墩果酸 240 108.7±2.14 8.46 101.3±1.10 5.64
3.1.5 稳定性
取“2.4.3”项下的BA溶液质控样品,每个浓度样品平行6份,分别考察BA质控样品的室温稳定性(25 ℃,24 h)、长期稳定性(-80 ℃ 冰箱放置30 d)、冻融稳定性(-80 ℃,反复冻融循环 3 次),以当日标准曲线计算质控样品浓度,并计算准确度,结果见表3、图2、图3。结果显示上述条件下RSD值均<10%,表明BA质控样品溶液均能在上述条件下保持稳定。
表3 稳定性(±S ,n=6)
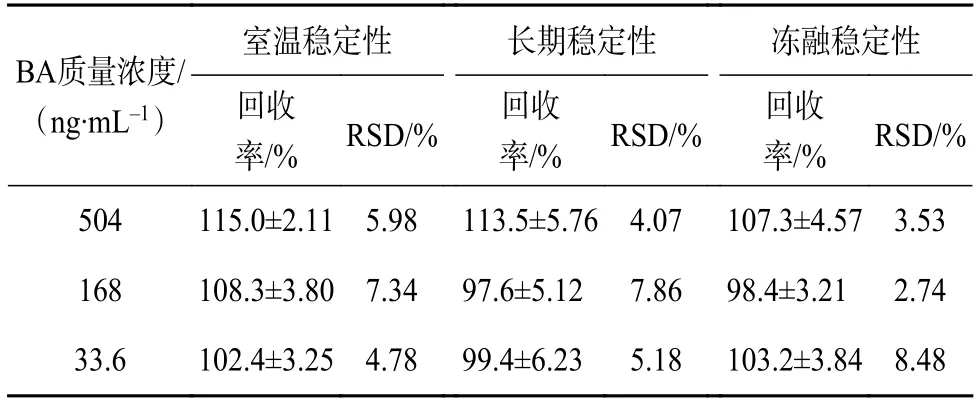
表3 稳定性(±S ,n=6)
BA质量浓度/(ng·mL-1)率/% RSD/% 回收室温稳定性 长期稳定性 冻融稳定性回收率/% RSD/% 回收率/% RSD/%504 115.0±2.11 5.98 113.5±5.76 4.07 107.3±4.57 3.53 168 108.3±3.80 7.34 97.6±5.12 7.86 98.4±3.21 2.74 33.6 102.4±3.25 4.78 99.4±6.23 5.18 103.2±3.84 8.48
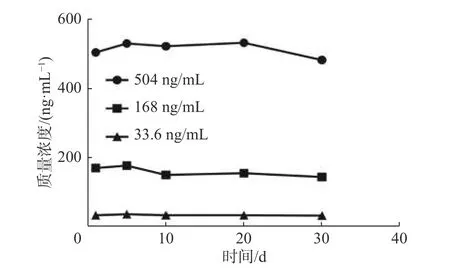
图2 长期稳定性
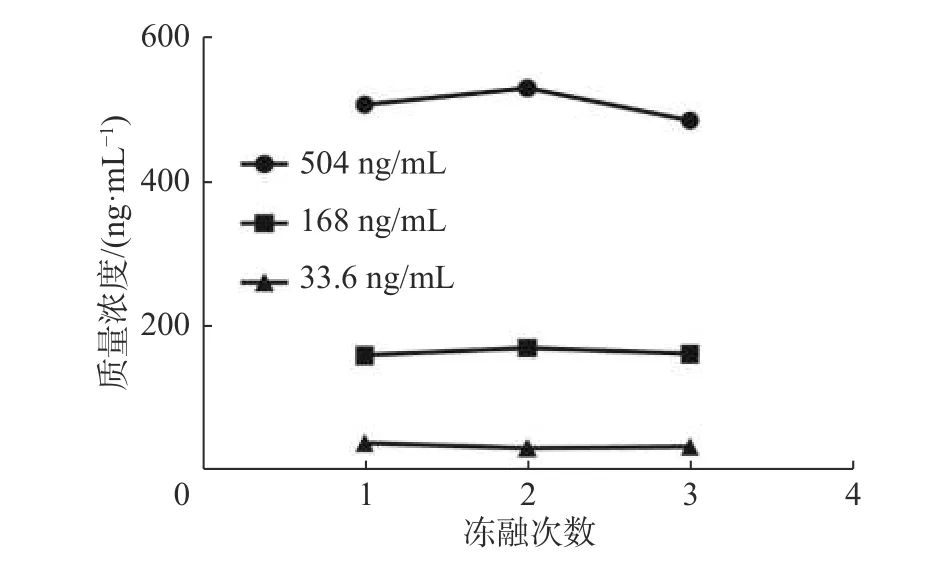
图3 冻融稳定性
3.2 实验结果
3.2.1 细胞摄取
将 Caco-2细胞分别与 100,175,250 μg/mL BA供试液以及250 μg/mL BA供试液与维拉帕米、丙磺舒的混合试液培养,结果见图4。BA摄取量随着浓度的增加而增大,呈一定浓度依赖性(P<0.05)。加入维拉帕米、丙磺舒共培养,BA摄取量与未加药物的对照组比较,没有显著差异(P>0.05),说明BA的摄取不受维拉帕米和丙磺舒的影响。
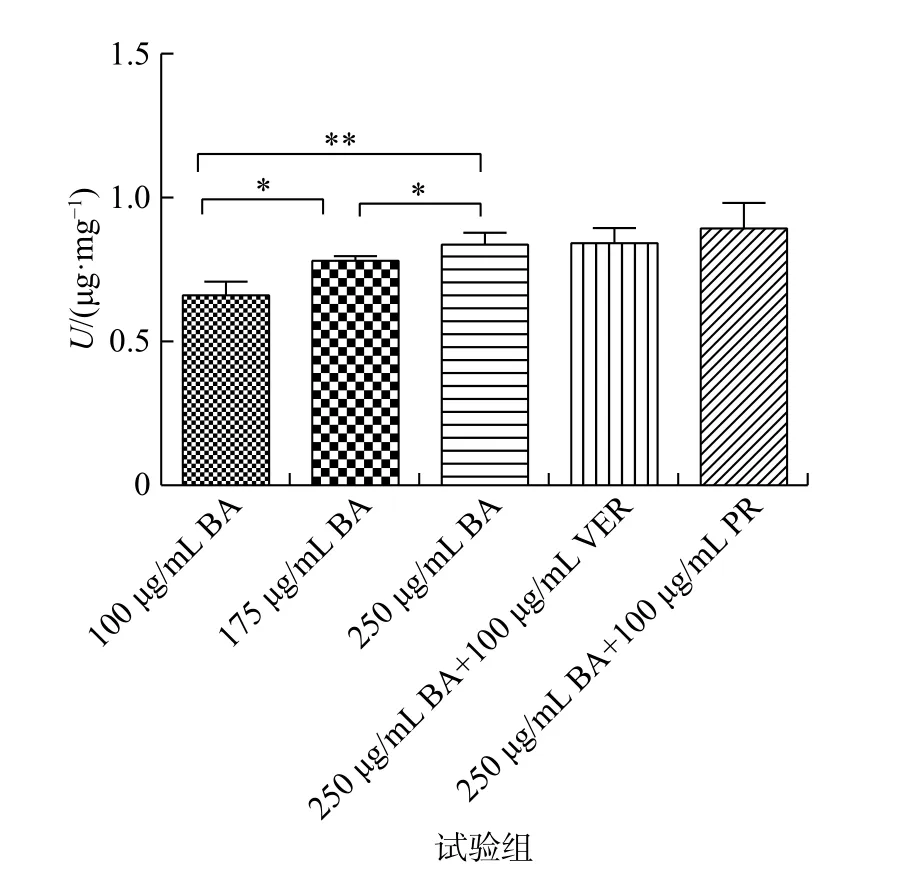
图4 Caco-2细胞药物摄取实验
3.2.2 药物跨膜转运
不同浓度BA跨膜转运实验结果如图5、图6所示,AP→BL 时,BA 的Papp值为 1.31×10-7~1.40×10-7cm/s;BL→AP 时,BA 的Papp值为 1.50×10-7~1.61×10-7cm/s。两侧的Papp值均随浓度的增加变化不大(P>0.05),且外排率均<1.5。在加入维拉帕米、丙磺舒转运体抑制剂之后,BA的Papp值与未加入转运体抑制剂的对照组相比,没有显著性差异(P>0.05),表明BA的转运不受转运体抑制剂的影响。

图5 Caco-2细胞药物在AP→BL侧转运实验
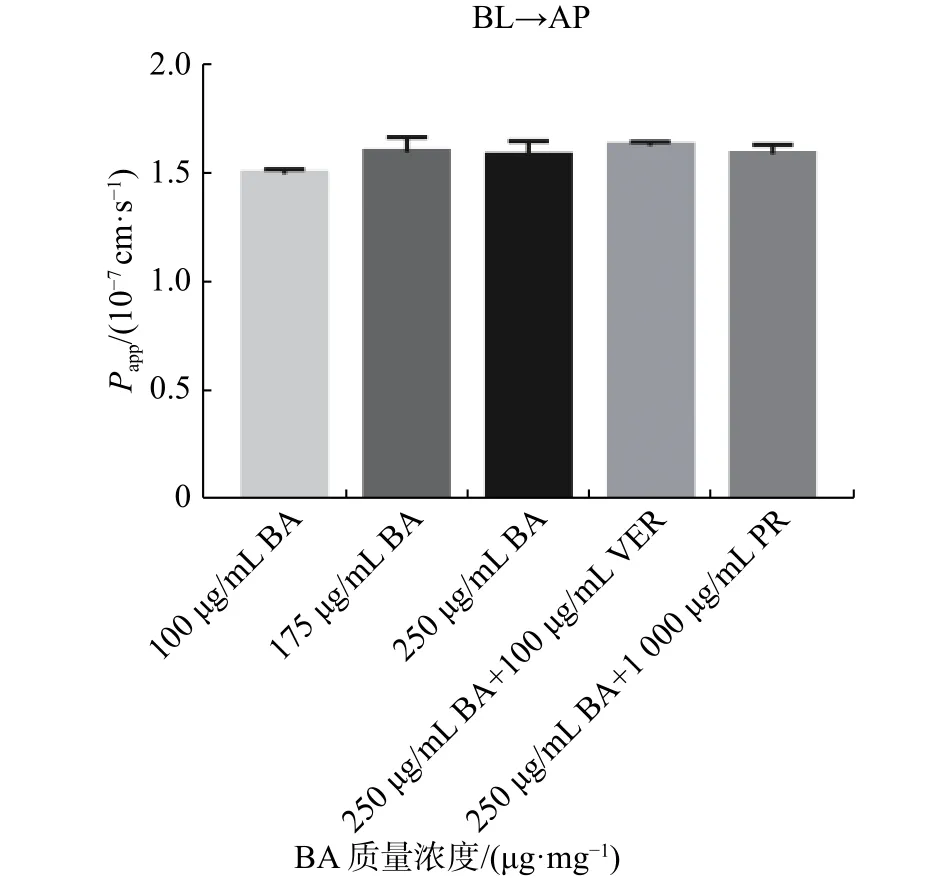
图6 Caco-2细胞药物在BL→AP侧转运实验
4 讨 论
前期,有学者[21]也采用LC-MS建立起BA的含量测定方法,但主要是针对大鼠血浆中BA的含量测定,而在本研究中主要是针对于HBSS细胞摄取液和转运液样品中BA的含量测定。实验前期考察发现BA的HPLC检测定量限约为4 μg/mL,而样品中BA浓度远低于HPLC定量限,故研究选用采用LC-ESI-MS检测BA含量,并对其方法学进行了验证,该方法测得的目标成分的内源性杂质干扰小,峰形对称,分离度好,是一种较为快速、高效、灵敏的含量测定方法。
通过建立灵敏度高、特异性强的细胞摄取液和转运液中BA浓度的LC-MS测定方法,设置不同浓度以及相同浓度下不同转运蛋白抑制剂等考察因素,探究BA在Caco-2细胞中的摄取和跨膜转运情况。摄取实验结果表明,BA摄取存在浓度依赖性,转运蛋白抑制剂维拉帕米和丙磺舒的加入对BA的单位蛋白摄取量无显著影响;在转运实验中,100,175,250 μg/mL的BA从AP侧到BL侧及BL侧到AP侧的Papp值随浓度的增加无显著变化,而且ER<1.5。可以推断BA主要是通过被动扩散的方式吸收转运,呈浓度依赖性。药物在Caco-2细胞模型上的表观渗透系数Papp与其口服吸收率密切相关,实验结果显示BA的Papp<1×10-6cm/s,表明BA属于吸收极差的化合物[23],推测BA在人体的吸收率小于20%,这和BA较低的口服生物利用度的结果一致。加入维拉帕米和丙磺舒,BA 的Papp(AP-BL)值、Papp(BL-AP)值无显著差异,由此可推断,BA不是P-糖蛋白和多药耐药相关蛋白的底物。综上,BA是一种口服吸收率极差的化合物,在Caco-2细胞中的摄取和转运为被动扩散,且不是P-糖蛋白和多药耐药相关蛋白的底物。
5 结束语
本实验成功建立了用LC-MS准确测定Caco-2细胞中BA含量的实验方法。该方法在-ESI离子化方式下,以齐墩果酸为内标,通过检测BA的碎片离子m/z455.4进行定量分析。该方法稳定性良好,灵敏度高、提取回收率高,生物样本中内源性杂质无干扰,能有效应用于Caco-2细胞中BA的定量分析。本实验采用LC-MS法对BA在Caco-2细胞上的摄取和转运进行研究,预测BA在肠吸收情况,为合理设计其口服制剂研发提供实验数据以及理论支持。
