启脾丸中黄曲霉毒素B1、B2、G1、G2含量测定及安全性评价
2022-03-30张慧白桂昌罗轶罗永强张赞广西壮族自治区食品药品检验所国家药品监督管理局中药材质量监测与评价重点实验室南宁530021
张慧,白桂昌,罗轶,罗永强,张赞(广西壮族自治区食品药品检验所,国家药品监督管理局中药材质量监测与评价重点实验室,南宁 530021)
启脾丸处方由六神曲(炒)、莲子(炒)、麸炒白术、茯苓、人参、山药、炒山楂、陈皮、炒麦芽、甘草、泽泻等中药组成,临床用于健脾和胃。中药材从采集到成药环节繁杂,由于药材含糖、蛋白质、油脂等成分较高,在栽培生产、加工炮制、储藏运输等过程容易霉变污染,而霉变产生的代谢物中毒性最强的为黄曲霉毒素(aflatoxin,AF),黄曲霉毒素在中药材中主要含有黄曲霉毒素B、B、G、G,其中黄曲霉毒素 B毒性最大。在启脾丸的11 味药材中,莲子、陈皮、炒麦芽、六神曲、甘草等易受黄曲霉毒素污染,进而引入启脾丸中。《中国药典》一部中部分药材品种制定了黄曲霉毒素的检测项目,但对中成药并未规定,为保证用药安全,有必要考察启脾丸中黄曲霉毒素的残留情况。本文将样品提取后,经免疫亲和柱处理,利用高效液相色谱(HPLC)-柱后衍生-荧光检测器(FLD),建立了启脾丸中黄曲霉毒素B、B、G、G的含量测定方法,并对全国10 个生产企业的64 批启脾丸样品进行了测定和安全性评价,为其质量安全控制提供依据。
1 材料
HPLC 2695 和FLD 2475(Waters 公司),UVE光化学衍生器(254 nm)(LCTech 公司),AB204-S电子天平(Mettler Toledo 公司),涡旋混合器(TALBOYS 公司),固相萃取仪(Dikma 公司)。黄曲霉毒素混合对照品(批号:610001-201602,黄曲霉毒素B、B、G、G标示质量浓度分别为1.02、0.43、1.06、0.38 μg·mL,中国食品药品检定研究院);黄曲霉毒素总量(B、B、G、G)免疫亲和柱(北京华安麦科生物技术有限公司);64 批启脾丸样品来自全国10 个生产厂家,厂家(样品编号)分别为A(1 ~4)、B(5 ~11)、C(12)、D(13 ~20)、E(21 ~23)、F(24 ~25)、G(26 ~35)、H(36 ~37)、I(38 ~43)、J(44 ~64);乙腈为色谱纯,其他试剂为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:CAPCELL PAK CMGⅡ(4.6 mm×250 mm,5 μm);流动相:甲醇-乙腈-水(30∶13∶57);流速:1.1 mL·min;进样量:25 μL;柱后UVE 光化学衍生;检测器:FLD,激发波长:360 nm,发射波长:450 nm。
2.2 溶液的制备
2.2.1 对照品溶液和随行加样对照品溶液 精密量取黄曲霉毒素混合对照品0.5 mL,置10 mL 棕色量瓶中,用甲醇稀释至刻度,作为储备液。精密量取储备液1 mL,置25 mL 棕色量瓶中,用甲醇稀释至刻度,即得黄曲霉毒素B、B、G、G质量浓度为2.04、0.86、2.12、0.76 ng·mL的对照品溶液。精密量取储备液0.65 mL,置50 mL 量瓶中,用甲醇稀释至刻度,作为随行加样对照品溶液。
2.2.2 供试品溶液 取样品剪碎,精密称取3 g,置50 mL 离心管中,加入氯化钠3 g,水5 mL,涡旋摇散,再精密加入甲醇20 mL,2500 r·min涡旋5 min,9000 r·min离心5 min,精密量取上清液15 mL,置50 mL 量瓶中,用磷酸缓冲液(pH 6.5)稀释至刻度,摇匀,滤过,精密量取续滤液20 mL,经免疫亲和柱处理,流速3 mL·min,用水20 mL 洗脱,洗脱液弃去,用空气将水排出,再用甲醇1.5 mL 自然洗脱,将洗脱液置2 mL 量瓶中,用甲醇稀释至刻度,摇匀,即得。
2.3 系统适用性试验
按“2.1”项下色谱条件,取对照品溶液、阴性样品(均未检出黄曲霉毒素B、B、G、G的样品)、供试品溶液进样测定,黄曲霉毒素各成分分离完全,分离度大于(R
)1.5,见图1。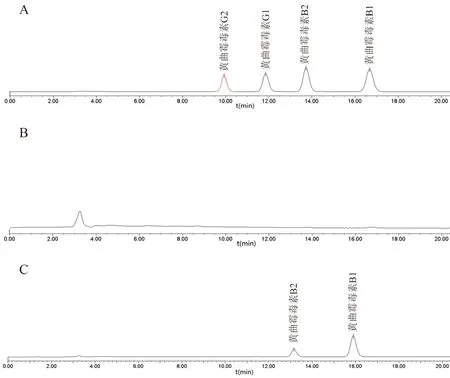
图1 黄曲霉毒素HPLC 图Fig 1 HPLC of aflatoxin
2.4 线性关系考察
精密吸取“2.2.1”项下的对照品溶液配制成系列对照品溶液,按“2.1”项下色谱条件进样测定,以进样量(X
,pg)为横坐标,峰面积(Y
)为纵坐标,计算回归方程,结果见表1。表1 回归方程和线性范围
Tab 1 Regression equation and linear range
黄曲霉毒素线性方程r线性范围/pg B1Y =3.842×104X +17.261.0000 9.3 ~55.8 B2Y =7.268×103X-16.621.0000 3.0 ~18.0 G1Y =2.167×104X-70.431.00009.3 ~55.8 G2Y =5.662×104X-51.020.9999 3.5 ~21.0
2.5 加样回收试验
取未检出样品6 份,约3 g,精密称定,置离心管(50 mL)中,精密加入随行加样对照品溶液20 mL,按“2.2.2”项下方法制备加样回收供试品溶液,进样测定,结果黄曲霉毒素B、B、G、G平均加样回收率分别为84.09%、84.38%、83.11%、86.33%,RSD
分别为2.5%、2.0%、2.8%、1.9%,符合分析要求。2.6 重复性试验
取同一批样品6 份,按“2.2.2”项下方法制备供试品溶液,进样测定,结果黄曲霉毒素B、B、G、G的RSD
分别为2.0%、1.5%、2.1%、1.6%,表明方法重复性良好。2.7 精密度试验
取同一份“2.5”项下的加样回收供试品溶液,连续测定6 次,结果黄曲霉毒素B、B、G、G的RSD
分别为0.64%、0.48%、1.0%、0.57%,表明仪器精密度良好。2.8 稳定性试验
取同一份“2.5”项下的加样回收供试品溶液,分别于0、2、5、8、12 h 进样测定,结果黄曲霉毒素B、B、G、G的RSD
分别为1.3%、1.0%、1.0%、0.99%,表明12 h 内各组分均稳定。2.9 检测限
精密量取“2.2.1”项下对照品溶液1 mL,置25 mL 量瓶中,加甲醇稀释并定容,摇匀,进样测定,结果各黄曲霉组分峰的信噪比均大于10,折算各成分检测限,结果黄曲霉毒素B、B、G、G检测限分别为0.2、0.1、0.2、0.1 μg·kg。
2.10 样品测定
取64 批启脾丸样品,按“2.2.2”项下方法制备供试品溶液,进样测定,结果52 批启脾丸检出黄曲霉毒素,检出率达81.2%,黄曲霉毒素B的含量为0.0 ~21.8 μg·kg,黄曲霉毒素B的含量为0.0 ~2.5 μg·kg,黄曲霉毒素G和黄曲霉毒素G均未检出,黄曲霉毒素B、B、G、G总量为0.0 ~24.3 μg·kg,见表2。参考《中国药典》2020年版一部的限度(每1 kg 含黄曲霉毒素B不得过5 µg,含黄曲霉毒素B、B、G、G总量不得过10 µg)对样品进行判断,结果6 批样品超过限度,不合格率为9.4%。表明黄曲霉毒素所造成的安全隐患不容忽视。
表2 启脾丸样品中黄曲霉毒素B、B、G、G 测定结果(μg·kg)
Tab 2 Determination of aflatoxin B,B,G and G in Qipi pill (μg·kg)
注(Note):ND 表示未检出(ND means no detection)。
样品黄曲霉毒素样品黄曲霉毒素B1B2G1G2总量B1B2G1G2总量1 12.2 2 9.4 3 21.81.8 NDND14.0 33 1.2 0.1 NDND1.3 1.4 NDND10.8 34 1.3 0.2 NDND1.5 2.5 NDND24.3 35 1.5 0.1 NDND1.6 4 8.9 1.8 NDND10.7 36 2.0 0.3 NDND2.3 5 2.0 0.5 NDND2.5 37 2.2 0.4 NDND2.6 6 1.7 0.3 NDND2.0 38 0.6 0.3 NDND0.9 7 1.9 0.4 NDND2.3 39 NDNDNDNDND 8 2.2 0.4 NDND2.6 40 1.7 0.3 NDND2.0 9 4.5 0.9 NDND5.4 41 1.6 0.4 NDND2.0 10 2.4 0.6 NDND3.0 42 2.4 0.4 NDND2.8 11 7.6 1.1 NDND8.7 43 3.3 0.5 NDND3.8 12 5.6 1.1 NDND6.7 44 1.2 0.2 NDND1.4 13 1.3 0.6 NDND1.9 45 1.3 0.2 NDND1.5 14 1.1 0.5 NDND1.6 46 1.3 0.4 NDND1.7 15 1.4 0.4 NDND1.8 47 1.4 0.2 NDND1.6 16 NDNDNDNDND 48 1.3 0.2 NDND1.5 17 NDNDNDNDND 49 1.0 0.2 NDND1.2 18 NDNDNDNDND 50 1.0 0.3 NDND1.3 19 NDNDNDNDND 51 1.1 0.1 NDND1.2 20 NDNDNDNDND 52 0.6 0.1 NDND0.7 21 2.2 0.5 NDND2.7 53 0.7 0.1 NDND0.8 22 2.5 0.5 NDND3.0 54 0.8 0.1 NDND0.9 23 2.1 0.4 NDND2.5 55 1.7 0.2 NDND1.9 24 NDNDNDNDND 56 NDNDNDNDND 25 NDNDNDNDND 57 NDNDNDNDND 26 1.3 0.2 NDND1.5 58 NDNDNDNDND 27 1.2 0.3 NDND1.5 59 2.1 0.6 NDND2.7 28 2.2 0.3 NDND2.5 60 1.8 0.5 NDND2.3 29 2.6 0.2 NDND2.8 61 2.0 0.5 NDND2.5 30 0.9 0.1 NDND1.0 62 2.5 0.4 NDND2.9 31 0.9 0.1 NDND1.0 63 NDNDNDNDND 32 1.1 0.1 NDND1.2 64 1.9 0.5 NDND2.4
3 讨论
启脾丸由11 味药组成,制法为全部药味粉碎后于炼蜜混合直接入药。黄曲霉毒素的毒性被列为极毒,目前国际上不建议设定黄曲霉毒素的安全耐受量和无毒作用剂量,国内外标准对食品中黄曲霉毒素限量的规定不同,国际食品法典委员会、美国未单独对坚果中黄曲霉毒素B做限定,仅规定黄曲霉毒素总量最高限量为10 ~20 μg·kg;欧盟对水果及坚果类制品规定最高限量黄曲霉毒素B为2 ~12 μg·kg、黄曲霉毒素总量为4 ~15 μg·kg;中国《食品安全国家标准 食品中真菌毒素限量》(GB2761-2017)中仅限定了黄曲霉毒素B含量,其中谷物及制品5.0 ~20 μg·kg、豆类及制品5.0 μg·kg、坚果及籽类5.0 ~20 μg·kg、油脂及其制品10 ~20 μg·kg、 调味品5.0 μg·kg、 特殊膳食用食品0.5 μg·kg。除食品之外,德国、韩国对中药材中黄曲霉毒素B限度为2、10 μg·kg;中国《药用植物及制剂进出口绿色行业标准》中黄曲霉毒素B限度为5 μg·kg,《中国药典》对中药材中黄曲霉毒素B和黄曲霉毒素总量限量为5 μg·kg和10 μg·kg。但目前均没有标准单独对黄曲霉毒素B、G、G的限量进行规定,大多通过黄曲霉毒素总量控制其安全性。
在检出黄曲霉毒素的启脾丸样品中,全部为B 族黄曲霉毒素,主要为黄曲霉毒素B。按照《中国药典》的限度标准进行判定,有3 家生产企业6 批样品超过限度,表明部分企业对易感染黄曲霉毒素的投料饮片质量控制意识较差,缺乏有效监督。
由于黄曲霉毒素极易污染,在中药材和中成药的全过程生产链中制订有效的防控措施十分重要。从源头来讲,先进的栽培技术、合理的采集时间、严格的储藏加工运输条件均能有效降低黄曲霉毒素的污染。在黄曲霉毒素产生后,也可通过物理方法(高温、辐照、精油熏蒸、吸附)、化学方法(氨处理、臭氧处理)、生物方法(细菌、真菌、海洋微生物)对其进行降解并减少毒性。同时应根据中药的不同特性,在不影响质量的前提下选择合适的防控措施,形成长效的保障机制。
黄曲霉毒素易溶于甲醇、三氯甲烷、丙酮、油等有机溶剂,难溶于水,试验中采用70%甲醇对启脾丸样品进行提取后,提取液呈弱酸性,为使免疫亲和柱保持良好的吸附性能,比较了水和4 种磷酸缓冲液(pH 6.0、6.5、7.0、7.5)作为提取液的稀释溶液,结果选用pH 6.5 的磷酸缓冲液稀释提取液后再经免疫亲和柱净化回收率最好。方法学研究表明此方法具有回收率好、专属性强、操作简单快速等优点,可作为启脾丸黄曲霉毒素的定量分析方法。
