长裂藤黄叶的化学成分研究
2022-03-30王玉婷于熙岳佳音华会明孙雅婷沈阳医学院药学院沈阳0034沈阳药科大学中药学院沈阳006
王玉婷,于熙,岳佳音,华会明,孙雅婷*(. 沈阳医学院药学院,沈阳 0034;. 沈阳药科大学中药学院,沈阳 006)
长裂藤黄(Garcinia lancilimba
)为藤黄科(Guttiferae)藤黄属(Garcinia
)植物,主要分布于我国云南省东南部,广西西部和西南部地区,生于低丘、荫坡、潮湿的沟谷密林下。藤黄属植物有着悠久的民间用药历史,具有消炎作用,其代表性化合物为酮类化合物、间苯三酚类化合物、萜类化合物和黄酮类化合物。现代药理学研究显示,该属植物具有抗肿瘤、抗氧化、抗菌和抗炎等多种药理作用。长裂藤黄是中国特有的藤黄属植物,但对其化学成分研究相对较少且研究部位为茎,为了更好地开发利用长裂藤黄的化学结构和生物活性,本文对长裂藤黄叶的化学成分进行研究。本文采用硅胶柱色谱、开放ODS柱色谱、Sephadex LH-20凝胶柱色谱、反相半制备高效液相色谱等多种色谱手段从长裂藤黄叶95%乙醇提取液的二氯甲烷萃取物中分离得到8个化合物,包括5个黄酮类,2个双黄酮类,1个生育三烯酚类,分别鉴定为山柰酚(kaempferol,1)、芹菜素(apigenin,2)、5,7-二羟基-6,4'-二甲氧基黄酮(5,7-dihydroxy-6,4'-dimethoxyflavone,3)、槲皮素(quercetin,4)、木犀草素(luteolin,5)、pancibiflavonol(6)、藤黄双黄酮(morelloflavone,7)、litchtocotrienol A(8)。通过理化常数测定、波谱数据分析等方法确定了化合物的结构(见图1)。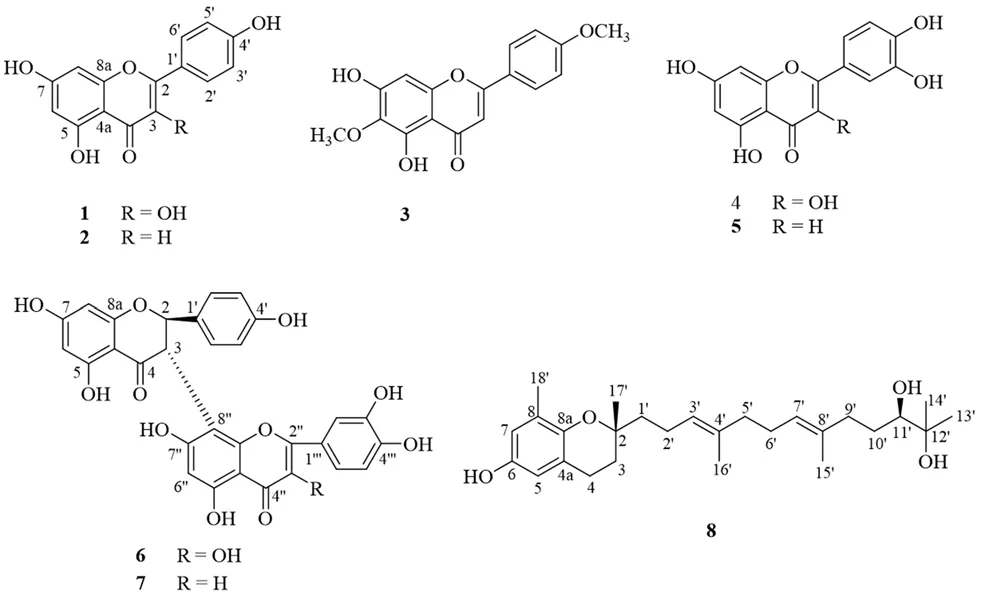
图1 化合物1~8的结构式Fig 1 Structures of the compounds 1~8
1 材料
Bruker ARX-400核磁共振波谱仪(Bruker 公司,TMS内标);Bruker micrOTOF-Q 高分辨电喷雾质谱仪(Bruker 公司);J-715圆二色谱仪(日本JASCO);高效液相色谱仪(日本岛津,配备SPD-20A紫外检测器,LC-6AB高压输液泵);色谱柱(YMC ODS-A,250 mm×20 mm,5 μm);Bruker IFS-55红外光谱仪(KBr压片);N1100DWB旋转蒸发仪(日本EYELA);柱色谱用硅胶(200~300目、100~200目)和薄层色谱用硅胶(青岛海洋化工厂);ODS柱色谱填料(100 μm,日本YMC公司);Sephadex LH-20(GE公司);色谱纯甲醇、乙腈(天津科密欧公司),其他常规试剂均为分析纯。
长裂藤黄叶于2010年采自云南省西双版纳热带植物园,经陈渝工程师鉴定为藤黄属植物长裂藤黄Garcinia lancilimba
的叶。样品标本保留于沈阳药科大学中药学院天然药物化学教研室。2 提取分离
长裂藤黄叶12.4 kg在提取罐中用95%乙醇浸渍加热提取3次,每次3 h,合并提取液,回收溶剂。将该醇提物混悬于水中,依次用等体积的石油醚、二氯甲烷和正丁醇萃取,分别减压回收溶剂,得到二氯甲烷萃取物270 g。
取二氯甲烷萃取物270 g,进行硅胶柱色谱分离,以二氯甲烷-甲醇系统(100∶0~0∶100)进行梯度洗脱得到5个组分Fr.A~Fr.E。Fr.C组分进行硅胶柱色谱分离,以石油醚-丙酮系统(100∶5~0∶100)进行梯度洗脱,得到7个亚组分Fr.C1~Fr.C7。Fr.C3经ODS开放柱色谱(甲醇-水:30%~100%)和高效液相色谱纯化得到化合物1(5.0 mg)和化合物2(3.0 mg)。Fr.C5依次经过ODS柱色谱(甲醇-水:40%~100%)、重结晶以及高效液相色谱(流动相:80%甲醇)纯化得到化合物8(30.0 mg)。Fr.C6经ODS柱色谱和Sephadex LH-20凝胶柱色谱纯化得到化合物3(5.6 mg)、化合物4(3.2 mg)和化合物5(3.5 mg)。Fr.D组分进行硅胶柱色谱分离,以石油醚-丙酮系统(100∶5~100∶50)进行梯度洗脱,得到4个亚组分Fr.D1~Fr.D4。Fr.D3经Sephadex LH-20凝胶柱色谱和高效液相色谱纯化得到化合物6(4.0 mg)和化合物7(7.0 mg)。
3 结构鉴定
化合物1:黄色粉末(甲醇),10% 硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基,推测可能为黄酮类化合物。H NMR(400 MHz,DMSO-d
)谱表明δ
12.47(1H,s,5-OH)为5位酚羟基质子信号,δ
9.53(1H,brs)为一个活泼质子信号;一组B环AA'BB'偶合系统质子信号δ
8.02(2H,d,J
=8.8 Hz,H-2',6'),6.92(2H,d,J
=8.8 Hz,H-3',5'),提示有4'-羟基取代;同时还显示了一组A环6,8位间位偶合芳香质子信号δ
6.41(1H,d,J
=2.0 Hz,H-8),6.16(1H,d,J
=2.0 Hz,H-6),表明A环为5,7-二羟基取代。氢谱信号归属为:δ
12.47(1H,s,5-OH),9.53(1H,brs,7/4'-OH),8.02(2H,d,J
=8.8 Hz,H-2',6'),6.92(2H,d,J
=8.8 Hz,H-3',5'),6.41(1H,d,J
=2.0 Hz,H-8),6.16(1H,d,J
=2.0 Hz,H-6)。该化合物的波谱数据与文献基本一致,鉴定化合物1为山柰酚(kaempferol)。化合物2:淡黄色粉末(甲醇),10%硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基,推测可能为黄酮类化合物。H NMR(400 MHz,DMSO-d
)谱中:δ
12.46(1H,s,5-OH)为与羰基缔合的羟基质子信号;一组B环AA'BB'偶合系统质子信号δ
7.98(2H,d,J
=8.3 Hz,H-2',6'),6.90(2H,d,J
=8.3 Hz,H-3',5'),提示有4'-羟基取代;A环6,8位间位偶合芳香质子信号δ
6.44(1H,d,J
=2.0 Hz,H-8),6.15(1H,d,J
=2.0 Hz,H-6),表明A环为5,7-二羟基取代;与化合物1相比,多了一个芳氢质子信号δ
6.68(1H,s,H-3),为黄酮母核3位的质子。氢谱信号归属为:δ
12.46(1H,s,5-OH),7.98(2H,d,J
=8.3 Hz,H-2',6'),6.90(2H,d,J
=8.3 Hz,H-3',5'),6.68(1H,s,H-3),6.44(1H,d,J
=2.0 Hz,H-8),6.15(1H,d,J
=2.0 Hz,H-6)。该化合物的波谱数据与文献基本一致,鉴定化合物2为芹菜素(apigenin)。化合物3:黄色粉末(甲醇),10% 硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基,推测可能为黄酮类化合物。H NMR(400 MHz,DMSO-d
)谱表明含有5位缔合酚羟基质子信号δ
13.01(1H,s,5-OH);一组B环AA'BB'偶合系统较低场质子信号δ
8.02(2H,d,J
=8.6 Hz,H-2',6'),7.10(2H,d,J
=8.6 Hz,H-3',5'),同时还显示两个芳香质子信号δ
6.84(1H,s),6.58(1H,s),提示化合物为A环和3位有独立氢取代的黄酮类化合物;另外还给出了两个甲氧基信号δ
3.85(3H,s,4'-OCH),3.75(3H,s,6-OCH),提示有4'-甲氧基存在。氢谱信号归属为:δ
13.01(1H,s,5-OH),8.02(2H,d,J
=8.6 Hz,H-2',6'),7.10(2H,d,J
=8.6 Hz,H-3',5'),6.84(1H,s,H-3),6.58(1H,s,H-8),3.85(3H,s,4'-OCH),3.75(3H,s,6-OCH)。C NMR(100 MHz,DMSO-d
)共显示17个碳信号并归属为:δ
182.1(C-4),163.3(C-2),162.3(C-4'),158.0(C-8a),152.7(C-5),152.5(C-7),131.5(C-6),128.3(C-2',6'),122.9(C-1'),114.6(C-3',5'),103.9(C-4a),103.0(C-3),94.4(C-8),59.9(6-OCH),55.6(4'-OCH)。该化合物的波谱数据与文献基本一致,鉴定化合物3为5,7-二羟基-6,4'-二甲氧基黄酮(5,7-dihydroxy-6,4'-dimethoxyflavone)。化合物4:黄色粉末(甲醇),10%硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基,推测可能为黄酮类化合物。H NMR(400 MHz,DMSO-d
)谱中δ
12.48(1H,s,H-5)为5位缔合酚羟基质子信号;给出B环上ABX偶合系统氢质子信号δ
7.65(1H,d,J
=2.1 Hz,H-2'),7.53(1H,dd,J
=8.6,2.1 Hz,H-6'),6.84(1H,d,J
=8.6 Hz,H-5'),提示该黄酮母核B环上有3',4'-二取代;A环上给出间位偶合质子信号δ
6.42(1H,d,J
=2.2 Hz,H-8),6.19(1H,d,J
=2.2 Hz,H-6)。氢 谱 信号归属为:δ
12.48(1H,s,5-OH),7.65(1H,d,J
=2.1 Hz,H-2'),7.53(1H,dd,J
=8.6,2.1 Hz,H-6'),6.84(1H,d,J
=8.6 Hz,H-5'),6.42(1H,d,J
=2.2 Hz,H-8),6.19(1H,d,J
=2.2 Hz,H-6)。该化合物的波谱数据与文献基本一致,鉴定化合物4为槲皮素(quercetin)。化合物5:黄色针状结晶(甲醇),10%硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基,推测可能为黄酮类化合物。H NMR(400 MHz,DMSO-d
)谱中给出5位缔合的酚羟基质子信号δ
12.62(1H,s,5-OH);给出B环上ABX偶合系统氢质子信号δ
7.46(1H,d,J
=2.4 Hz,H-2'),7.44(1H,dd,J
=8.6,2.4 Hz,H-6'),6.92(1H,d,J
=8.6 Hz,H-5');A环上给出间位偶合质子信号δ
6.44(1H,d,J
=2.1 Hz,H-8),6.19(1H,d,J
=2.1 Hz,H-6);氢谱中还有一个δ
6.63(1H,s,H-3)的芳氢质子信号。氢谱信号归属为:δ
12.62(1H,s,5-OH),7.46(1H,d,J
=2.4 Hz,H-2'),7.44(1H,dd,J
=8.6,2.4 Hz,H-6'),6.92(1H,d,J
=8.6 Hz,H-5'),6.63(1H,s,H-3),6.44(1H,d,J
=2.1 Hz,H-8),6.19(1H,d,J
=2.1 Hz,H-6),以上数据与文献基本一致,故鉴定化合物5为木犀草素(luteolin)。化合物6:黄色无定形粉末(甲醇),10%硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基。H NMR(400 MHz,DMSO-d
)谱中δ
12.51,12.32为两个与羰基缔合的羟基质子信号,9.32(2H,brs)为两个活泼质子信号。δ
7.63(1H,d,J
=1.8 Hz,H-2'''),7.56(1H,brd,J
=8.6 Hz,H-6'''),6.90(1H,d,J
=8.6 Hz,H-5''')为一组典型的苯环上ABX偶合系统;δ
6.14(1H,s,H-6'')为一个孤立的芳氢信号。δ
7.12(2H,d,J
=8.4 Hz,H-2',6')和6.37(2H,d,J
=8.4 Hz,H-3',5')为苯环上一组AA'BB'偶合系统质子信号,提示B环上有4'-羟基存在,δ
5.93(2H,brs,H-8,6)为A环上一组间位偶合的质子信号,表明A环为5,7-二羟基取代,δ
5.75(1H,d,J
=12.0 Hz,H-2)和4.81(1H,d,J
=12.0 Hz,H-3)为二氢黄酮母核C环2,3位上的处于反式直立键上的两个质子信号。氢谱信号归属为:δ
12.51(5''-OH),12.32(5-OH),9.32(2H,brs,7/4'/4'''/5'''-OH),7.63(1H,d,J
=1.8 Hz,H-2'''),7.56(1H,brd,J
=8.6 Hz,H-6'''),7.12(2H,d,J
=8.4 Hz,H-2',6'),6.90(1H,d,J
=8.6 Hz,H-5'''),6.37(2H,d,J
=8.4 Hz,H-3',5'),6.14(1H,s,H-6''),5.93(2H,brs,H-8,6),5.75(1H,d,J
=12.0 Hz,H-2),4.81(1H,d,J
=12.0 Hz,H-3)。C NMR(100 MHz,DMSO-d
)谱中共给出30个碳信号,归属为:δ
196.4(C-4)、175.7(C-4'')、166.7(C-7)、163.8(C-5)、163.6(C-7'')、162.9(C-8a)、159.7(C-5'')、157.3(C-4')、154.1(C-8''a)、147.7(C-4''')、145.1(C-3''')、145.1(C-2'')、135.3(C-3'')、128.8(C-1')、128.5(C-2',6')、121.8(C-1''')、120.4(C-6''')、115.7(C-5''')、114.7(C-2''')、114.4(C-3',5')、102.3(C-4''a)、101.6(C-4a)、100.2(C-8'')、98.1(C-6'')、96.2(C-6)、95.3(C-8)、80.9(C-2)、48.1(C-3)。综合分析该化合物的波谱数据,并结合ESIMS给出的分子离子峰[M+H]m/z
573.10,推测其可能为一个黄酮母核的C-8''位与另一个二氢黄酮母核的C-3位通过碳碳键连接而形成的双黄酮类化合物。ECD谱中显示212 nm处负Cotton效应(-27)、284 nm处正Cotton效应(+22)和356 nm处正Cotton效应(+6)。该化合物的波谱数据及其ECD数据同文献基本一致,鉴定为pancibiflavonol。由于C-3位上连接基团的空间位阻较大,旋转受阻而出现构象异构,在氢谱中表现为具有一定比例的两种异构体的混合,升温核磁后(80℃)的图谱则表现为单一形式的一组核磁信号。化合物7:黄色无定形粉末(甲醇),10%硫酸乙醇溶液显黄色;三氯化铁/铁氰化钾溶液显蓝色,提示结构中存在酚羟基。H NMR(400 MHz,DMSO-d
)谱中δ
13.06,12.31为两个与羰基缔合的羟基质子信号,9.38(2H,brs)为两个活泼质子信号。δ
7.41(2H,m,H-2'''/6'''),6.90(1H,d,J
=8.8 Hz,H-5''')为一组典型的苯环上ABX偶合系统;δ
6.55(1H,s,H-3''),6.19(1H,s,H-6'')为两个孤立的芳氢信号。δ
7.16(2H,d,J
=8.3 Hz,H-2',6')和6.39(2H,d,J
=8.3 Hz,H-3',5')为苯环上一组AA'BB'偶合系统质子信号,提示B环上有4'-羟基存在,δ
5.96(2H,brs,H-8,6)为A环上一组间位偶合的质子信号,表明A环为5,7-二羟基取代,δ
5.75(1H,d,J
=12.0 Hz,H-2)和4.86(1H,d,J
=12.0 Hz,H-3)为二氢黄酮母核C环2,3位上处于反式直立键上的两个质子信号。氢谱数据与化合物6相比,仅黄酮母核上多了一个δ
6.55的氢质子信号。氢谱信号归属为:δ
13.06(5''-OH),12.31(5-OH),9.38(2H,brs,7/4'/4'''/5'''-OH),7.41(2H,m,H-2'''/6'''),7.16(2H,d,J
=8.3 Hz,H-2',6'),6.90(1H,d,J
=8.8 Hz,H-5'''),6.55(1H,s,H-3''),6.39(2H,d,J
=8.3 Hz,H-3',5'),6.19(1H,s,H-6''),5.96(2H,brs,H-8,6),5.75(1H,d,J
=12.0 Hz,H-2),4.86(1H,d,J
=12.0 Hz,H-3)。C NMR(100 MHz,DMSO-d
)谱中共给出30个碳信号,归属为:δ
196.4(C-4)、181.5(C-4'')、166.8(C-8a)、163.9(C-2'')、163.3(C-7)、162.9(C-7'')、160.6(C-5'')、157.4(C-4')、155.4(C-8''a)、149.7(C-4''')、145.7(C-3''')、128.6(C-2',6')、128.3(C-1')、121.2(C-1''')、119.3(C-6''')、116.2(C-5''')、114.5(C-3',5')、113.3(C-2''')、102.8(C-4''a)、102.2(C-3'')、101.5(C-4a)、100.7(C-8'')、98.8(C-6'')、96.3(C-8)、95.4(C-6)、81.0(C-2)、48.4(C-3),其中C-5的化学位移值被覆盖。综合分析该化合物的波谱数据,并结合ESIMS给出的分子离子峰[M+H]m/z
557.10,推测其可能为一个黄酮母核C-8''位与另一个二氢黄酮母核的C-3位通过碳碳键连接而形成的双黄酮类化合物。ECD谱中显示221 nm处负Cotton效应(-43)、284 nm处正Cotton效应(+38)和348 nm处正Cotton效应(+12)。该化合物的波谱数据及ECD数据与文献基本一致,鉴定为藤黄双黄酮(morelloflavone)。与化合物6相似,该化合物氢谱中也由于旋转受阻而出现两组信号,可以通过升温核磁使其变为单一形式的一组核磁信号。化合物8:浅棕色油状,10% 硫酸乙醇溶液显棕色。HRESIMS给出准分子离子峰[M+Na]m/z
453.2976,确定该化合物的分子式为CHO(计算值为453.2975)。红外光谱在3427 cm处的吸收峰提示存在羟基信号,在1384,2973 cm处的吸收峰提示甲基的存在,在1640,933 cm处的吸收峰提示苯环的存在。H NMR(400 MHz,CDN)谱结合HMBC,HSQC,H-H COSY图谱(见图2),将氢信号归属为:δ
6.97(1H,d,J
=2.4 Hz,H-7),6.84(1H,d,J
=2.4 Hz,H-5),5.36(1H,t,J
=6.4 Hz,H-7'),5.24(1H,t,J
=6.4 Hz,H-3'),3.74(1H,m,H-11'),2.68(2H,m,H-4),2.62(1H,m,H-9'),2.34(1H,m,H-9'),2.30(3H,s,H-18'),2.21(2H,m,H-2'),2.17(2H,m,H-6'),2.07(2H,m,H-5'),2.05(1H,m,H-10'),1.81(1H,m,H-10'),1.75(1H,m,H-3a),1.74(1H,m,H-1'),1.68(3H,s,H-15'),1.67(1H,m,H-3b),1.64(3H,s,H-16'),1.63(1H,m,H-1'),1.51(3H,s,H-13'),1.48(3H,s,H-14')1.27(3H,s,H-17')。C NMR(100 MHz,DMSO-d
)谱 中共给出27个碳信号,归属为:δ
151.2(C-6)、145.2(C-8a)、135.7(C-8')、135.0(C-4')、126.9(C-8)、124.8(C-3')、124.4(C-7')、121.5(C-4a)、116.8(C-7)、113.7(C-5)、78.2(C-11')、75.2(C-2)、72.5(C-12')、40.0(C-5')、39.8(C-1')、37.5(C-9')、31.6(C-3)、30.7(C-10')、26.8(C-6')、25.9(C-13')、25.8(C-14')、24.0(C-17')、22.7(C-4)、22.4(C-2')、16.4(C-18')、16.2(C-15')、15.8(C-16')。此核磁数据与文献中化合物litchtocotrienol A的数据基本一致,故确定化合物的平面结构。根据ECD谱中215 nm处正Cotton效应(+15)和293 nm处负Cotton效应(-4.6)确定C-2的绝对构型为R
型。采用钼盐诱导ECD的方法确定C-11'位的绝对构型,此方法用来测定邻二醇类结构的绝对构型。根据ECD谱中特征的302 nm处的负Cotton效应确定C-11'位的绝对构型为R
。综合分析,鉴定化合物8为litchtocotrienol A。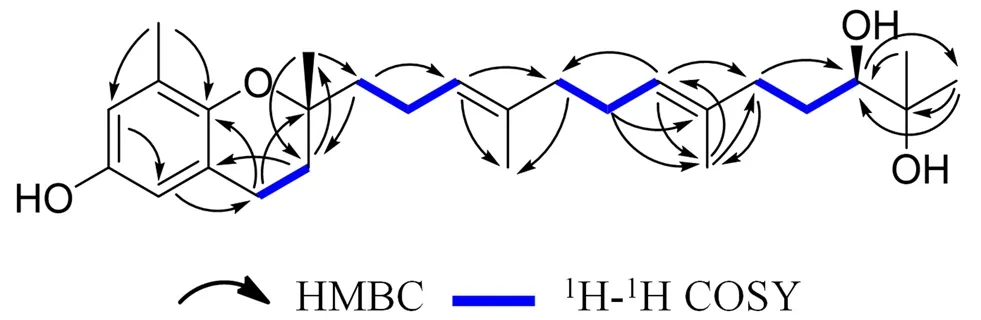
图2 化合物8的主要HMBC和COSY相关信号Fig 2 Key HMBC(H→C),and COSY correlation of compound 8
4 讨论
近年来藤黄属植物一直是天然药物领域研究的热点,其化学成分种类丰富,结构新颖,活性强,如黄酮、酮、间苯三酚、萜类等化合物。本文对长裂藤黄的化学成分进行了研究,从中分离得到8个化合物,丰富了藤黄属次级代谢产物的多样性,为探索藤黄属的化学成分提供了参考。从近几年分离得到的化合物的结构复杂性以及活性数据来看,藤黄属植物还有很大的研究发展空间,有待于进一步深入研究。
