地龙对肺炎支原体感染小鼠肺组织中表皮生长因子EGF表达的影响
2022-03-30梁明川蒙艳丽王晓溪王博徐慧星王欣王磊王伟明黑龙江省中医药科学院哈尔滨150036
梁明川,蒙艳丽,王晓溪,王博,徐慧星,王欣,王磊,王伟明(黑龙江省中医药科学院,哈尔滨150036)
肺炎支原体(mycoplasma pneumoniae,MP)是呼吸道传播和感染中最为常见的一种致病菌,在儿童群体中致病率较高。研究表明,MP感染可以直接造成肺呼吸道黏膜上皮细胞的损伤,是破坏肺组织结构完整,诱发多种肺部系统疾病的主要影响因素。所以修复受损的肺组织在MP感染的治疗中尤为重要。
表皮生长因子(epidermal growth factor,EGF)在支原体肺炎的治疗和呼吸道黏膜修复中的作用逐渐成为研究的热点。研究显示,EGF于1962年被首次发现。EGF存在于大多数体液分泌物及组织中,尤其在肺脏中EGF表达较高。EGF可以对多种组织的表皮细胞如呼吸道上皮细胞的增殖、分化和修复起重要作用,并能促进肺血管类疾病的发生、发展。实验表明,芩百清肺浓缩丸可通过调控小鼠肺组织中EGF的表达修复受损的肺上皮细胞。
Biacore分子互作检测实验基于表面等离子共振(surface plasmon resonance,SPR)技术,具有高灵敏度、免标记、实时监测、样品用量少等优点,在生物制药、新药研发等相关领域有着广泛的应用。徐明杭等通过Biacore实验钓取了芩百清肺浓缩丸中与TGF-β
1蛋白结合的亲和活性成分为黄芩苷,并通过亲和力实验进行验证。地龙又名蚯蚓,主要含有蚯蚓素、蚯蚓毒素、花生四烯酸等活性成分。当代研究表明,地龙对MP肺炎有较好的治疗作用。地龙可通过调控TGF与α
-SMA的表达来改善肺纤维化症状。本实验主要通过Biacore系统检测地龙与EGF蛋白体外是否存在有效结合,并应用MP感染动物模型,采用免疫组化(immunohistochemistry,IHC)、Western blot及RT-PCR实验进行体内验证,阐明地龙对小鼠肺组织EGF表达的影响,为地龙治疗MP感染的进一步研究和开发提供科学依据。1 材料
1.1 实验动物
60只8周龄BALB/c小鼠,雌雄各半。购自哈尔滨医科大学,饲养于黑龙江省中医药科学院实验动物中心,许可证编号SCXK(黑)2019-001。本研究中的动物实验得到了黑龙江省中医药科学院保护和使用委员会的批准(许可证号:[2011]93),依照《黑龙江省实验动物护理和使用指南》进行。采用人道主义方式脱颈椎处死实验动物。
1.2 试药
地龙药材购买自同仁堂香坊店,并由黑龙江省中医药科学院王伟明研究员鉴定为巨蚓科动物参环毛蚓的干燥完整体;TRIzol试剂(美国Invitrogen,批号:113604);一抗EGF(Bioss公司,批号:bs-0086R);EGF蛋白(Acro公司,批号:H525b);Biacore T200试剂盒、CM5芯片(GEHealthcare公司,批号:10280148);RT-PCR试剂盒(CWBIO公司,批号:29520),引物合成由上海Invitrogen公司完成。
1.3 仪器
Reverse Transcribe PCR仪 Tc-24/H(b)(中 国博日生物公司);KD-BM生物组织包埋机、KDTS3A自动组织脱水机(浙江科迪仪器设备公司)。
1.4 提取地龙原液
称取地龙饮片200.2 g,剪碎,用70%的乙醇回流提取两次,将两份提取液过滤并合并,调整相对密度为1.35(60℃)的浸膏,4℃冰箱保存备用。
2 方法
2.1 蛋白纯度检测
通过SDS-PAGE凝胶电泳检测EGF蛋白的纯度,EGF蛋白的相对分子质量为6.3 kDa。EGF用去离子水制备成200 mg·L的蛋白溶液,经过制胶、上样、电泳和切胶后,考马斯亮蓝染色2 h,再用脱色液进行脱色至背景完全清晰。使用凝胶成像仪对凝胶进行拍照并分析,与marker相对分子质量条带比较。
2.2 Biacore预富集实验
采用单一通道流通方式,将EGF蛋白偶联在2通道上,1通道作为参比通道。本实验室前期实验数据表明pH为4.0时的醋酸盐溶液偶联效果最好,故配制pH 4.0的醋酸盐溶液并各取97 μL与3 μL EGF蛋白(400 mg·L)配制蛋白溶液加入到无盖的1.5 mL离心管中。芯片结合采用氨基偶联方式,另取一个无盖的1.5 mL离心管加入200 μL氢氧化钠放置在指定位置上。设置偶联条件为温度25℃,进样60 s,流速10 μL·min,0.05 mol·LNaOH再生30 s进行预结合实验,观察RU值(Resonance unit,响应单位)。
2.3 Biacore配体偶联实验
取100 μL EDC与100 μL NHS混合均匀,以活化芯片表面。量取140 μL乙醇胺将1通道封闭。用pH 4.0醋酸钠缓冲液180 μL+EGF 20 μL(400 mg·L)配制蛋白溶液,蛋白以脉冲进样的方式结合到芯片表面,芯片表面结合不牢的蛋白使用PBS缓冲液冲洗掉。偶联时间设置为600 s,流速为10 μL·min。
2.4 地龙原液与EGF蛋白结合实验
用PBS配制质量浓度为4.8 g·L的地龙蛋白原液。进样程序:进样速度10 μL·min,进样时间60 s,等待时间60 s,再生30 s。从Biacore输出的传感图结果中观察和分析RU值。
2.5 体内动物实验
2.5.1 MP培养 在无菌环境下复苏MP,培养在含胎牛血清的PPLO培养基中,37℃孵箱培养,每日观察,直至培养基变黄,按1∶9比例传代。
2.5.2 建立MP感染模型 将60只小鼠雌雄分笼混养,适应性饲养7 d后,随机分为6组,分别为空白组,模型组,阳性对照组(阿奇霉素),地龙高、中、低剂量组,每组10只。除空白组外,各组小鼠连续3 d以鼻滴入的方式给药20 μL 1×10CCU MP培养液,MP感染成功后,阳性对照组(阿奇霉素22.5 mg·kg),地龙高(4.7 g·kg)、中(2.35 g·kg)、低(1.175 g·kg)剂量组,每日灌胃给药1 mL,共10 d,空白组与模型组每日灌胃给予同等剂量的生理盐水。10 d后脱颈椎处死小鼠,取小鼠肺组织于-80℃保存,备用后续实验。
2.5.3 HE染色观察肺组织形态变化 取各组小鼠新鲜的左肺组织提前用甲醛固定过夜后,石蜡包埋。在-20℃冰冻4 h后,使用组织切片机将组织切成厚度为5 μm的切片,使用HE染色试剂盒进行操作,树脂封片。置于室温通风处晾干2 h,在显微镜下观察肺组织形态并拍照记录。
2.5.4 IHC法检测肺组织中EGF的表达 取各组小鼠右肺组织用自动石蜡包埋机包埋,切成厚度为5 μm的切片。使用免疫组化试剂盒说明书进行操作。树脂封片后,20×光镜下显微镜观察EGF的表达,采用Image J分析软件分析图像,计算EGF的平均光密度值(OD
值),对结果进行半定量分析。2.5.5 Western blot实验检测肺组织中EGF蛋白表达水平 取各组小鼠右肺组织提取组织蛋白,检测蛋白浓度,15% SDS-PAGE电泳,EGF蛋白分子量约为6 kDa,切胶范围为0~11 kDa,转PVDF膜,Rabbit anti-EGF抗 体1∶1000稀 释,4℃孵化整夜,山羊抗兔二抗室温避光封闭孵化60 min,ECL显影液封闭2 min。使用凝胶成像分析仪进行显影,而后用凝胶图像处理软件Image J定量分析目标条带的灰度值,以β
-actin蛋白对目的蛋白进行标准化,分析蛋白变化差异。2.5.6 RT-PCR法检测肺组织中EGF mRNA表达水平 提取各组小鼠左肺组织中的总mRNA,酶标仪检测RNA浓度。EGF引物委托上海Invitrogen公司进行合成。使用一步法RT-PCR试剂盒步骤对目的基因进行扩增。引物基因序列:上游5'-GTCACCCACAGAAACAAT-3',下游5'-AGGAGCGAACCTACTAAA-3';β
-actin F:5'-GACGGCCAGGTCATCACTATTG-3',R:5'-AGGAAGGCTGGAAAAGAGCC-3'。采用2分析方法,计算目的基因的表达量。2.6 统计学方法
采用SPSS 26统计学软件进行结果分析,数据以±s 表示,单因素方差分析方法分析组间差异,以P
<0.05为差异有统计学意义。3 结果
3.1 蛋白纯度
通过图1可以看出,目的蛋白EGF条带清晰对应相对分子质量在0~11 kDa,符合EGF分子量范围。EGF蛋白说明书表明蛋白纯度大于0.95,符合Biacore操作要求,可用于后续操作。

图1 EGF蛋白纯度检测Fig 1 Purity detection of EGF protein
3.2 EGF蛋白偶联实验
应用pH 4.0的醋酸盐溶液缓冲液结果显示目的蛋白EGF与CM5芯片的偶联值达到616.6,表明EGF蛋白成功与芯片偶联,见图2。

图2 Biacore实验中EGF蛋白与芯片偶联Fig 2 EGF protein and chip couple in Biacore experiment
3.3 地龙与EGF结合实验
由图3中可知,蛋白2通道曲线始终高于参比1通道,峰2(地龙)的binding值与基线有较高差值,表明地龙药液与EGF蛋白在体外可以有效结合。

图3 Biacore实验地龙与EGF蛋白结合Fig 3 Binding of earthworm to EGF protein in Biacore experiment
3.4 肺组织HE染色
肺组织HE染色见图4。空白组肺组织HE染色结果显示肺泡组织结构清晰,肺泡壁完整;与空白组相比,模型组小鼠肺组织肺泡间隔增厚或被破坏,有大量炎性细胞浸润,支气管上皮脱落。地龙各剂量组给药后,可见炎性细胞减少,地龙中、高剂量组仅有少量炎性细胞,肺泡结构清晰完整,表明地龙中、高剂量组可有效改善MP感染症状。

图4 BALB/c小鼠肺病理学观察(×20)Fig 4 Pathological observation of lung in BALB/c mice(×20)
3.5 IHC法检测地龙对肺组织EGF蛋白表达的影响
由图5、6可知,与空白组比较,模型组OD
值有所降低(P
<0.05);与模型组比较,地龙低、中、高剂量组OD
值均升高(P
<0.05),其中地龙中、高剂量组OD
值升高显著,EGF着色点增加明显,表明地龙中、高剂量组可显著增加肺组织中EGF的表达。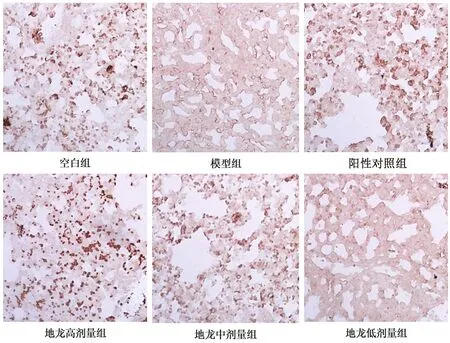
图5 地龙对肺组织EGF蛋白表达的影响(×20)Fig 5 Effect of earthworm on EGF protein expression in lung tissue(×20)

图6 各组小鼠肺组织EGF蛋白表达OD值Fig 6 OD value of EGF protein expression in lung tissue of mice in each group
3.6 Western blot检测地龙对肺组织EGF蛋白表达水平的影响
如图7所示,与空白组比较,模型组EGF蛋白水平明显下降(P
<0.05)。与模型组比较,地龙中、高剂量组EGF蛋白表达均升高(P
<0.05)。
图7 地龙对肺组织中EGF蛋白表达的影响Fig 7 Effect of earthworm on the expression of EGF protein in the lung tissue
3.7 地龙对肺组织 EGF mRNA 表达的影响
图8显示,与空白组比较,模型组小鼠EGF mRNA表达显著降低(P
<0.05);与模型组比较,模型小鼠经地龙给药治疗后,地龙中、高剂量组小鼠的EGF mRNA表达水平明显增加(P
<0.05)。
图8 地龙对肺组织EGF mRNA表达的影响Fig 8 Effect of earthworm on EGF mRNA expression in lung tissue
4 讨论
MP是引发呼吸系统感染的常见致病菌,潜伏期通常为14~21 d,严重感染时会发展为MP肺炎。目前关于MP肺炎致病机制仍不十分明确,如不及早干预,会导致病情恶化,引发其他呼吸道疾病。临床上,阿奇霉素对治疗小儿支原体肺炎具有较好的疗效,是治疗MP感染的常用药物,但近年关于阿奇霉素的不良反应报道逐渐增多,阿奇霉素长期静脉滴注会引发胃肠反应、局部疼痛等,急需寻找新的治疗药物。地龙作为一味应用广泛的动物类中药,在现代临床常用于治疗肺部疾病。研究表明,地龙可显著降低MP感染小鼠IFN-γ
、IL-6水平。本实验中HE染色表明,地龙中、高剂量组能修护受损的肺组织,改善MP感染造成的肺组织结构异常损害。EGF具有较强的促进细胞分裂作用,在体内外刺激多种组织及细胞的增殖、分化,并通过自分泌和旁分泌等多种方式调节呼吸道上皮细胞的分化及成熟。其修复功能可能与线粒体的运转功能有关,EGF可以使受损的表皮细胞代谢加快,运动活性增强,老化的组织及细胞得到更新。研究表明EGF对胎儿肺成熟有促进作用以及有助于消除成人肺水肿。EGF可调控成年大鼠肺泡Ⅱ型的细胞增生,促进肺部的生长发育。目前关于治疗MP引起的肺损伤的相关研究较少,也并无阿奇霉素通过调控EGF蛋白治疗MP感染的相关报道。故本研究基于EGF蛋白探究地龙治疗MP的作用机制,进一步开发治疗MP感染的中药新药。本课题组前期大量实验表明应用Biacore实验技术可有效在体外预测药物与靶蛋白的结合效果,本实验通过Biacore实验证实了在体外地龙可与EGF蛋白存在稳定结合。IHC、Western blot及RT-PCR体内药效学实验表明,地龙中、高剂量组能明显提高EGF蛋白和mRNA的表达,表明地龙可通过调控EGF的表达水平,改善MP感染症状,阐明了地龙治疗MP感染的作用机制。但与模型组相比,阿奇霉素阳性对照组对EGF蛋白和mRNA的表达没有明显统计学差异,原因可能为阿奇霉素并不能通过调控EGF蛋白发挥治疗MP感染的作用。
本研究显示,地龙可通过提高EGF的表达,修复受损伤的肺组织,改善MP感染引起的呼吸道症状,进一步阐明了地龙治疗MP感染的作用机制,为中药新药研制提供了一种创造性的思路。但地龙药材中化学成分复杂,与EGF蛋白结合的具体单体成分还需进一步研究。
