共载GNA和PLHSpT脂质立方液晶纳米粒的制备、表征以及体外抗肿瘤活性研究
2022-03-30魏晴林彤远王强王雷陈卫东安徽中医药大学药学院合肥23002华东师范大学附属芜湖医院芜湖二院药剂科安微芜湖2400中药复方安徽省重点实验室合肥23002安徽省中医药科学院药物制剂研究所合肥23002
魏晴,林彤远,2,王强,王雷,3,4,陈卫东,3,4*(. 安徽中医药大学药学院,合肥 23002;2.华东师范大学附属芜湖医院(芜湖二院),药剂科,安微 芜湖 2400;3. 中药复方安徽省重点实验室,合肥 23002;4. 安徽省中医药科学院药物制剂研究所,合肥 23002)
癌症发病隐匿,大部分癌症患者明确诊断时已属进展期,错过了最佳手术时间,这部分患者主要依赖于化疗药物治疗。但是大多数化疗药物本身不具有肿瘤特异性,通过静脉全身给药,杀伤肿瘤细胞的同时,对正常细胞也有较大的毒性,甚至会破坏免疫系统,这些因素阻碍了化疗药物在临床上的广泛应用。为提高化疗药物的水溶性及靶向性,降低毒副作用,纳米载药体系应运而生。近年来,纳米技术的发展为解决药物稳定性低、水溶性差、半衰期短、选择性低等问题提供了新的思路和突破点。脂质立方液晶作为新兴载药体系逐渐受到关注,脂质立方液晶纳米粒作为纳米载体一个新兴的分支,其具有生物可降解性、避免药物发生化学和生理降解以提高药物稳定性、控制药物释放等特点。适用于各种药物的包载,包括小分子药物、多肽、蛋白质和核酸等。除此以外,脂质立方液晶纳米粒的特殊空间结构,使其具有可同时包载亲脂性和亲水性药物的潜力。
中药藤黄是藤黄科植物藤黄所分泌出的干燥树脂,新藤黄酸(gambogenic acid,GNA,CHO)(结构式见图1A)是中药藤黄中的主要抗肿瘤化学成分之一,其对多种肿瘤细胞都有不同程度的抑制作用。新藤黄酸的抗肿瘤作用是通过诱导细胞凋亡、阻滞细胞周期进展和抑制肿瘤血管生成而产生的,其可以抑制细胞周期蛋白依赖激酶催化活性位点,阻断细胞周期G/G期,直接杀伤肿瘤细胞。其抗肿瘤活性强且确切,对肺癌、胰腺癌、肝癌、乳腺癌、胃癌等都具有较好的疗效,对正常动物造血系统和免疫功能不产生或很少产生影响。然而其水溶性差、体内消除快、静脉给药血管刺激性强、生物利用度低等缺陷,严重限制了其在临床上的广泛应用。
PLHSpT(结构式见图1B)是一种含磷酸化的丝/苏氨酸的多肽序列,与乳腺癌特异性靶点Polo样激酶1(polo-like kinase 1,PLK1)特异性高亲和(K
=0.45±0.11 μmol·L)。PLK1作为肿瘤确诊以及肿瘤愈后重要的标记物之一,在正常细胞中低表达甚至不表达,而在乳腺癌甚至晚期乳腺癌脑转移过程中高表达。因此,PLHSpT可作用于PLK1来阻滞肿瘤细胞使其停留在有丝分裂的G/M期,进而导致肿瘤细胞凋亡。但PLHSpT体内稳定性差、穿膜能力差。新型的磷酸化多肽类药物联合传统的中药单体同时使用,能够显著增强肿瘤细胞对药物的敏感性,增加协同抗肿瘤的效果。PLHSpT与GNA两种药物对肿瘤细胞的杀伤原理截然不同,两者作用于肿瘤细胞周期的不同阶段及代谢途径,可多种途径共同起到协同抗肿瘤的效果。本研究旨在制备共载GNA与PLHSpT的脂质立方液晶纳米粒[Cubs-(GNA+PLHSpT)],并对其理化性质及体外药效学进行研究。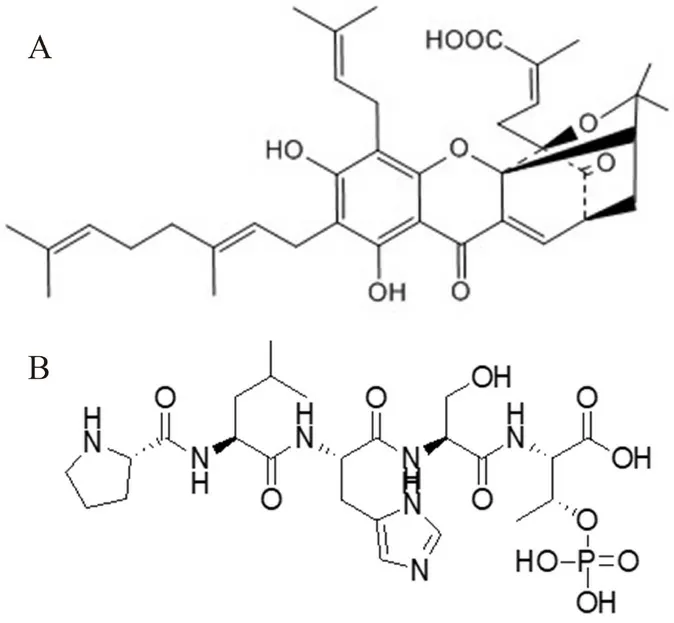
图1 GNA的结构式(A)和PLHSpT的结构式(B)Fig 1 Structure formula of GNA(A)and PLHSpT(B)
1 材料
1.1 仪器
岛津LC-15C高效液相色谱仪、SPD-15C紫外检测器(日本岛津公司);AB135-S 型十万分之一电子分析天平(德国 Mettler Toledo公司);DF-101B集热式恒温磁力搅拌器(金坛市鑫鑫实验仪器厂);LC-4016低速离心机(安徽中科中佳科学仪器有限公司);Zetasizer3000HS型激光粒度仪(英国Malvern公司);Hitachi-HT7700透射电镜(上海沪西分析仪器厂有限公司);KQ-300B型超声波清洗器(昆山市超声仪器有限公司);DZF-6050型真空干燥箱(上海傅讯实业有限公司);ESCO二氧化碳培养箱(新加坡 Esco 公司);Cascada超纯水仪(美国PALL 公司)。
1.2 试药
GNA对照品(纯度≥ 98%,由安徽中医药大学药学院GNA课题组提供);PLHS-PThr-NH2(PLHSpT)(纯度≥95%,上海沐晋生物科技有限公司);泊洛沙姆407(p407)(BASF公司);单油酸甘油酯(GMO)(天津希恩思生化科技有限公司);无水乙醇(上海润捷化学试剂有限公司);甘露醇(阿拉丁试剂公司);色谱甲醇(瑞典Oceanpak公司);胎牛血清(Gibco公司);DMEM培养基(赛百慷上海生物科技股份有限公司);青霉素-链霉素溶液、0.25%胰酶、MTT(Biosharp公司)。
1.3 细胞
乳腺癌SK-BR-3 细胞购自中国科学院上海细胞所。
2 方法与结果
2.1 [Cubs-(GNA+PLHSpT)]的制备
基于实验室前期研究基础,采用乳化蒸发-低温固化法制备[Cubs-(GNA+PLHSpT)]。即将适量GNA和GMO在60℃的水浴中完全溶解于5.00 mL无水乙醇中,得到有机相。将处方比例的磷酸化五肽和泊洛沙姆407溶于定量水中,水浴加热到与油相相同温度构成水相。然后在搅拌的条件下,于水浴中用1 mL注射器缓慢匀速将生成的有机溶液注入水溶液中,继续搅拌直至有机溶剂挥发完全得到均匀乳状液,在搅拌条件下将热乳液倒入适量冰水中冰浴,待其在冰水中完全分散即得淡黄色澄清透明脂质立方液晶纳米粒。
2.2 单因素考察及正交试验
影响脂质立方液晶纳米粒的制备因素很多,如乳化温度与时间、固化温度与时间、转速、GNA与PLHSpT的比例等。根据实验室前期研究基础,在原有处方基础上以外观、粒径、粒径分布和包封率作为考察指标,考察GNA与PLHSpT不同比例、搅拌速度、GNA加入量、药脂比等对载药体系的影响,筛选[Cubs-(GNA+PLHSpT)]脂质立方液晶纳米粒的最优处方。
2.2.1 GNA与PLHSpT质量比筛选 将水溶性磷酸化五肽作为水相加入反应体系中,在固定其他条件不变的情况下,以粒径、粒径分布、外观、包封率为考察指标。考察不同质量比(m∶m=1∶1,2∶1,4∶1,6∶1,8∶1,10∶1,12∶1)下[Cubs-(GNA+PLHSpT)]的制备情况。结果GNA与PLHSpT不同质量比对[Cubs-(GNA+PLHSpT)]的PDI影响较小,对其外观、粒径与包封率有明显影响,综合考虑选择8∶1~12∶1较为适宜。
2.2.2 搅拌速度的选择 在固定其他条件不变的情况下,仅改变转速的大小,选择搅拌速度分别为400、800、1000 r·min制备[Cubs-(GNA+PLHSpT)]溶液,以粒径、粒径分布、外观、包封率作为考察指标,结果搅拌速度为400 r·min时粒径、粒径分布、外观及包封率均不理想;搅拌速度为800、1000 r·min时外观无较明显差别,但受粒径与包封率的影响较大,当转速为1000 r·min时,其粒径较小、分散性较好、包封率较高,故选择搅拌速度为1000 r·min。
抓斗式清淤是指利用抓斗式挖泥船开挖河底淤泥,但淤泥清除率只能达到30% 左右,很难改善水质。绞吸式清淤挖泥、输泥和卸泥都是一体化完成,施工精度较高,不会出现淤泥泄露的问题,缺点是容易出现回淤问题,清淤效率并不高。水上挖掘机清淤可悬浮在浮泥或水上自由行走,被广泛使用于河道清淤和水域治理、资源开发、环境整治等复杂的工程中。新一代的水上挖掘机能在水深5m的狭窄区域内进行清淤作业,但其缺点也较为明显,不能输送淤泥,清淤效率较低。
2.2.3 GNA加入量的选择 在固定其他制备条件不变的情况下,改变GNA加入量(5、8、10 mg)制备[Cubs-(GNA+PLHSpT)]溶液,以粒径、粒径分布、外观、包封率作为考察指标,考察不同GNA加入量对[Cubs-(GNA+PLHSpT)]的影响。结果当GNA加入量逐渐增大时,其平均粒径与PDI也逐渐增大,包封率随之减小,所制备的[Cubs-(GNA+PLHSpT)]乳液透明度亦随之降低,蓝色乳光消失,故选择5~6.5 mg进行后续考察。
2.2.4 药脂比的选择 在固定其他制备条件不变的情况下,选择药脂比1∶10、1∶20、1∶30、1∶40制备[Cubs-(GNA+PLHSpT)]溶液,以粒径、粒径分布、外观、包封率作为考察指标,结果粒径分布对药脂比影响较小,随着药脂比的增加,粒径与包封率有一定变化,当药脂比过大时很不稳定,溶液较浑浊,放置一段时间会有沉淀产生,综合比较药脂比在1∶20~1∶30较佳。
2.2.5 综合加权评分法综合评价[Cubs-(GNA+PLHSpT)]的处方 以单因素考察的结果为基础,分别选择m∶m比例(A)、药脂比(w/w
)(B)、GNA加入量(C)、空白因素(D),按正交试验表L(3)试验方案考察各因素对包封率和粒径的影响。最佳工艺条件要满足包封率高、粒径小的特点,因此采用综合加权评分法考察最优工艺条件,考虑到包封率对制剂影响大于粒径,因此包封率与粒径的权重比分别为60%、40%,即GNA包封率(EE
)、PLHSpT包封率(EE
)、粒径分别按30%、30%、40%的权重系数计分,综合评分标准为:Y
=Y
/Y
×30%+Y
/Y
×30%-Y
/Y
×40%,即综合评分总分等于各项指标与各项指标最大值之比乘以各指标加权系数之和。正交设计各因素水平见表1,加权评分结果及方差分析见表2~3。表1 因素水平表
Tab 1 Factor and level of orthogonal experiment
水平 因素A B C D 1 8∶1 15% 5.0 -2 10∶1 20% 5.5 -3 12∶1 25% 6.5 -
表2 正交设计与综合评分结果
Tab 2 Orthogonal design and comprehensive scoring results
试验号 因素 EE1/% EE2/% 粒径/nm综合评分A B C D 1 1 1 1 1 73.80 70.98 139.43 18.86 2 1 2 2 2 87.54 85.68 136.21 29.28 3 1 3 3 3 79.96 76.75 138.56 23.12 4 2 1 2 3 74.61 72.39 137.70 20.00 5 2 2 3 1 89.12 86.65 134.65 30.49 6 2 3 1 2 74.40 72.26 130.20 21.53 7 3 1 3 2 72.48 68.59 176.73 9.41 8 3 2 1 3 87.66 85.67 157.00 24.76 9 3 3 2 1 76.90 76.85 182.50 12.49 K1 23.7516.0921.72 K2 24.0128.1820.59 K3 15.5619.0521.01极差 8.4512.09 1.13
由表2可知,各因素影响主次顺序为B>A>C,由表3可知,B因素有显著性意义。因此,综合分析以包封率和粒径为考察指标得到的评分结果,确定[Cubs-(GNA+PLHSpT)]最佳处方工艺条件为ABC,即m
∶m
为10∶1,药脂比(w/w
)为20%,GNA加入量为5 mg,搅拌速度为1000 r·min。表3 方差分析表
Tab 3 Variance analysis
注:(2,2)=19.00,(2,2)=99.00。
方差来源 偏差平方和 自由度 F值 F临界值 显著性A 138.76 2 12.77 19.00 P>0.05 B 238.19 2 21.92 19.00 P<0.05 C 1.95 2 0.18 19.00 P>0.05
2.3 [Cubs-(GNA+PLHSpT)]的质量评价
2.3.1 外观考察 由图2可知,所制备的空白立方液晶纳米粒外观带有淡蓝色乳光的澄清透明液体,没有沉淀或絮凝,而[Cubs-(GNA+PLHSpT)]则呈现黄色。

图2 空白立方液晶纳米粒(左)和[Cubs-(GNA+PLHSpT)](右)的外观Fig 2 Appearance of the blank Cubs(left)and [Cubs-(GNA+PLHSpT)](right)
2.3.2 形态学考察 取适量纳米乳液滴加于有碳膜的铜网上,静候30 min用滤纸吸去多余纳米乳液,并用2.0%的磷钨酸溶液负染约2 min,自然晾干后置于透射电镜下观察[Cubs-(GNA+PLHSpT)]的外观形态,结果见图3。从图3可以看出,制备的[Cubs-(GNA+PLHSpT)]近似圆形,稍立体,粒子与粒子之间无粘连。

图3 [Cubs-(GNA+PLHSpT)]的透射电镜图Fig 3 Transmission electron microscopy of [Cubs-(GNA+PLHSpT)]
2.3.3 平均粒径与Zeta电位 取适量的[Cubs-(GNA+PLHSpT)]用超纯水稀释30倍,在室温条件下用纳米激光粒度仪分别测定其粒径和Zeta电位。由图4可知,本试验制备的[Cubs-(GNA+PLHSpT)]平均粒径为(133.7±0.57)nm,多分散 系 数PDI为(0.171±0.01),Zeta电 位 为(-12.40±0.41)mV,表明本试验所制备的脂质立方液晶纳米粒粒径较小,粒径分布的范围较窄,Zeta电位绝对值小于30 mV。

图4 [Cubs-(GNA+PLHSpT)]的粒径分布图(A)及Zeta电位图(B)Fig 4 [Cubs-(GNA+PLHSpT)] particle size distribution(A)and Zeta potential(B)

图5 6种样品的DSC图Fig 5 DSC map of 6 samples
EE
%=M
/M
×100%EE
%=(W
-W
)/W
×100%式中M
、M
、W
、W
分别为过柱后脂质立方液晶纳米粒内被包封GNA的质量、分散体系中总GNA的质量、游离PLHSpT的含量、脂质立方液晶纳米粒中总PLHSpT的含量。依据公式计算可知,本试验中所制备的[Cubs-(GNA+PLHSpT]中EE
为(89.70±0.39)%,EE
为(87.74±0.71)%。2.3.6 体外释放
① 色谱条件:岛津LC-15C高效液相色谱仪、SPD-15C紫外检测器(日本岛津公司);色谱柱:COSMOSIL C柱(4.6 mm×250 mm,5 μm);柱温:30℃;流速:1.0 mL·min;进样量:20 μL;流动相:甲醇-0.1%磷酸水溶液(90∶10,V/V
);检测波长:360 nm。② 释放介质:根据实验室前期的基础,选择pH=7.4的磷酸盐缓冲液作为释放介质,添加1%的吐温80作为增溶剂,对[Cubs-(GNA+PLHSpT)]载药体系的体外释放行为进行初步考察。
③ 标准曲线:取适量的GNA对照品溶液,加PBS溶液(含1%的吐温80)制备成不同浓度的对照品溶液,12 000 r·min离心10 min,取上清液,进样测定。以峰面积(y
)为纵坐标、质量浓度(x
)为横坐标作标准曲线图进行线性拟合,得到GNA 线性回归方程:y
=1.06×10x
-2.64×10(R
=0.9997,n
=8),结果表明GNA在1.0~64.0 μg·mL与峰面积线性关系良好。④ 体外释放研究:本试验采用透析法(21 mm,8000~14 400 Da)对等量的GNA溶液以及[Cubs-(GNA+PLHSpT)]体外释放性能进行考察,以GNA溶液为对照。分别取等量的GNA溶液以及[Cubs-(GNA+PLHSpT)]置于预先处理好的透析袋中,然后将透析袋浸入相同的释放介质中,在37℃下以200 r·min搅拌。在预定的时间点各取样1 mL,同时补加等量释放介质,12 000 r·min离心10 min,取上清液进样后测定,按以下公式计算累计释药百分比(Q
)并绘制累计释放曲线,如图6所示。游离GNA在释放介质中释放迅速,8 h后几乎释放完全,累计释放率达99.63%;[Cubs-(GNA+PLHSpT)]载体中药物的释放前12 h快速释放,12 h后释放趋于平缓,在24 h内累计释放率为72.26%。
图6 GNA及[Cubs-(GNA+PLHSpT)]的体外释药曲线Fig 6 In vitro release profile of GNA solution and [Cubs-(GNA+PLHSpT)]
Q
={CV
+(C
+C
+…+C
)V
}/M
×100%其中,C
,C
,C
,C
分别为第1,2,i
-1,i
等时间点释放介质中GNA的浓度;V
表示释放介质总体积;V
表示所取样品的体积。2.4 [Cubs-(GNA+PLHSpT)]体外抗肿瘤活性研究
2.4.1 细胞培养 将人乳腺癌细胞株SK-BR-3细胞培养于含有10%胎牛血清、1%青霉素-链霉素混合液的DMEM(含1.5 g·LNaHCO)培养基的透气培养瓶中,置于饱和湿度二氧化碳培养箱中培养(37℃,5%CO),24~48 h后更换培养液继续培养(具体时间视细胞生长状态以及培养基状态而定),待细胞密度达70%~90%(约培养3~5 d),即按1∶2的比例进行传代培养。
2.4.2 体外抗肿瘤评价 细胞分为调零组,对照组,空白纳米立方液晶、游离GNA、游离PLHSpT、PLHSpT-Cubs、GNA-Cubs、[Cubs-(GNA+PLHSpT)]给药组。
将生长状态优良的SK-BR-3细胞消化,制成单细胞悬液并计数以备用,以1×10个/孔,每孔悬液体积为200 μL,接种至96孔板内,照分组及浓度梯度的数量铺板,剩余空白孔铺满PBS(避免边缘效应),培养箱孵育24 h后,实验组各孔(每个药物不同浓度各设6个复孔)加入对应药物,37℃孵育36 h,吸去旧培养基,每孔加入200 μL新鲜培养基及20 μL含5 mg·mLMTT的DMEM混合液,继续培养4 h,吸去培养基,每孔加入150 μL二甲基亚砜(DMSO),摇床恒温(37℃)充分避光震荡10 min,使反应生成的紫蓝色结晶物充分溶解,在自动酶标仪上以490 nm波长测定实验孔每孔OD
值,计算细胞存活率(%)和半抑制浓度(IC
),结果游离GNA、游离PLHSpT、PLHSpT-Cubs、GNA-Cubs、[Cubs-(GNA+PLHSpT)]的IC
分别为(14.33±0.59)、(15.67±0.68)、(9.03±0.41)、(6.73±0.22)、(3.46±0.11)μg·mL,结果见图7。
图7 不同浓度制剂(A)以及游离药物(B)对SK-BR-3 细胞存活率的影响(Mean±SD,n=3)Fig 7 Effect of different agent concentrations(A)and different concentrations of free drugs(B)on the survival rate of SK-BR-3 cells(B)(Mean±SD,n=3)
由图7可知,与游离GNA和游离PLHSpT相比,空白脂质立方液晶纳米粒毒性较低,对细胞影响较小,游离GNA对SK-BR-3细胞的抑制作用优于游离PLHSpT。与单独载GNA或PLHSpT的纳米立方液晶相比,[Cubs-(GNA+PLHSpT)]对SKBR-3细胞的的细胞抑制效果更明显,对 SK-BR-3细胞的IC
值最小,为(3.46±0.11)μg·mL,抑制效果是游离GNA的4.14倍,游离PLHSpT的4.52倍,GNA-Cubs的1.95倍,PLHSpT-Cubs的2.61倍。[Cubs-(GNA+PLHSpT)]对细胞抑制率随GNA浓度增大而增大,说明同时包载GNA和PLHSpT的脂质立方液晶纳米粒能发挥协同作用,其体外抗肿瘤效果最好。3 讨论
本研究采用高温乳化蒸发-低温固化法制备了同时包裹GNA与PLHSpT的脂质立方液晶纳米粒[Cubs-(GNA+PLHSpT)],通过单因素与正交试验确定最优处方,得到粒径较小,分布均匀,理化特性理想的脂质立方液晶。并通过外观、类型、粒径、多分散系数、透射电镜、DSC等方法对其进行了系统的表征。结果表明,最优处方下的[Cubs-(GNA+PLHSpT)]平均粒径为(133.7±0.57)nm,多分散系数PDI为(0.171±0.01),Zeta电位为(-12.40±0.41)mV;GNA和PLHSpT包封率分别为(89.70±0.39)%和(87.74±0.71)%。透射电镜显示[Cubs-(GNA+PLHSpT)]呈球形或者类球形,DSC分析结果亦验证了确有新的物相生成。体外释药曲线表明,与游离GNA相比,[Cubs-(GNA+PLHSpT)]具有明显的缓释效果。MTT法检测[Cubs-(GNA+PLHSpT)]对 SK-BR-3 细胞有明显的增殖抑制作用,初步证明了脂质立方液晶纳米粒可以增强GNA对肿瘤的抑制作用。
对传统载药系统而言,本实验借助脂质立方液晶纳米粒同时包载PLHSpT及GNA,提高了PLHSpT的体内稳定性、细胞穿膜能力,同时也延长了GNA体内半衰期、增加了体内生物利用度、减少了其对血管的刺激性。对乳腺癌而言,新型肽类药物PLHSpT与中药GNA单体可通过不同作用机制实现抗肿瘤作用,两种药物联合应用有望使该复方脂质立方液晶纳米粒载药体系对乳腺癌细胞的杀伤力增加,提高抗肿瘤效果,为后续研究提供一定理论基础。
