LncRNA HOTAIR 对宫颈癌Hela细胞增殖、凋亡和EMT的影响和作用机制*
2022-03-29陈文婷黄丽珊曾带娣陈志萍吴志喜
陈文婷,黄丽珊,曾带娣,陈志萍,吴志喜
南方医科大学附属东莞医院/东莞市人民医院妇产科,广东东莞 523000
宫颈癌是较常见的妇科癌症之一。据统计,全球每年有30多万人死亡,其中85%以上发生在发展中国家,尽管近年来宫颈癌的手术、化疗、放疗等治疗取得了很大的进展,但宫颈癌的临床疗效仍然较差[1]。因此,寻找新的生物标志物和治疗靶点对提高宫颈癌的诊断和治疗至关重要。长链非编码RNA(LncRNA)是一种转录本超过200个核苷酸,没有蛋白编码功能的特殊RNA 分子,LncRNA 与多种疾病及肿瘤的发生发展密切相关[2]。有报道称,LncRNA 能够广泛参与生物体的各种生理及病理过程,如表观遗传学调控,以及神经系统功能的构建等[3]。有研究证实,LncRNA MEG3 具有抗宫颈癌的作用[4];LncRNA PANDAR 表达上调预示宫颈癌预后不良并促进细胞增殖[5]。LncRNA HOTAIR 是一种保守的LncRNA,其在不同的癌症中发挥了重要的生物学功能。有学者发现,LncRNA HOTAIR 可增强雄激素受体介导的转录程序,驱动去势抗性前列腺癌[6]。LncRNA HOTAIR 增强雌激素受体信号,并在乳腺癌中导致他莫昔芬耐药[7]。然而,LncRNA HOTAIR在宫颈癌细胞中的表达和生物学功能尚不清楚。本研究通过分析LncRNA HOTAIR 在宫颈癌细胞中的表达模式,研究其生物学功能,探讨宫颈癌的发病机制,为该病的治疗提供依据。
1 材料与方法
1.1 材料 宫颈癌细胞(Hela细胞)和人永生化宫颈上皮细胞(H8 细胞)购自上海富衡生物科技有限公司。宫颈癌组织和癌旁正常组织(各53例)均来自本院2020年2—12月确诊的患者,经过患者、家属同意及伦理委员会批准后,进行采集和保存。DMEM 培养基购自北京索莱宝科技有限公司。PrimeScriptTMⅣ1st Strand cDNA Synthesis Mix、SYBR Premix Ex Taq试剂盒购自武汉赛培生物科技有限公司。双荧光素酶活性检测试剂盒购自北京百奥莱博科技有限公司。HOTAIR 小干扰RNA(siRNA)、miR-20a-5p inhibitor、miR-20a-5p mimics、KIF26B siRNA 等质粒由Genepharma公司合成。Turbofect购自美国Invitrogen公司。点突变试剂盒购自天根生化科技(北京)有限公司。Bax、Bcl-2 多克隆抗体购自美国圣克鲁斯公司。
1.2 方法
1.2.1 细胞培养 Hela细胞和H8 细胞在添加含10%胎牛血清和1%抗菌药物/抗真菌溶液中培养,放置于37 ℃,5% CO2湿润培养箱中,待达到90%浓度后收集细胞,用于后续试验。
1.2.2 细胞转染 用指数期Hela细胞进行转染。转染前,将细胞接种于12孔板,采用2 mL 完全培养基培养24 h,直至90%的融合。用Turbofect试剂将质粒转染到Hela细胞系中,并按说明用Opti-MEM无血清培养基培养,收集培养后细胞进行后续试验。培养的Hela 细胞分为以下转染组:(1)siRNA NC组、HOTAIR siRNA 组、KIF26B siRNA 组;(2)inhibitor NC 组、miR-20a-5p inhibitor组;(3)pcDNA-3.1(+)+mimics NC组、pcDNA-HOTAIR+mimics NC 组、pcDNA-3.1(+)+miR-20a-5p mimics 组、pcDNA-HOTAIR+miR-20a-5p mimics组;(4)HOTAIR wt+mimics NC 组、HOTAIR wt+miR-20a-5p mimics组、HOTAIR mut+mimics NC 组、HOTAIR mut+miR-20a-5p mimics 组;(5)KIF26B wt+mimics NC组、KIF26B wt+miR-20a-5p mimics组、KIF26B mut+mimics NC 组、KIF26B mut+miR-20a-5p mimics组;(6)siRNA NC+inhibitor NC组、HOTAIR siRNA+inhibitor NC组、siRNA NC+miR-20a-5p inhibitor 组、HOTAIR siRNA+miR-20a-5p inhibitor组。(1)组、(2)组、(6)组转染组细胞用于实时定量PCR 检测;(1)组、(2)组、(3)组转染组细胞用于细胞活力、凋亡率和Western blot检测;(4)组、(5)组转染组细胞用于双荧光素酶报告基因活性检测。
1.2.3 细胞活力测定 将各组细胞按照一定的密度比例分别接种于96孔板,培养48 h后,每孔加入20 μL MTT 溶液,继续培养4 h,弃上清液后,再向孔内加入DMSO 150 μL,震荡10 min,发现结晶充分溶解后,用酶标仪测定波长 570 nm 处的吸光度(A)值,检查细胞的存活率。
1.2.4 双荧光素酶报告基因试验 利用软件预测LncRNA HOTAIR 及miR-20a-5p的结合点,将HOTAIR 结合位点的野生序列(LncRNA HOTAIR wt)和突变序列(LncRNA HOTAIR mut)构建双荧光素酶报告载体,并分别与miR-20a-5p mimics、mimics NC共转染至Hela细胞;再将KIF26B结合位点的野生序列(KIF26B wt)和突变序列(KIF26B mut)分别与miR-20a-5p mimics、mimics NC共转染至Hela细胞;48 h后,检测细胞中荧光素酶活性。
1.2.5 实时定量PCR (RT-qPCR) 收集对数期的Hela细胞和组织,总RNA 从细胞和组织中提取(Trizol法),并检查RNA 质量和水平(紫外分光光度法),按照制造商的说明,进行逆转录,转化为cDNA,设置3 个复孔,重复3 次,内参为GAPDH,采用2-ΔΔCt法进行分析。试验所用的引物见表1。

表1 引物序列
1.2.6 Western blot 转染后,用RIPA 裂解液裂解各组细胞,提取细胞蛋白,并测定所提取的蛋白水平。让蛋白变性成蛋白凝胶后进行电泳试验,再将蛋白转印到PVDF 膜上,利用TBST(含5%脱脂奶粉)在4 ℃下孵育12 h,在PVDF 膜上加入一抗,孵育2 h,再在PVDF膜上加入二抗,孵育1 h。采用TBST 清洗PVDF膜3次,滴入ECL 反应液进行ECL 显影,进行蛋白灰度值分析。
1.3 统计学处理 采用SPSS20.0统计学软件分析数据。计量资料以表示,各组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA HOTAIR siRNA 抑制Hela细胞与H8细胞的作用 RT-qPCR 结果显示,Hela细胞中的LncRNA HOTAIR 表达量(1.89±0.07)相比H8细胞(0.83±0.08)明显上调(P<0.01),宫颈癌组织中的LncRNA HOTAIR 表达量(2.37±0.42)相比癌旁正常组织(1.15±0.11)明显上调(P<0.01)。LncRNA HOTAIR siRNA 转染Hela细胞后HOTAIR表达量(0.35±0.06)显著低于siRNA NC组(1.05±0.08),差异有统计学意义(P<0.01)。由图1可知,LncRNA HOTAIR siRNA 转染Hela细胞后显著下调了细胞增殖能力(P<0.05)。HOTAIR siRNA 组细胞凋亡率(9.73%±0.71%)明显高于siRNA NC组(4.25%±0.12%),差异有统计学意义(P<0.01);HOTAIR siRNA 组Bax和E-cadherin表达明显上升(P<0.01),Bcl-2 和N-cadherin 表达量明显下降(P<0.01)。见图1。
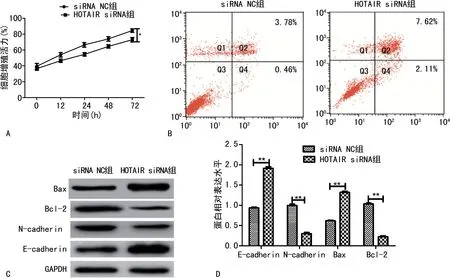
图1 LncRNA HOTAIR siRNA 对Hela细胞的作用
2.2 LncRNA HOTAIR 与miR-20a-5p的关系HOTAIR 和miR-20a-5p之间具有结合位点,当质粒携带LncRNA HOTAIR wt+miR-20a-5p mimics时,荧光素酶活性显著低于LncRNA HOTAIR wt+mimics NC(P<0.01),当质粒携带LncRNA HOTAIR mut+miR-20a-5p mimics时,荧光素酶活性无变化(P>0.05)。见图2。
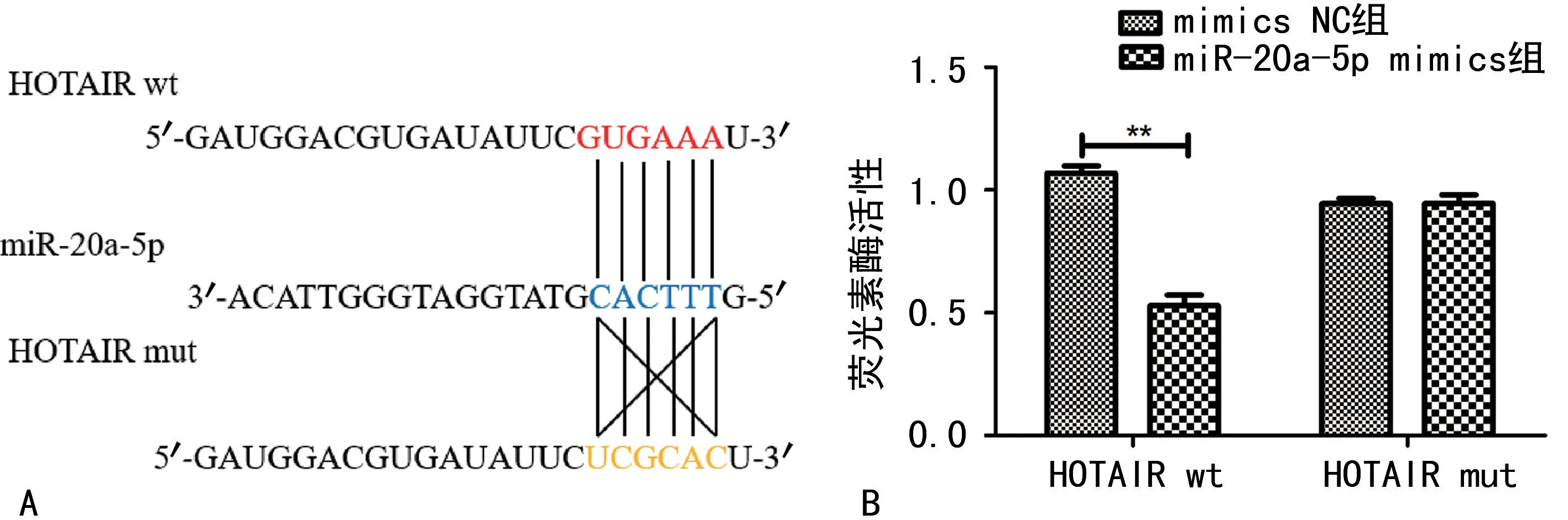
图2 LncRNA HOTAIR 与miR-20a-5p之间的靶向关系
2.3 miR-20a-5p inhibitor对Hela细胞的作用 分析RT-qPCR 结果可知,Hela 细胞中的miR-20a-5p表达量(0.35±0.09)相比H8细胞(1.06±0.10)明显下调(P<0.01),宫颈癌组织中的miR-20a-5p表达量(0.47±0.04)相比癌旁正常组织(1.16±0.11)明显下调(P<0.01)。miR-20a-5p inhibitor转染Hela细胞后miR-20a-5p表达量(0.19±0.04)显著低于inhibitor NC组(0.87±0.13),差异有统计学意义(P<0.01)。同时,miR-20a-5p inhibitor转染Hela细胞后显著上调了细胞增殖能力(P<0.05)。miR-20a-5p inhibitor组细胞凋亡率(2.86%±0.24%)明显低于inhibitor NC 组(5.82%±0.49%)(P<0.01),miR-20a-5p inhibitor组Bax和E-cadherin表达量明显下降(P<0.01),Bcl-2 和N-cadherin 表达量明显上升(P<0.01)。见图3。
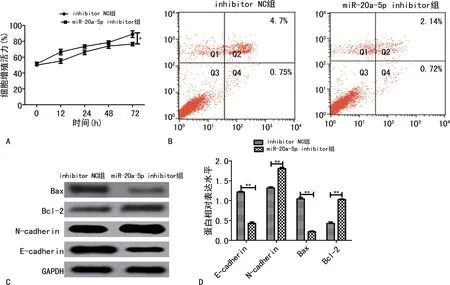
图3 miR-20a-5p inhibitor对Hela细胞的作用
2.4 LncRNA HOTAIR 通 过miR-20a-5p 对Hela细胞的调控作用 与pcDNA-3.1(+)+mimics NC组相比,pcDNA-HOTAIR+mimics NC组Hela细胞增殖能力明显升高(P<0.05),细胞凋亡率明显降低(1.74%±0.11%),Bcl-2 和N-cadherin蛋白表达量明显上升(P<0.01),Bax和E-cadherin蛋白表达量明显下降(P<0.01),pcDNA-3.1(+)+miR-20a-5p mimics组Hela细胞增殖能力明显降低(P<0.01),细胞凋亡率明显上升(12.72%±1.46%),Bcl-2和Ncadherin蛋白表达量明显降低(P<0.01),Bax和Ecadherin蛋白表达量明显上升(P<0.01);与pcDNA-3.1(+)+miR-20a-5p mimics组相比,pcDNAHOTAIR+miR-20a-5p mimics组Hela细胞增殖能力明显升高(P<0.01),细胞凋亡率明显降低(5.27%±0.31%),Bcl-2 和N-cadherin 蛋白表达量明显上升(P<0.01),Bax和E-cadherin蛋白表达量明显下降(P<0.01)。见图4。

图4 LncRNA HOTAIR 通过miR-20a-5p对Hela细胞的作用
2.5 miR-20a-5p与KIF26B 之间的关系 miR-20a-5p与KIF26B 之间具有结合位点,当质粒携带与KIF26B wt+miR-20a-5p mimics时,荧光素酶活性显著低于与KIF26B wt+mimics NC 组(P<0.01),当质粒携带KIF26B mut+miR-20a-5p mimics时,荧光素酶活性无变化(P>0.05)。见图5。

图5 miR-20a-5p与KIF26B之间的关系
2.6 KIF26B 对Hela细胞的作用 分析RT-qPCR结果可知,Hela 细胞中的KIF26B 表达量(2.35±0.12)相比H8 细胞(1.08±0.11)明显上调(P<0.01),宫颈癌组织中的KIF26B表达量(2.57±0.13)相比癌旁正常组织(1.15±0.08)明显上调(P<0.01)。KIF26B siRNA 转染Hela细胞后KIF26B表达量(0.49±0.06)显著低于siRNA NC 组(0.94±0.05),差异有统计学意义(P<0.01)。KIF26B siRNA 转染Hela细胞后显著下调了细胞增殖能力(P<0.05)。KIF26B siRNA 组细胞凋亡率(7.26%±0.61%)明显高于siRNA NC 组(4.12%±0.13%)(P<0.01),KIF26B siRNA 组Bax和E-cadherin表达明显上升(P<0.01),Bcl-2 和N-cadherin表达量明显下降(P<0.01)。见图6。
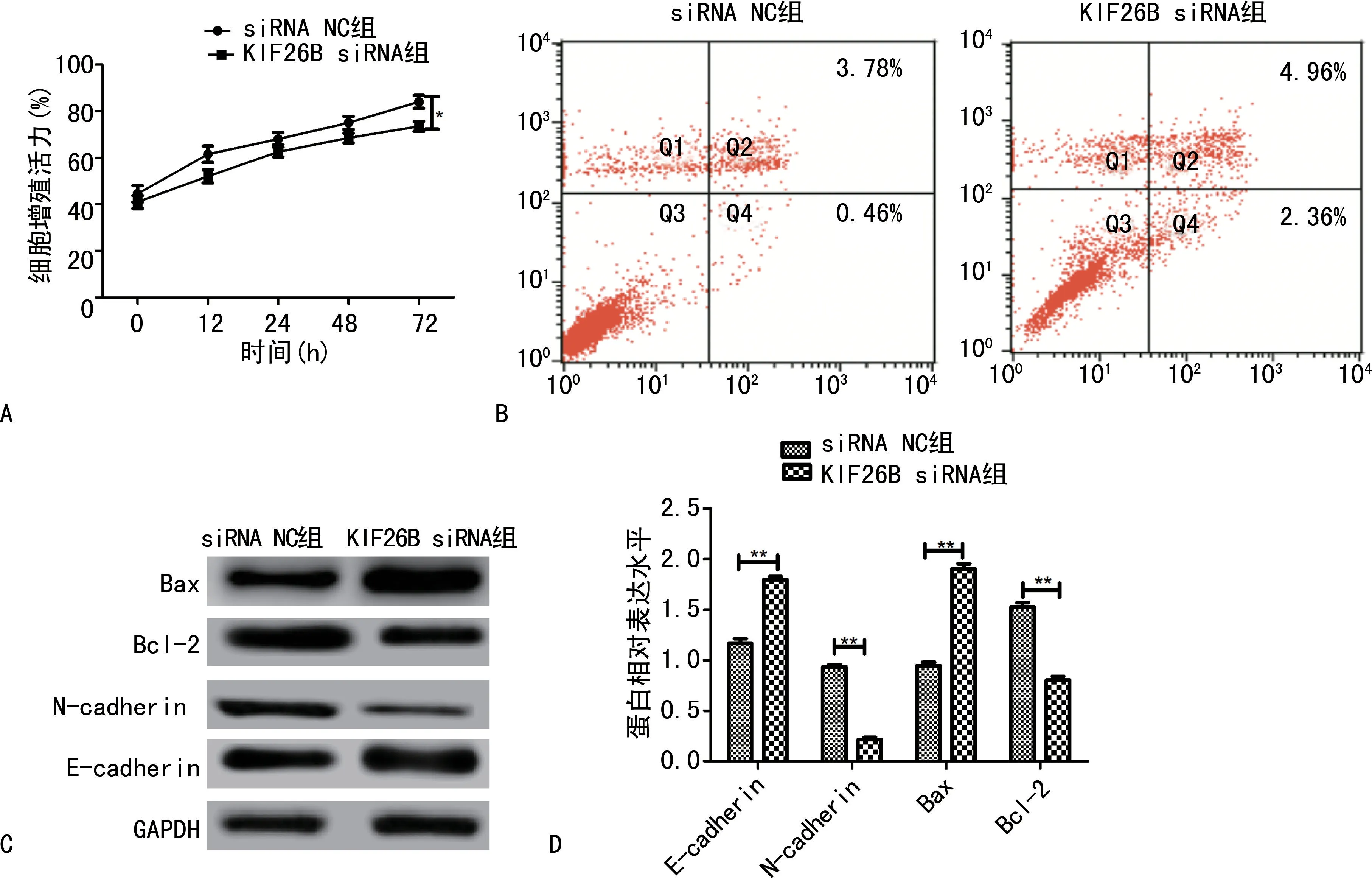
图6 KIF26B siRNA 对Hela细胞的作用
2.7 LncRNA HOTAIR 通过miR-20a-5p对KIF26B表达的影响 RT-qPCR 结果显示,HOTAIR siRNA+inhibitor NC组KIF26B表达量明显低于siRNA NC+inhibitor NC组,差异有统计学意义(P<0.01)。siRNA NC+miR-20a-5p inhibitor 组KIF26B表达量明显高于siRNA NC+inhibitor NC组,差异有统计学意义(P<0.01)。HOTAIR siRNA+miR-20a-5p inhibitor组KIF26B 表达量明显低于siRNA NC+miR-20a-5p inhibitor组,差异有统计学意义(P<0.01)。
3 讨论
LncRNA 可以在不同水平上调控基因表达,广泛参与核导入、选择性剪接和表观遗传学等多种生理过程。这些分子也可以作为结构成分,比如mRNA 衰变的调节因子,或者小RNA的前体。此外,越来越多的证据表明,LncRNA 表达异常可能是宫颈癌发生过程中的一个重要组成部分,例如LncRNA SNHG1可促进宫颈癌细胞增殖、迁移和侵袭[8]。另有研究表明,LncRNA RSU1P2作为内源竞争RNA(ceRNA)在宫颈癌细胞中对抗let-7a,参与肿瘤发生[9]。研究还发现,LncRNA MEG3具有抗宫颈癌作用[10]。LncRNA SNHG20通过miR-140-5p-ADAM10轴促进宫颈癌细胞增殖和侵袭[11]。HOTAIR 在2007年被识别[12]。已有研究表明,HOTAIR 参与了多种癌症的发展。如LncRNA HOTAIR 通过下调SETD2促进人肝癌干细胞恶性生长[13]。另有研究表明,LncRNA HOTAIR 通过COX-2调控胃癌细胞增殖与侵袭[14]。靶向LncRNA HOTAIR 通过调节EMT 抑制口腔癌干细胞的癌干性和转移[15]。尽管HOTAIR 已被证明在胃癌、肝癌、口腔癌的进展中发挥关键作用,但有关调控宫颈癌发展的分子机制的研究较少。本研究检测了HOTAIR 在宫颈癌发展中的生物学功能,结果表明,过表达HOTAIR 显著加快了细胞增殖和上皮细胞-间充质转化(EMT),抑制了细胞凋亡;而下调HOTAIR 则抑制了细胞增殖,减少了细胞EMT,诱导了更多的细胞凋亡。由此得出,HOTAIR 可能是宫颈癌的一个潜在的生物标志物和治疗靶点。
HOTAIR 作为内源竞争RNA(ceRNA)在各类肿瘤中可以与不同的微小RNA(miRNA)结合并发挥重要的调控作用。在卵巢癌中,HOTAIR 可以通过竞争结合miR-148a上调人类白细胞抗原-G(HLAG)的表达促进卵巢癌细胞的增殖、迁移和侵袭[16]。在乳腺癌中,HOTAIR 可以通过与miR-20a-5p以及HMGA2形成的ceRNA 调控网络影响乳腺癌的发生和发展[17]。在肺癌中,LncRNA-HOTAIR 通过上调miR-613影响非小细胞肺癌的发生和转移[18]。据此推测在宫颈癌中,HOTAIR 是否也通过miRNA 发挥作用。本研究结果发现,HOTAIR 与miR-20a-5p之间存在靶向结合位点,HOTAIR 通过miR-20a-5p靶向调节宫颈癌进展。为了探讨miR-20a-5p的下游分子机制,本研究采用TargetScan软件进一步分析得出miR-20a-5p与KIF26B存在靶向结合关系。KIF26B是驱动蛋白超家族的成员之一,在肾脏的发育过程中起到非常重要的作用[19]。近年来有研究表明,KIF26B的下调抑制了乳腺癌细胞的增殖、迁移和侵袭。KIF26B 通过FGF2/ERK 信号通路促进乳腺癌细胞增殖和迁移。最后,本研究探讨了KIF26B 在宫颈癌细胞中的表达量及发挥的关键作用,结果显示,KIF26B在宫颈癌细胞中过表达,促进宫颈癌细胞增殖和EMT,抑制癌细胞凋亡。
综上所述,本研究阐明了HOTAIR 通过其直接靶基因miR-20a-5p/KIF26B轴抑制宫颈癌细胞凋亡,促进宫颈癌细胞增殖和EMT。研究结果提示HOTAIR 可能作为一种潜在的生物分子标志物在宫颈癌进展中发挥作用。
