食管鳞状细胞癌患者血清miR-1246、miR-146a表达水平与预后和细胞免疫功能的关系研究*
2022-03-29闫玲新
徐 超,徐 珊,窦 燕,闫玲新,闫 茹
河北省邯郸市中心医院消化科,河北邯郸 056001
食管鳞状细胞癌(ESCC)是食管癌最常见的组织学类型,是中国第四大恶性肿瘤,多数患者确诊时已处于晚期,肿瘤恶性程度高,病死率高[1-2]。恶性肿瘤的发生与免疫失衡存在密切关系,免疫功能低下可导致肿瘤细胞逃避免疫监视和免疫细胞杀伤作用,引起肿瘤细胞恶性增殖、侵袭或转移[3]。微小RNA(miR)是一种小型非编码调控RNA 分子,转录后调控宿主基因表达,参与各种生物过程,包括肿瘤的发生、进展和转移以及肿瘤免疫调节[4]。miR-1246 是一种由突变p53衍生的外泌体,可介导肿瘤细胞和巨噬细胞之间的通信传导,对肿瘤相关巨噬细胞进行免疫调节,发挥免疫抑制作用和癌基因作用[5]。miR-146a是免疫反应的关键调控因子,可调节T 淋巴细胞增殖及其细胞因子表达,参与癌症发展[6]。miR-1246、miR-146a是否参与ESCC肿瘤免疫调节尚不清楚,且miR-1246、miR-146a与ESCC患者预后关系的报道并不多见。本研究以此为切入点,拟探讨血清miR-1246、miR-146a与ESCC 患者细胞免疫功能和预后的关系及其预测ESCC 患者预后的价值,旨在为临床ESCC的个性化诊疗和预后评估提供参考。
1 资料与方法
1.1 一般资料 选择2017年2月至2019年1月本院收治的91例ESCC患者为ESCC组,其中男47例,女44例;年龄53~71岁,平均(66.26±4.12)岁;肿瘤最大径2~7 cm,平均(4.62±1.36)cm;肿瘤部位:颈段及胸上段42例,胸中段49例;分化程度:低中分化53例,高分化38例;TNM 分期:Ⅰ~Ⅱ期57例,Ⅲ期34例。TNM 分期参照文献[7]。纳入标准:(1)均进行胸腔镜食管癌切除术和淋巴结清扫术,术后组织病理学检查证实为ESCC;(2)采集血标本前未接受任何形式的治疗;(3)临床资料完整;(4)患者均知情且签署同意书。排除标准:(1)合并其他部位恶性肿瘤、血液系统疾病;(2)坏死癌灶取材标本;(3)合并免疫系统疾病;(4)随访失访者。另选择同期于本院进行健康体检的90例体检健康者为对照组,男49例,女41例;年龄52~71岁,平均(65.97±4.13)岁。两组年龄、性别比较差异无统计学意义(P>0.05),具有可比性。本研究获得本院伦理委员会批准。
1.2 主要试剂和仪器 TRIzol试剂盒(美国Invitrogen 公司),M-MLV 逆转录酶(Epicentre 公司),CFX96 实时荧光PCR 仪(美国Bio-Rad 公司),RPM1-1640培养液(杭州吉诺生物医药技术有限公司),CD4单克隆抗体、CD8单克隆抗体(武汉艾美捷科技有限公司),羊抗兔IgG Alexa Fluor 488b 标记(上海富衡生物科技有限公司),EPICS-XL 流式细胞仪(美国COULTER 公司)。
1.3 方法
1.3.1 miR-1246、miR-146a检测 ESCC 患者确诊后未治疗前以及对照组于体检当日采集肘静脉血3 mL,自然凝固后以3 000 r/min的速度离心10 min后取上清液,加入10 cm2/mL 比例TRIzol法提取总RNA。采用M-MLV 逆转录酶将RNA 逆转录为cDNA。取2 μL cDNA 样品加入实时荧光定量聚合酶链反应(RT-qPCR)体系,采用RT-qPCR 检测miR-1246、miR-146a表达水平,反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s,40个循环。引物由金唯智生物科技有限公司设计和合成,序列如下,miR-1246 上游:5'-CCU GCU CCA AAA AUC CAU U-3';下游:5'-UUG UAC UAC ACA AAA GUA CUG-3'。miR-146a上游:5'-CGG CGG TGA GAA CTG AAT TCC A-3';下游:5'-GTG CAG GGT CCG AGG T-3'。GADPH 上游:5'-TGA CGT GCC GCC TGG AGA AAC-3';下游:5'-CCG GGC ATC GAA GGT GGA AGA G-3'。采用熔解曲线分析法进行RT-qPCR 后产物分析,共做3次平行试验。以GADPH 为内参,2-ΔΔCt计算miR-1246、miR-146a在各组相对表达量。
1.3.2 细胞免疫功能检测 ESCC 患者于确诊后未治疗前,对照组于体检当日采集清晨空腹静脉血3 mL注于抗凝试管,经EDTA 抗凝后稀释,加入100 μL RPM1-1640培养液混匀,置入含5%CO2培养箱内37 ℃温度下培养5 h。取出后加入CD4-PerCP单克隆抗体、CD8-PerCP单克隆抗体,室温避光孵育30 min,加入2 mL红细胞lysis Buffer混匀后室温下避光孵育10 min,以3 000 r/min的速度离心5 min,弃上清液,2 mL 磷酸盐缓冲液洗涤,再次离心洗涤,加入500 μL磷酸盐缓冲液重悬细胞,制成外周血单个核细胞液悬液,密度至1×104个/毫升。流式细胞仪检测T 淋巴细胞亚群CD4+、CD8+占比,计算CD4+/CD8+比值。CD4+/CD8+参考值为1.3~2.0[8],低于参考值下限为CD4+/CD8+降低。
1.4 随访 所有患者定期电话或微信随访,中位随访时间为24(12~36)个月,随访截止时间为2020年2月,统计随访期间生存情况。生存时间定义为确诊日期到死亡或随访结束日期。
1.5 统计学处理 采用SPSS25.0统计软件进行数据分析。计量资料经K-S检验符合正态分布,以表示,两组间比较采用独立样本t检验。采用Pearson 相关分析 miR-1246、miR-146a 表达水平与CD4+/CD8+相关性,Kaplan-Meier法绘制不同miR-1246、miR-146a 表达水平下ESCC 患者生存曲线,Log-Rank 检验生存率的差异。受试者工作特征(ROC)曲线分析miR-1246、miR-146a预测ESCC 患者预后的价值,预后不良定义为随访期间死亡。以P<0.05为差异有统计学意义。
2 结果
2.1 两组血清miR-1246、miR-146a表达水平对比ESCC组血清miR-1246 表达水平高于对照组,差异有统计学意义(P<0.001),miR-146a表达水平低于对照组,差异有统计学意义(P<0.001),见表1。
表1 ESCC组与对照组miR-1246、miR-146a表达水平差异()

表1 ESCC组与对照组miR-1246、miR-146a表达水平差异()
2.2 不同临床病理特征、细胞免疫功能ESCC 患者血清miR-1246、miR-146a表达水平比较 TNM 分期为Ⅲ期、CD4+/CD8+降低患者血清miR-1246表达水平高于TNM 分期为Ⅰ~Ⅱ期、CD4+/CD8+正常患者,差异有统计学意义(P<0.001),miR-146a表达水平低于TNM 分期为Ⅰ~Ⅱ期、CD4+/CD8+正常患者,差异有统计学意义(P<0.001);不同年龄、性别、肿瘤最大径、肿瘤部位、分化程度患者miR-1246、miR-146a表达水平比较差异无统计学意义(P>0.05),见表2。
表2 不同临床病理特征、细胞免疫功能ESCC患者血清miR-1246、miR-146a表达水平的比较()
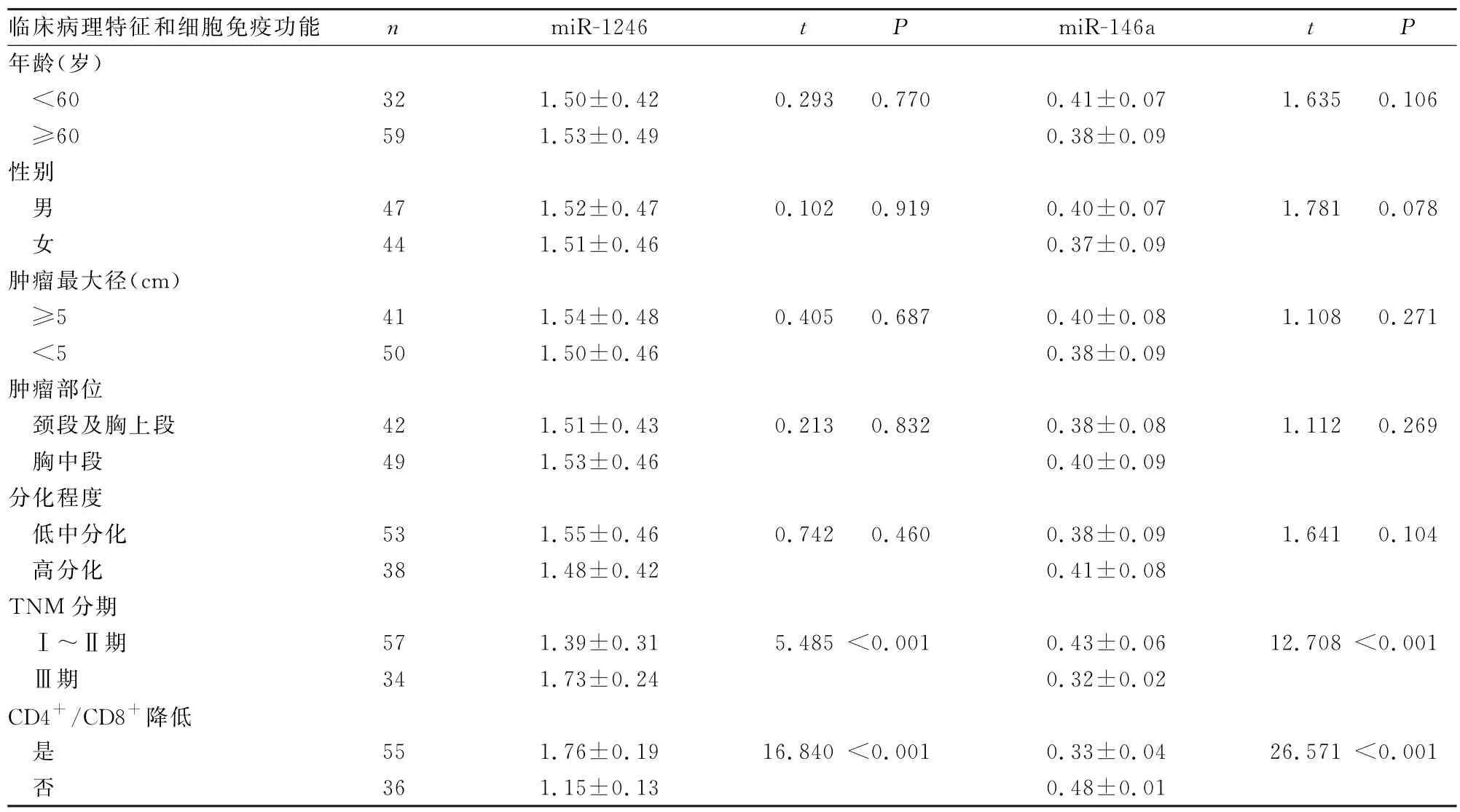
表2 不同临床病理特征、细胞免疫功能ESCC患者血清miR-1246、miR-146a表达水平的比较()
2.3 血清miR-1246、miR-146a表达水平与CD4+/CD8+相关性分析 miR-1246 表达水平与CD4+/CD8+呈负相关(r=-0.752,P<0.05),miR-146a表达水平与CD4+/CD8+呈正相关(r=0.775,P<0.05),miR-1246、miR-146a表达水平之间呈负相关(r=-0.801,P<0.05)。
2.4 不同miR-1246、miR-146a表达水平ESCC患者预后比较 随访期间,ESCC 患者中43例(47.25%)存活,48 例(52.75%)死亡。根据miR-1246、miR-146a表达水平的均值将患者分为高miR-1246表达组(miR-1246≥1.52,47例)、高miR-146a表达组(miR-146a≥0.39,42 例)、低miR-1246 表达组(miR-1246<1.52,44 例)、低 miR-146a 表达组(miR-146a<0.39,49例)。Kaplan-Meier生存曲线分析结果显示高miR-1246表达组、低miR-146a表达组患者生存率分别为31.91%(15/47)、36.73%(18/49),低于低 miR-1246 表达组、高 miR-146a 表达组的63.64%(28/44)、59.52%(25/42),差异有统计学意义(χ2=9.683、4.384,P=0.002、0.036),见图1。
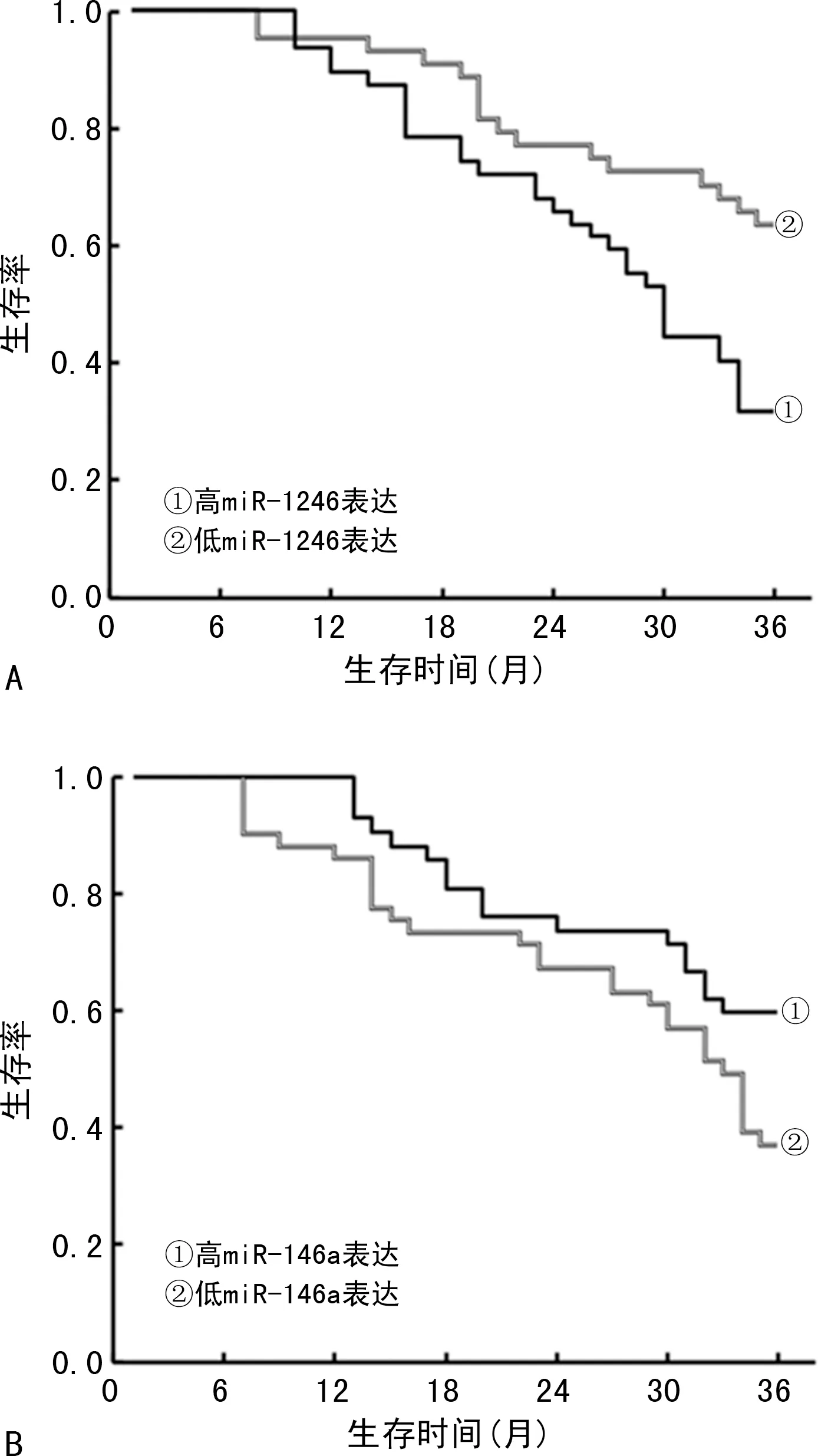
图1 不同miR-1246、miR-146a表达水平ESCC患者的生存曲线
2.5 miR-1246、miR-146a预测ESCC 患者预后的价值分析 ROC曲线分析miR-1246、miR-146a单独检测预测ESCC患者预后的截断值为1.12、0.49,曲线下面积(AUC)分别为0.754、0.713,灵敏度分别为75.00%、72.20%,特异度分别为76.40%、70.40%,约登指数分别为0.514 0、0.426 0,miR-1246、miR-146a联合检测预测ESCC 患者预后的AUC 为0.824,灵敏度为81.70%,特异度为80.20%,约登指数为0.629 0,均高于miR-1246、miR-146a单独预测。见表3和图2。
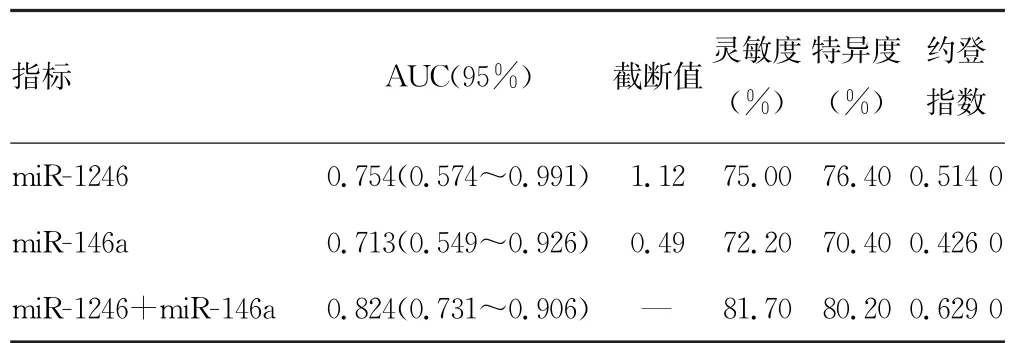
表3 miR-1246、miR-146a单独和联合检测预测ESCC患者预后效能

图2 miR-1246、miR-146a单独和联合检测预测ESCC患者预后的ROC曲线
3 讨论
免疫系统是人体最重要的防御系统,在调节肿瘤生长过程中起着重要的作用,如果免疫系统受到抑制,肿瘤细胞可逃避免疫监视,发生免疫逃逸,导致肿瘤恶性增殖、侵袭和转移[9]。T 淋巴细胞是免疫细胞中最重要的组成部分,在维持机体免疫功能、杀伤肿瘤细胞方面发挥重要作用,ESCC 患者T 淋巴细胞亚群平衡存在异常[10]。miR 是一类非编码小分子RNA,通过特异性识别靶mRNA3' 非编码区降解靶mRNA、抑制mRNA 翻译,在转录后调控多种基因表达,参与细胞生长分化、免疫调节、肿瘤发生和进展等过程[11]。
本研究发现miR-1246 在ESCC 血清中表达上调,TNM 分期为Ⅲ期的患者miR-1246表达水平高于TNM 分期为Ⅰ~Ⅱ期患者,说明miR-1246 表达与ESCC患者TNM 分期有关。丁元杰等[12]筛选ESCC差异表达miR,发现miR-1246存在明显表达异常,与ESCC发生、发展有关。另有研究显示糖原合成酶激酶3β是关键丝/苏氨酸蛋白激酶,通过作用于Wnt/β-链蛋白、磷酸肌醇-3 激酶/蛋白激酶B、Hedgehog信号通路调节细胞增殖分化、存活和凋亡,miR-1246直接靶向调控糖原合成酶激酶3β促进食管癌转移[13]。本研究中miR-1246在CD4+/CD8+降低患者中表达水平升高,miR-1246与CD4+/CD8+呈负相关,说明miR-1246过表达可抑制T 淋巴细胞功能,降低抗肿瘤免疫反应,提示miR-1246可能通过调控肿瘤免疫,促使肿瘤细胞逃逸导致肿瘤进展。COOKS等[5]报道显示miR-1246作为p53家族的一个靶点,可促使肿瘤相关巨噬细胞招募外周血单核细胞,抑制肿瘤免疫微环境,促使肿瘤进展。
本研究发现miR-146a表达缺失与ESCC 恶性侵袭转移行为有关,miR-146a表达水平与CD4+/CD8+呈正相关,提示miR-146a缺失可能抑制T 淋巴细胞增殖分化,降低对肿瘤细胞的杀伤力,提高肿瘤进展的风险。miR-146a是免疫应答的重要调节因子,通过抑制辅助性T 细胞分化所需的转录激活因子1,抑制干扰素-γ介导的辅助性T 细胞应答,对辅助性T 细胞发挥负调控作用[14],miR-146a还可调节肿瘤细胞增殖凋亡、新生血管形成,介导肿瘤细胞与巨噬细胞信号转导,改变肿瘤微环境[15-16]。MASTROIANNI等[17]研究结果显示miR-146a通过信号转导与转录激活因子1/干扰素-γ 轴影响程序性细胞死亡受体1水平,程序性细胞死亡受体1是适应性和先天免疫应答的抑制剂,可诱导肿瘤反应性细胞毒性T 细胞功能衰竭,参与肿瘤细胞的免疫逃逸。本研究发现miR-1246与miR-146a表达水平呈负相关,提示两者可能在ESCC发病中发挥相互抑制作用,破坏肿瘤免疫微环境,抑制机体抗肿瘤免疫反应,促使癌症进展。
通过随访发现miR-1246高表达、miR-146a低表达与ESCC 患者低生存率有关,miR-1246、miR-146a联合检测预测ESCC 患者预后具有较高效能,提示miR-1246、miR-146a可能成为ESCC 患者预后评估的辅助指标,二者联合检测可为ESCC 患者预后评估提供更可靠的参考。
综上所述,miR-1246、miR-146a均参与ESCC 发病和肿瘤免疫调节过程,因此本研究选择miR-1246、miR-146a两者指标进行探讨分析,结果发现miR-1246与miR-146a可能相互抑制调控肿瘤免疫反应参与ESCC 进展和不良预后。miR-1246、miR-146a联合检测可作为ESCC患者预后评估的辅助手段。
