前列腺癌超声造影、活检受侵范围与病理新分级分组的相关性
2022-03-29高泳陈圆圆韦丽艳曾雪容廖新红
高泳,陈圆圆,韦丽艳,曾雪容,廖新红
广西医科大学第一附属医院超声科,广西 南宁 530021;* 通信作者 廖新红 liaoxinhong2021@163.com
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤,我国前列腺癌的发病率呈逐年上升趋势[1-2]。确诊前列腺癌的“金标准”是经直肠超声引导下前列腺穿刺活检。以往临床应用最广泛、最主要的前列腺癌病理分级系统是Gleason评分,但其预测患者预后方面存在不足。因此,2016年WHO采纳一种新的前列腺癌病理分级分组系统,在Gleason评分基础上依据患者预后不同进行分级,能更准确地预测肿瘤的生物学行为,利于临床制订适当的治疗方案[3-4]。经直肠前列腺超声造影(transrectal contrast enhanced ultrasound,TRCEUS)可以提高常规超声对前列腺癌的诊断敏感度及特异度[5-6],联合超声造影指导前列腺穿刺活检,可以有效提高早期前列腺癌的检出率[7-9]。目前超声造影与穿刺标本受侵范围以及前列腺癌病理新分级分组系统之间的相关性研究较少。本研究拟对比分析TR-CEUS与穿刺活检标本受侵范围和前列腺癌病理新分级分组系统,探讨前列腺癌超声造影增强程度及定量参数、穿刺活检标本受侵范围在预测前列腺癌预后中的价值。
1 资料与方法
1.1 研究对象 回顾性分析2018年1月—2020年4月广西医科大学第一附属医院泌尿外科收治的疑似前列腺癌并经TR-CEUS检查有异常发现的94例患者,年龄50~91岁,平均(68.9±8.9)岁。所有患者均行经直肠超声引导下前列腺穿刺活检术,术后病理均证实为前列腺腺癌。超声造影及穿刺前均签订知情同意书。纳入标准:①患者行血清前列腺特异抗原(prostate specific antigen,PSA)、TR-CEUS、超声引导下前列腺穿刺活检;②TR-CEUS在穿刺术前进行检查,且造影均有异常发现;③术后病理均证实为前列腺腺癌。排除有任何前列腺手术及药物治疗史者。收集患者的临床资料,包括年龄、前列腺体积、PSA、可疑病灶超声造影增强程度、定量参数峰值强度(peak intensity,PI)、穿刺活检标本受侵范围(包括穿刺阳性针数占总针数比例、全部活检标本肿瘤所占平均比例、受累最重的活检标本肿瘤所占最大比例)、全部活检标本肿瘤Gleason评分以及前列腺癌病理新分级分组情况。本研究经医院医学伦理委员会批准(2021KY-E-238)。
1.2 仪器与方法
1.2.1 仪器 采用GE LOGIQ E9超声诊断仪,具备造影功能和自带定量分析软件,经直肠探头型号IC5-9-D,探头频率为5~9 MHz。
1.2.2 常规经直肠前列腺超声 患者屈膝抱胸取左侧卧位,测量前列腺大小(左右径、前后径、上下径),观察前列腺形态、包膜连续性、内外腺分界、内部回声、有无异常结节及不对称血流结构。
1.2.3 对比剂 采用对比剂SonoVue(Barcco公司),用5 ml生理盐水稀释,用力振荡摇匀,经肘静脉团注2.4 ml后,快速推注5 ml生理盐水。
1.2.4 TR-CEUS检查 如常规超声发现异常回声区或结节,取该处作为造影平面;若常规超声无异常,则取前列腺最大横断面作为造影观察平面,随后进入造影模式。造影时调整机械指数0.10~0.12,动态范围60 dB,焦点设置在图像稍下方,所有患者仪器参数设置保持一致。将造影的动态图像存储于机器硬盘中,由2名造影经验丰富的副高级医师读图,确定病灶造影增强程度,结论不一致时,讨论后取得一致结论。前列腺癌灶超声造影增强程度以正常内腺组织为参照,与内腺增强程度相同或高于内腺定义为高增强,低于内腺增强程度定义为低增强。如病灶内呈不均匀增强,定义时取占比50%以上区域的增强程度。利用机器自带定量分析软件,绘制时间-强度曲线,获取定量参数PI。
1.2.5 前列腺穿刺活检 选用BARD公司的自动活检枪,25 cm的18 G活检针。患者取左侧膝胸卧位,常规消毒铺巾,在经直肠超声引导下对前列腺穿刺取材,对超声造影提示可疑病灶穿刺1~2针,其余行系统12点穿刺法,共取材12+X针。标本置入10%甲醛溶液小瓶固定并标识穿刺点位置后送病理。
1.2.6 病理检查 采用2014年国际泌尿病理学会关于前列腺癌Gleason分级的共识会议推荐的新分级系统[3],在Gleason评分基础上根据患者预后分为5组(Gleason 3+3、3+4、4+3、8、9~10分),由2名具有10年以上前列腺疾病诊断工作经验的病理科医师阅片,判读Gleason评分及新分级分组。计算穿刺活检标本受侵范围的相关指标:穿刺阳性针数占总针数的比例(每例患者穿刺阳性总针数/每例患者穿刺总针数)、每例患者每一针标本肿瘤所占比例(癌灶长度/相应标本长度)、活检标本肿瘤所占平均比例(每例患者每一针标本肿瘤所占比例之和/每例患者穿刺阳性总针数)、受累最重的活检标本肿瘤所占最大比例(以每例患者标本肿瘤所占比例最高一针的肿瘤占比数)。
1.3 统计学方法 应用SPSS 13.0软件,符合正态分布的计量资料以±s表示,采用独立样本t检验;非正统分布的计量资料用M(Q1,Q3)表示,采用Mann-WhitneyU检验。采用Pearson相关分析PI值与病理新分级分组和PSA的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 94例前列腺癌患者中,超声造影呈高增强组67例,低增强组27例,两组患者年龄、前列腺体积、PSA比较,差异均无统计学意义(P均>0.05),见表1。按病理新分级分组1~5级,低增强组分别为6例、4例、9例、5例、3例,高增强组分别为4例、5例、19例、15例、24例。
表1 低增强组和高增强组前列腺癌患者一般情况比较(±s)
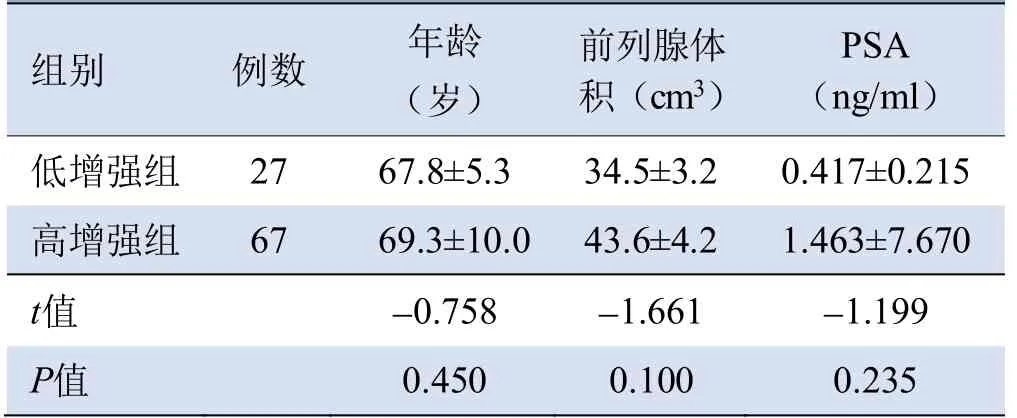
表1 低增强组和高增强组前列腺癌患者一般情况比较(±s)
注:PSA为前列腺特异抗原
组别例数年龄(岁)前列腺体积(cm3)PSA(ng/ml)低增强组 27 67.8±5.3 34.5±3.2 0.417±0.215 1.463±7.670 t值 -0.758 -1.661 -1.199高增强组67 69.3±10.0 43.6±4.2 P值0.450 0.100 0.235
2.2 不同造影增强组活检标本受侵范围、病理新分级分组、PI值比较 高增强组穿刺阳性针数占总针数比例、受累最重的活检标本肿瘤所占最大比例均高于低增强组(P均<0.05);两组PSA、全部活检标本肿瘤所占平均比例比较,差异无统计学意义(P>0.05),见表2。高增强组前列腺癌病理新分级分组高于低增强组(Z=-2.401,P=0.016)。
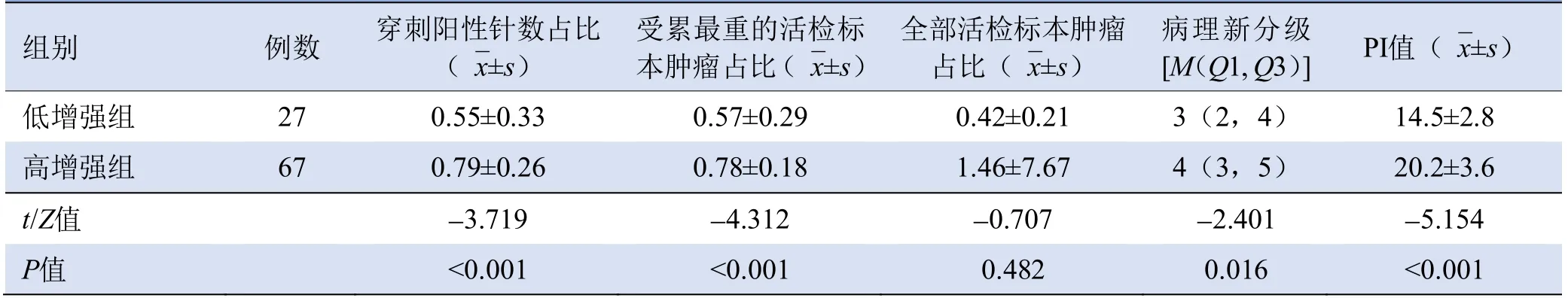
表2 不同造影增强组活检标本受侵范围、病理新分级分组及PI值比较
2.3 不同造影增强组PI值与病理新分级分组、PSA的相关性 Pearson相关分析显示,低增强组PI与新分级分组呈正相关(r=0.774,P=0.003),与PSA无相关性(P=0.833);高增强组PI与新分级分组、PSA均无相关性(P=0.384、0.315),见图1、2。
3 讨论
3.1 前列腺癌新病理分级分组与预后的关系 以往对于前列腺癌患者预后的评估,通常按照Gleason评分(≤6、7、8~10分)分为3组[10]。研究表明,Gleason评分(4+3)组患者预后与(3+4)组、8分组与9~10分组不同[11]。因此,前列腺癌新病理分级分组系统,每组分别对应不同的Gleason评分及形态学特点,均具有独立预后,更能准确预测肿瘤生物学行为[12-13]。既往研究显示,行根治性前列腺癌切除术后患者,1~5分组的5年无复发生存率分别为96%、88%、63%、48%和26%[12]。
3.2 前列腺癌超声造影增强程度与穿刺活检标本受侵范围、新病理分级分组的关系 超声造影是血池成像,前列腺癌组织中新生血管高于正常前列腺组织,且肿瘤分化程度越低,癌灶内微血管生成越多[14-15],理论上前列腺癌结节超声造影呈高增强,定量参数中的峰值强度PI值较正常组织高[16]。然而研究发现,前列腺癌结节的超声造影增强程度相当一部分也会呈低增强[17]。本研究对比分析超声造影呈高增强与低增强的癌灶,结果表明高增强组穿刺阳性针数占总针数比例、受累最重的活检标本肿瘤所占最大比例均高于低增强组,表明在相同的穿刺针数时,高增强组的穿刺标本穿刺阳性针数比低增强的癌灶更多,受累最重的活检标本肿瘤占比更高。穿刺阳性针数占比和穿刺组织中癌所占比例能准确预测前列腺癌根治术切缘阳性、包膜侵犯及精囊浸润[18-19]。本研究发现,高增强组的新分级分组高于低增强组,表明与低增强组相比,造影高增强组预后更差。因此,在利用超声造影指导前列腺穿刺活检时,异常高增强区域应为首选靶目标,有利于获取最能代表癌灶病理分级分组的活检组织。
3.3 前列腺癌超声造影定量参数PI值与新病理分级分组、PSA值的关系 本研究中低增强组PI值与前列腺癌病理新分级分组呈正相关,表明癌灶呈低增强时,癌灶的峰值强度越大,提示病理新分级分组越高,预后越差。既往研究报道,造影呈低增强的前列腺癌结节,可能是由于癌灶内微血管数量少,对比剂进入少,表现为低增强;另一个原因可能是癌结节虽然呈现富血管的病理学表现,但发育较幼稚,大部分呈闭合状,或由单个细胞围成,癌结节内仅部分血管有造影剂进入,故表现为低增强[17]。因此,在利用超声造影指导前列腺穿刺活检时,若有几处异常低增强区域,PI值越高的区域应为首选靶目标,有利于获取最能代表癌灶病理分级分组的活检组织。本研究发现,癌灶呈高增强时,PI值的高低,即峰值强度值与病理新分级分组关系并不密切。同为高增强的前列腺癌结节,仅靠超声造影的峰值强度评估其恶性程度及预后并不准确。本研究发现,造影高增强组和低增强组癌灶的PSA值无显著差异;无论前列腺癌灶呈低增强或高增强,PI值均与PSA值无相关性,表明高PSA患者可能表现为高增强,也可能表现为低增强,造影呈低增强组中同样有较高PSA值的患者。
3.4 本研究的局限性 ①穿刺标本与造影异常区域不一定完全匹配,下一步若有根治术后大体标本,通过解剖精准定位,可以减少两者间的误差;②样本量较小,有待大样本、多中心研究进一步验证。
综上所述,超声造影呈高增强的前列腺癌,穿刺阳性标本受侵范围更大,病理新分级分组更高,患者预后更差。癌灶呈低增强时,癌灶峰值强度值越高,提示患者的病理新分级分组越高,预后越差。癌灶呈高增强时,峰值强度的高低与病理新分级分组不相关,不能仅靠超声造影峰值强度评估前列腺癌结节的恶性程度和预后。PSA值的高低与癌灶的造影增强程度及病理分级分组不呈正相关。
