基于ACR TI-RADS评分系统构建甲状腺乳头状癌颈中央区淋巴结转移风险模型
2022-03-29李婷婷吕国荣沈浩霖陈可悦李玲杨舒萍
李婷婷,吕国荣,沈浩霖,陈可悦,李玲,杨舒萍*
1.福建医科大学附属漳州市医院超声医学科,福建 漳州 363000;2.泉州医学高等专科学校母婴健康服务应用技术协同创新中心,福建 泉州 362000;*通信作者 杨舒萍 2419981500@qq.com
近年,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的发病率不断上升[1-3]。有无颈部淋巴结转移与患者预后密切相关[3-4]。颈中央区淋巴结是PTC转移的首站淋巴结,术前准确评估中央区淋巴结转移(central compartment lymph node metastasis,CLNM)有助于制订临床决策[5-6]。CT及MRI检测CLNM的敏感度较低,分别为55%和41%[1,7];由于颈部复杂的解剖关系,超声对CLNM的检出率仅为30.0%~40.0%[8]。既往研究构建模型术前预测颈部淋巴结转移,但模型泛化能力差,难以在临床广泛应用[9-10]。基于美国放射学会甲状腺影像报告和数据系统(American college of radiology thyroid imaging reporting and data system,ACR TI-RADS)构建模型鲜有报道[11]。因此,本研究基于ACR TI-RADS评分系统[11],应用赤池信息准则(Akaike information criterion,AIC)构建PTC发生CLNM的风险预测模型,以提高术前预测CLNM的准确性。
1 资料与方法
1.1 研究对象 开发队列:选取2019年1—12月于福建医科大学附属漳州市医院行甲状腺全切或次全切除术+颈部淋巴结清扫(包括中央区和侧颈区淋巴结)的住院患者,纳入标准:①年龄≥18岁;②术前行甲状腺及双侧颈部淋巴结超声检查;③甲状腺病灶及颈部淋巴结术后病理提示PTC。排除标准:①超声图像不完整;②既往甲状腺手术史;③超声评估和记录的结节与病理明确的癌灶不一致;④病理诊断双侧腺叶PTC仅单侧颈部淋巴结转移;⑤颈部超声可疑淋巴结转移;⑥跳跃性转移。最终纳入284例PTC共296枚癌灶,其中男76例,女208例;273例单发癌灶,10例2枚癌灶,1例3枚癌灶;最大径约3.1~43.0 mm,平均(10.3±6.4)mm。
验证队列:选取2020年1—4月于福建医科大学附属漳州市医院行甲状腺全切或近全切除术+颈部淋巴结清扫的住院患者,纳入和排除标准同上,最终纳入54例PTC共59枚癌灶,其中男12例,女42例;最大径约3.3~36.5 mm,平均(10.0±6.3)mm。分析癌灶及颈中央区淋巴结的超声征象,并记录患者年龄、性别、癌灶数量、癌灶部位及颈部淋巴结转移情况。根据病理结果将患者分为无转移组和转移组。本研究经医院伦理委员会批准(20160702),所有患者均知情同意。
1.2 甲状腺超声检查 采用Siemens S3000型超声仪,探头频率7~9 MHz;Hitachi Vision Preirus型超声仪,探头频率7~13 MHz;Mindray Resona 7s型超声仪,探头频率7~14 MHz。
1.3 超声图像分析 由3名具有7年以上工作经验并进行ACR TI-RADS评分培训的超声诊断医师[医师A(主治医师)、B(副主任医师)、C(主任医师)]采用盲法阅片。由医师A、B同时检查癌灶以下征象:①最大径;②部位(左叶,右叶,峡部);③数量;④成分、边界、回声、钙化、形态。由医师C采用盲法分析所有癌灶的影像资料,并计算ACR总分。ACR评分赋值标准[11]:成分(囊性0分、囊实性1分、实性或基本实性2分);边缘(光滑或不确定0分、分叶或不规则状2分、腺外侵犯3分);回声(无回声0分,高回声1分,低回声2分,极低回声3分);钙化(彗星尾征或无钙化0分,大钙化1分,环状钙化2分,微钙化3分);形态(高宽比<1取0分,高宽比>1取1分)。
模型构建和验证:开发队列按3∶1随机划分为训练集和验证集。训练集用于模型构建,验证集用于模型内部验证。验证队列用于模型外部验证。
1.4 统计学方法 采用R 4.0.2软件(http://www.rproject.org/)。计量资料以±s表示,采用t检验进行分析;计数资料以例(%)表示,组间比较采用χ2检验。使用rms包进行单变量分析和多变量Logistic回归分析筛选独立危险因素,估计调整后的优势比(odds ratio,OR)和相应的95%置信区间(confidence interval,CI)。依据AIC向后逐步回归选择最小AIC值对应的预测模型。在构建集中采用Hosmer-Lemeshow拟合优度检验对上述模型进行校准度检验。应用受试者工作特征(ROC)曲线计算最佳诊断截断值。
在开发队列的验证集中进行内部验证。在验证队列中进行外部验证,根据Logistic回归分析计算验证组中每例患者的总积分,以总积分作为唯一自变量、淋巴结是否发生转移作为因变量进行回归分析。采用val.prob()函数计算C统计量,并绘制校准曲线。Unreliability检验评估校准度。P<0.05表示差异有统计学意义。
2 结果
2.1 模型构建 单变量分析和多变量Logistic回归分析结果表明,性别、癌灶数量、最大径、ACR TI-RADS评分是预测颈中央区淋巴结转移的独立危险因素,见表1、2。

表1 开发队列PTC患者一般资料和超声特征的单变量分析
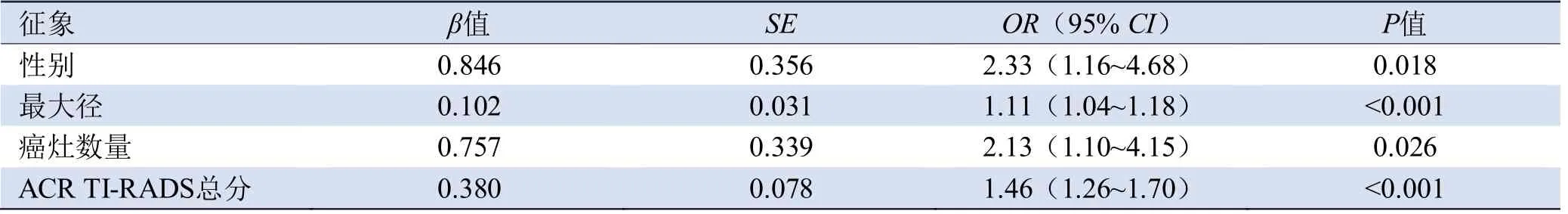
表2 开发队列中PTC发生颈CLNM征象的多变量Logistic回归分析
最小AIC值(270.135)对应的模型为:Y=-4.564+0.102×X1+0.757×X2+0.380×X3+0.846×X4。
其中,X1为最大径,X2为癌灶数量(0=1,1≥2),X3为ACR TI-RADS评分,X4为性别(0=女,1=男),见图1。模型C统计量为0.759(95%CI0.696~0.822),CLNM的预测率与实际发生率一致性较好(P=0.948,图2A)。ROC曲线分析显示,以0.421为模型最佳诊断截值时,曲线下面积为0.759(图3),模型诊断效能最高,敏感度、特异度和约登指数分别为0.839、0.609、0.448。当Y≥0.421时,认为CLNM。
2.2 模型验证 内部验证:模型C统计量为0.748(95%CI0.632~0.864),CLNM的预测率与实际发生率的一致性较好(P=0.310,图2B)。外部验证:模型C统计量为0.866(95%CI0.779~0.953),校准曲线显示CLNM的预测率和观测率的一致性良好(P=0.125,图2C)。
3 讨论
伴有颈部淋巴结转移的PTC病死率和复发率是无转移患者的30倍以上[12-14]。由于颈中央区淋巴结较小、位置较深,同时受到颈部气管环及气体的影响,使得CLNM常无法被彩色多普勒超声高效检出,导致临床医师无法准确判断是否进行预防性颈淋巴结清扫术[3]。因此,迫切需要能够准确预测CLNM的模型。2017版ACR TI-RADS[11]规范了甲状腺结节的超声诊断,可以全面反映PTC的声学特征,但目前依据AIC构建基于ACR TI-RADS评分的CLNM风险预测模型鲜有报道。
3.1 PTC的超声特征与CLNM的关系 本研究结果表明,最大径和ACR总分是PTC患者发生CLNM的独立危险因素,其中最大径与CLNM高度相关,已在既往研究中得到证实[15-18]。但既往研究中癌灶直径多为分类变量,而本研究将癌灶最大径作为连续变量纳入分析,发现病灶最大径与CLNM显著相关,其原因可能是病灶越大,PTC病程越长或倍增时间越短,转移风险越高[15-18]。何学森等[19]报道ACR TI-RADS分值有助于预判PTC及转移风险。本研究基于ACR TIRADS评分系统[11],将边缘、钙化情况、回声、纵横比和成分转化为评分进行建模,更全面地评估PTC特征,结果进一步证实ACR评分与CLNM高度相关,评分每增加1分,患者发生CLNM的风险也会相应地增加,因此超声医师应对结节进行准确评分。本研究中癌灶部位不是CLNM的危险因素,与兰雨等[15]的研究结果一致。
3.2 PTC的临床病理特征与CLNM的关系 本研究结果表明,性别及癌灶数量是PTC发生CLNM的独立危险因素。癌灶是否多发往往提示肿瘤的恶性程度[20]。本研究中癌灶数量是术后病理随访所得,因此,为了在术前做出明确的诊断和预测,建议尽可能对所有可疑的病灶进行细针穿刺活检。年龄及性别是否影响CLNM,不同研究结果存在差异[7,15-16,18]。本研究提示性别具有较高的OR值,表明女性患者发生CLNM的风险比男性患者高,即女性CLNM的可能性大于男性,推测与不同性别激素水平差异有关[21]。年龄与CLNM无明显相关,与既往报道一致[17]。
3.3 预测模型的诊断效能 不同学者构建的预测模型纳入了癌灶的不同恶性征象,如边缘、微钙化等,且多以逻辑回归分析所筛选出的独立危险预测因素进行构建,可能存在一致性较差或过度拟合的问题[6-7]。本研究选择AIC最低值(270.135)对应的模型为最终模型,一致性检验及拟合优度检验显示该模型具有良好的一致性与校准度,泛化能力较强。以0.421为诊断截值,模型能达到最大诊断效能。内、外部验证表明模型预测能力良好。
3.4 本研究的局限性 本研究未分析多灶的PTC是否位于同侧与颈中央区淋巴结转移的关系;未纳入PTC微转移病例进行研究。希望未来有多中心研究对本研究结果进行验证。
总之,模型的构建纳入了ACR TI-RADS评分值,可以较全面地反映PTC的影像学特点。以最小AIC值对应的模型为最终模型,验证其泛化能力,结果提示模型能在术前较准确地预测CLNM,可以在临床推广应用。
