多模态超声在非肿块乳腺病变诊断中的应用
2022-03-29李诗雨牛瑞兰王博姜莹王知力
李诗雨,牛瑞兰,王博,姜莹,王知力
解放军总医院超声诊断科,北京 100853;*通信作者 王知力 wzllg@sina.com
非肿块型乳腺病变(non-mass breast lesions,NML)是由美国放射学学院提出的3种乳腺病变之一,占乳腺异常的5%~9%[1]。NML是2个不同的扫查方向上不具备空间占位效应的乳腺病变,超声诊断特异性较低[2]。超声造影(CEUS)可以实时动态观察乳腺病变内微血管的分布[3],剪切波弹性成像(shear wave elastography,SWE)可以全面评价病灶内部硬度[4]。多模态超声有助于鉴别和区分乳腺病变[5],但目前针对NML的研究较少。本研究拟探讨超声多模态成像在NML诊断中的应用价值,提高超声对NML的诊断效能。
1 资料与方法
1.1 研究对象 前瞻性纳入2021年1—8月于解放军总医院行常规超声(US)、CEUS及SWE检查的44例女性患者,共47个乳腺病灶。所有患者均行穿刺活检、旋切活检或手术。患者年龄22~72岁,平均(42±10)岁;病变最大径0.9~8.8 cm,平均(3.3±1.9)cm。纳入标准:①乳腺常规超声检查为NML;②无鸡蛋、牛奶、海鲜过敏史。排除标准:①哺乳期女性或不能配合检查者,恶病质及患有严重基础疾病者;②术前已接受相关放射治疗和药物治疗;③SWE及CEUS前已行粗针或细针穿刺活检。本研究经解放军总医院伦理委员会批准(S2021-683-01),患者均签署知情同意书。
1.2 超声造影检查 采用Minray Resona 7s(Mindray Medical International公司)进行US及CEUS检查,使用L11-3线阵探头,频率5.6~10.0 MHz。患者取平卧或侧卧位,双上肢上举。首先对病灶行US检查,记录病灶的部位、大小、形态、回声、血流信号、是否伴有微钙化等。确定病灶血流信号最丰富的切面,进入至CEUS模式。打开双幅成像,将焦点调至病灶后侧,待图像稳定后,静脉推注5 ml声诺维(Bracco公司),然后推注5 ml生理盐水。患者保持平静呼吸,记录造影动态视频3 min,保存后行脱机分析。
1.3 SWE检查 采用AixPlorer超声诊断仪(SuperSonic Imagine公司),选取L10-2线阵探头,频率2~10 MHz。于病灶处行US检查,显示病灶后嘱患者平静呼吸。保存图像进行SWE测量前,将超声探头放置于病灶上方3 s,以稳定SWE图像。病灶位于弹性盒中心直径最长的平面上,未经压缩即可获得SWE图像。选定感兴趣区后,使用超声系统内置的量化工具在SWE图像上测量定量弹性参数。记录3个不同切面病灶组织的最大、平均、最小弹性模量,病变与周围相同深度组织的弹性比值,有无“硬环征”等。
1.4 统计学方法 采用SPSS 23.0软件。连续变量中,若符合正态分布,用±s表示;不符合正态分布的连续变量用M(Q1,Q3)表示,采用Mann-WhitneyU检验。分类变量以例(%)表示,采用χ2检验或Fisher确切概率法。绘制受试者工作特征(ROC)曲线,计算敏感度、特异度、阳性预测值、阴性预测值,比较US、US+SWE、US+CEUS、US+CEUS+SWE的诊断效能。采用Z检验比较ROC曲线下面积(AUC)的差异。P<0.05为差异有统计学意义。
2 结果
2.1 病理诊断 47个病灶中,病理分析显示乳腺癌21个(44.7%),其中浸润性乳腺癌12个,导管原位癌9个;乳腺良性病变26个(55.3%),其中纤维腺瘤12个,乳腺腺病6个,导管内乳头状瘤3个,乳腺炎症细胞浸润3个,纤维腺病伴假性血管瘤1个,导管内乳头状瘤样增生1个。
2.2 良、恶性NML常规超声及超声造影增强特征分析恶性NML较良性NML的直径更大、微钙化发生率更高、血流信号丰富(P均<0.05),见表1及图1、2。CEUS中,与良性NML比较,恶性NML更易出现造影时病灶面积增大和滋养血管结构改变(P均<0.05),见表2。良、恶性NML在方向、边界、内部回声、增强时间、增强模式、增强强度、增强方向、增强形状、增强边界、消退时间等方面,差异均无统计学意义(P均>0.05),见表1、2。

表1 良、恶性非肿块型乳腺病变常规超声特征比较[个(%)]
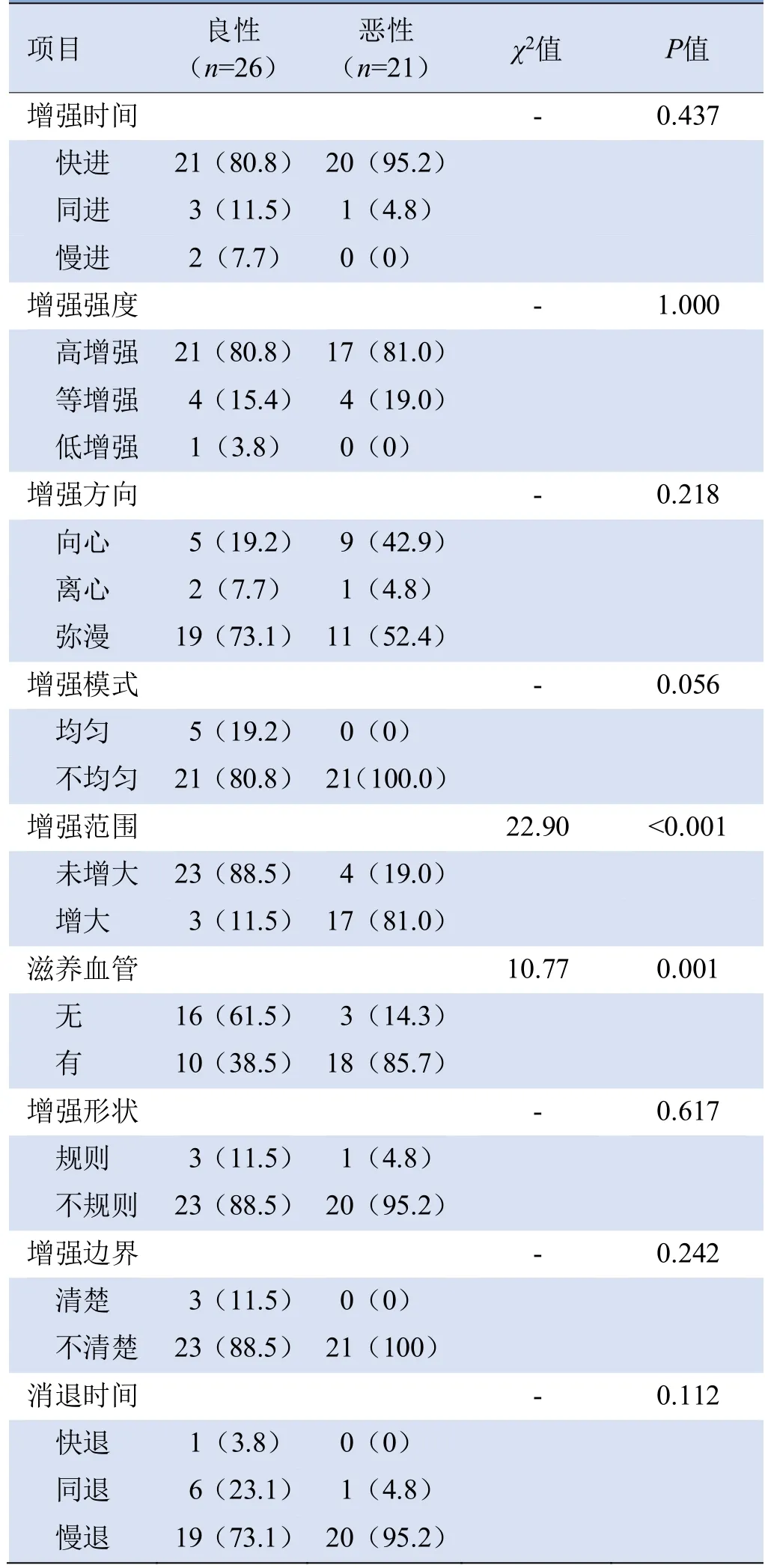
表2 良、恶性非肿块型乳腺病变超声造影特征比较[个(%)]
2.3 良、恶性NML弹性特征分析 SWE显示,恶性NML的平均、最大、最小弹性模量以及弹性模量与周围组织的比值、发生“硬环征”的概率均高于良性NML(P均<0.05),见表3及图1、2。
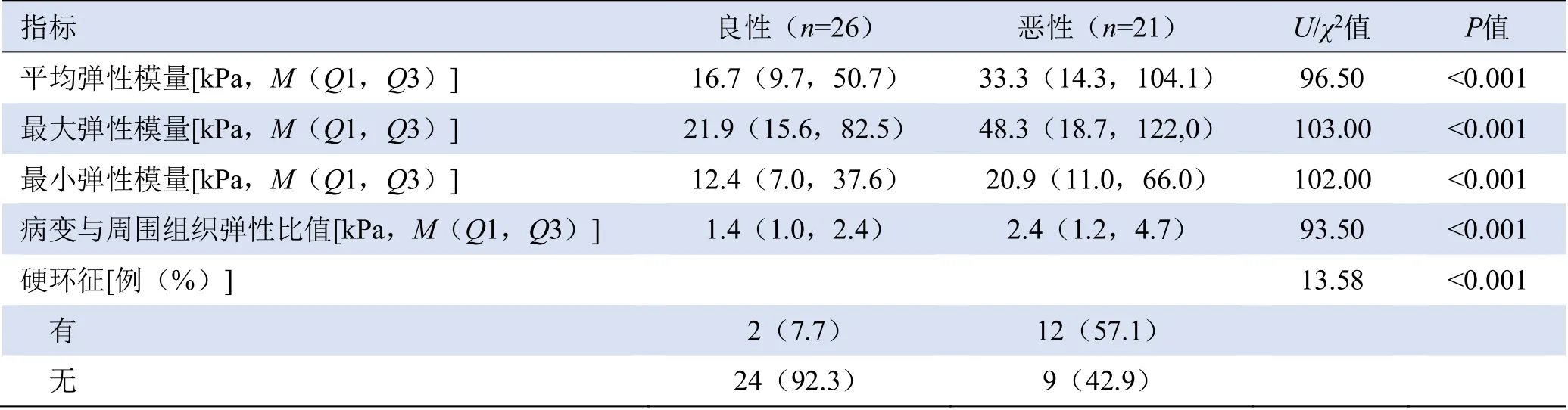
表3 良、恶性非肿块型乳腺病变的SWE特征比较
2.4 多模态超声诊断效能比较 US+SWE+CEUS的AUC显著大于US(Z=3.432,P=0.027)。US+SWE+CEUS的AUC大于US+SWE和US+CEUS,但三者差异无统计学意义(P均>0.05),见表4。

表4 不同超声诊断对良、恶性非肿块型乳腺病变的诊断价值
3 讨论
近年乳腺癌对年轻女性的威胁有所增加[6]。既往研究表明,某些类型的乳腺癌,特别是导管内癌,在常规超声下常表现为NML[7]。本研究中,乳腺癌占NML中的44.7%(21/47),其中导管内癌占42.9%(9/21)。因此,明确区分良、恶性NML至关重要。目前,SWE及CEUS在鉴别诊断乳腺病变中的重要作用已得到多方面研究,而多模态超声(US+CEUS+SWE)在NML的应用研究相对较少。
3.1 良、恶性NML的常规超声特征 本研究中,恶性NML的钙化、血流信号丰富的发生率显著高于良性,病灶直径明显大于良性病灶,与既往研究一致[2,8]。王知力等[9]研究表明,微钙化高度提示非肿块乳腺癌。Xu等[3]的研究将微钙化作为恶性NML的独立危险因素,表明微钙化与恶性NML相关。低回声区合并微钙化的阳性预测值可达78.26%[10]。Li等[2]报道,高血管性和低血管性分别与恶性、良性NML相关,与本研究结果一致。此外,尽管50%以上的恶性乳腺肿块有纵向生长的趋势(纵横比>1)[5],但本研究中93.6%(44/47)的NML横径均与乳腺平行(纵横比<1),其中95.2%(20/21)的恶性NML横径也与乳腺平行(纵横比<1),可能与恶性NML大多沿导管生长有关。
3.2 良、恶性NML的超声造影特征 本研究中,非肿块型乳腺癌多表现为造影时病灶范围增大、伴随滋养血管,与前期研究[11]相符,这可能是由于血管内皮因子表达增加导致的非肿块型乳腺癌微血管增加,进而向周围乳腺组织侵袭[12-13]。Xu等[3]的研究表明,恶性NML表现为早期增强、高增强、范围增大和滋养血管。Stöblen等[1]研究证实乳腺恶性病灶周边较中心有更多的肿瘤微血管集中。增强区的扩大可反映病灶内微血管的真实密度和分布[14]。本研究中,19.0%(4/21)的非肿块型乳腺癌造影时病灶范围并未增大,14.3%(3/21)的非肿块型乳腺癌造影时未见明显滋养血管。可能是由于即使周围血管缺乏或免疫机制抑制病灶血管形成,部分非肿块型乳腺癌仍然可以在周围毛细管网络能够滋养其生长的情况下生长[15]。
3.3 良、恶性NML的剪切波弹性特征 本研究中,恶性NML的最大、平均、最小弹性模量、与周围组织弹性比值及“硬环征”检出率均高于良性NML,与前期研究[16-17]相符,这可能是由于在恶性NML浸润侵袭的过程中,胶原蛋白、纤维蛋白合成并分泌,在细胞外基质中堆积,导致非肿块型乳腺癌弹性模量增加[18]。而增多的胶原纤维组织主要存在于非肿块型乳腺癌病灶周围,因而出现“硬环征”[19]。本研究中,7.7%(2/26)的良性NML出现“硬环征”,1例为导管内乳头状瘤,1例为乳腺导管内乳头状瘤样增生,提示良性NML在发生、发展过程中与恶性NML存在部分重叠,也可能出现病灶周围胶原纤维组织增多。
3.3 多模态超声诊断效能比较 本研究提出联合US、CEUS和SWE的多模态方法评价NML的良恶性,US+CEUS+SWE的AUC最大,明显大于常规超声。既往研究表明,常规超声诊断NML的敏感度仅为75.0%,特异度仅为76.5%[10];本研究中敏感度(66.7%)下降,但特异度(96.2%)提高。在多种超声方法联合诊断效果比较中,US+CEUS+SWE的敏感度和特异度最高,分别为95.2%和92.3%。US+CEUS+SWE的AUC大于US+SWE、US+CEUS,但无显著差异,可能与样本量较少有关,且诊断结果也受到部分主观因素的影响。
本研究存在一定的局限性:①NML的样本采集较少,样本直径较大,<1 cm的病变较少;②在图像特征分析中未评估不同观察者的影响;③超声造影定量分析也将是以后进一步研究中需要完善的目标。
综上所述,US、CEUS和SWE联合的多模态诊断方法可以提高NML的诊断效能,有助于评价NML的良恶性。
