当量比对乙炔/空气爆炸特性和火焰速度的影响
2022-03-29王文涛程扬帆姚雨乐张蓓蓓王中华刘上豪
王文涛,程扬帆,2,姚雨乐,张蓓蓓,王中华,刘上豪,2
(1.安徽理工大学化学工程学院,安徽淮南,232001;2.安徽省爆破器材与技术工程实验室,安徽淮南,232001)
乙炔(C2H2)作为最简单炔烃分子,包含碳碳三键,具有较高的化学反应活性,被用于合成氯乙烯、丙烯酸甲酯等精细化工产品[1]。另外,由于C2H2燃烧能够产生高温火焰,因此,在金属焊接、表面淬火以及热喷镀等行业中被用作优质热源[2]。C2H2在空气中的可燃范围较宽、点火能量小,具有很高的爆炸风险,在生产、运输和储存等环节极有可能引起爆炸[3]。近十几年来,全球范围内关于C2H2气体的爆炸事故频发,如2003年广东湛江C2H2爆炸事故[4]、2005年美国新泽西州Acetylene Services Company的C2H2泄露燃爆事故、2008年广维集团“8.16”爆炸事故[5]、2017年旅顺华东气体厂乙炔车间爆炸事故和2018年河北盛华化工有限公司“11.28”重大爆燃事故。由此可见,研究C2H2的爆炸特性对化工企业的安全生产和爆炸防控具有重要意义。国内外对C2H2爆炸特性进行了研究。SONG 等[6-7]实验研究了悬浮CaC2粉尘与水生成C2H2的化学反应过程,并提出一种“水解缩核模型”,详细分析了水在CaC2粉尘/C2H2气固两相爆炸中发挥的作用,揭示了C2H2氛围下气固两相爆炸的反应机制,对C2H2乙炔生产环节的相关生产条件和参数的设置具有重要意义。王犇等[8]研究了多种可燃气体在不同浓度下的爆炸威力,发现C2H2的峰值爆炸压力远高于同等条件下的甲烷、乙烷和丙烷的峰值爆炸压力。SHARMA 等[9]通过球形爆炸弹测试了C2H2/Air/Freon 12混合气体的爆炸压力,发现随着Freon 12的增加,峰值爆炸压力逐渐减小,为抑制C2H2爆炸的研究提供新的思路。火焰燃烧方面,高志崇[10]考虑光子和波长的影响并结合燃烧反应焓,计算得出C2H2在空气中的最大燃烧温度为2 690 K。
爆炸压力是研究气体意外爆炸的重要参数,20 L 球形爆炸系统在爆炸测试方面的发展较为成熟,在甲烷等可燃气体的爆炸实验中已得到验证[11-13]。层流燃烧速度Su反映了燃料的燃烧特性,国内外关于层流燃烧速度Su的测量方法主要有对冲火焰法[14]、平面火焰法[15]以及球形火焰法[16-17]。EGOLFOPOULOS等[18]采用对冲火焰法对C2H2火焰的Su进行测量,但由于实验条件等限制,测量结果存在较大误差。而球形火焰法由于实验装置简单、火焰拉伸率的定义明确,在预混火焰层流燃烧速度Su的测量中应用较为广泛。球形火焰在扩张过程中受到热扩散不稳定和流体动力学不稳定的影响,发生失稳和加速,导致Su的测量出现偏差[19]。YANG等[20]指出:在燃烧不稳定作用下,火焰被划分为光滑阶段、转捩阶段和饱和阶段,其中热扩散不稳定会导致光滑的球形火焰出现褶皱,转捩和饱和阶段主要受流体动力学不稳定的控制。对此,研究人员通过Chemkin模拟气体燃烧过程获得层流燃烧速度,对实验进行补充。Chemkin软件的化学反应动力学分析如组分浓度、反应敏感性分析等已得到验证,是研究燃烧化学的重要工具[21-23]。
本文采用20 L球形爆炸装置和高速摄像系统,对不同当量比下的C2H2/空气预混爆炸进行测试,获得相应的爆炸特征参数。采用球形火焰法对光滑阶段的火焰图像进行处理,进而得到更为精确的C2H2/空气预混燃烧的层流燃烧速度Su。结合Chemkin软件对预混气体的绝热压力、火焰温度以及层流燃烧速度Su进行模拟,从化学反应动力学的角度探究C2H2/空气的化学反应过程,并进行敏感性分析,为完善烃类燃料的反应机理和预防C2H2的意外爆炸提供理论和数据参考。
1 实验与数值模拟
1.1 实验装置和实验过程
图1所示为实验装置示意图,主要包括20 L球罐、点火系统、配气系统、控制系统以及数据采集系统。C2H2(纯度≥99.98%)和空气(20.98% O2+79.02%N2,体积分数)由合肥恒隆电气有限公司提供。首先,用真空泵将罐体抽真空,然后,按照分压法先后通入C2H2和空气至常压,点火前静置5 min 保证气体充分混合。点火器两端电压为15 kV,采用PCB 113B24 压力传感器记录压力,采用MEMRECAM HX-3 高速摄像机透过直径为6 cm 的石英玻璃以5 000 帧/s 的速率对球形火焰进行同步拍摄,实验初始温度为298 K,初始压力为1.01×105Pa,实验工况如表1所示,每组工况重复实验3次。
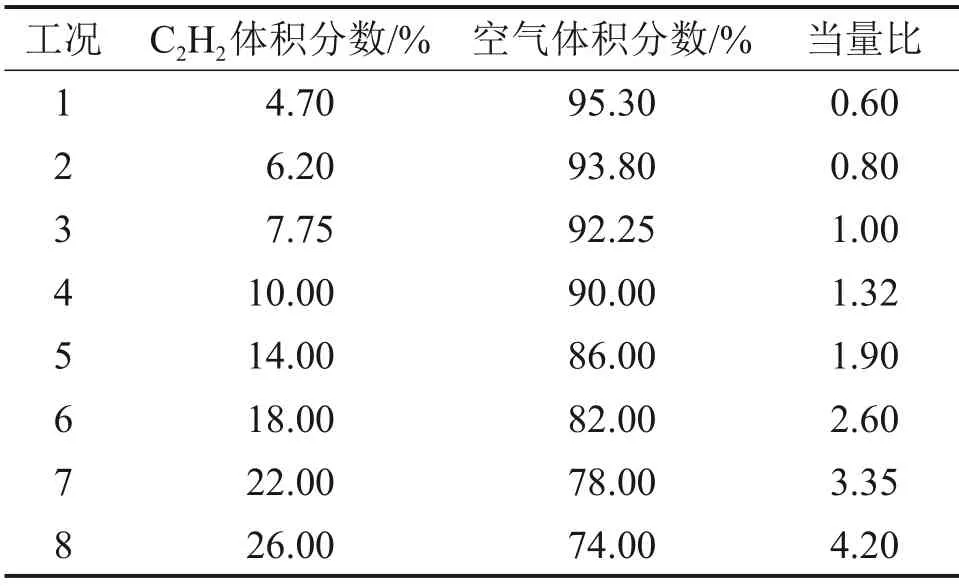
表1 实验工况Table 1 Experimental condition
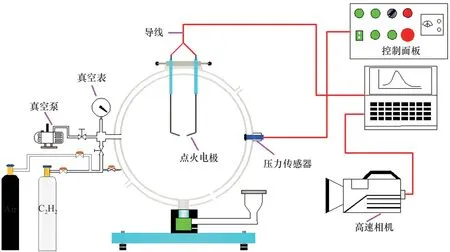
图1 实验装置示意图Fig.1 Schematic diagram of experimental apparatus
1.2 数值计算
1.2.1 反应器模型
Chemkin软件包含了以气相动力学、表面动力学、传递过程软件包为基础的24种反应器模型[24]。本文采用Chemkin 软件中相平衡(Equilibrium)、封闭0 维均质反应(closed homogeneous 0-D reactor)、层流预混火焰计算(premixed laminar flame-speed calculation)模型对不同当量比的C2H2/空气爆炸过程进行计算,获得绝热压力、爆燃温度、层流燃烧速度,并对相关的基元反应进行分析。
1.2.2 反应动力学模型及初始条件
反应动力学模型采用美国Lawrence Livermore国家实验室提出的Gri Mech 3.0模型,该模型包含C,H,O。N 和Ar 共5 个元素,53 种化学物质以及325个基元反应,常用于轻质可燃气体氧化燃烧过程的研究[25]。借助敏感性分析,选取C2H2/空气爆炸的10个关键反应基元步,如表2所示,其中,α为指前因子,B为温度指数,E为活化能。在模拟过程中,初始温度和压力分别为298 K 和1.01×105Pa。对于相平衡模型,求解类型设置为定体积焓(constant volume enthalpy);0 维均质反应模型,求解类型选用限定体积求能量(constrain volume and solve energy equation),反应容器的体积为20 L,求解时间设为5 ms,敏感性阈值设为0.02。层流火焰计算模型中,根据SARATHY 等[26]的网格测试报告,先将初始网格点设为250,相对梯度和曲率分别设为0.1和0.5,初始计算起始坐标和终止坐标分别设为-0.1 cm 和0.3 cm。然后,在Continuations面板扩大计算范围,计算起始坐标和终止坐标分别设为-2 cm 和10 cm,保证气体温度和主要组分在梯度边界外接近为0,再将网格参数提升至300,保证计算精度,进而得出与网格参数无关的精确解[27]。
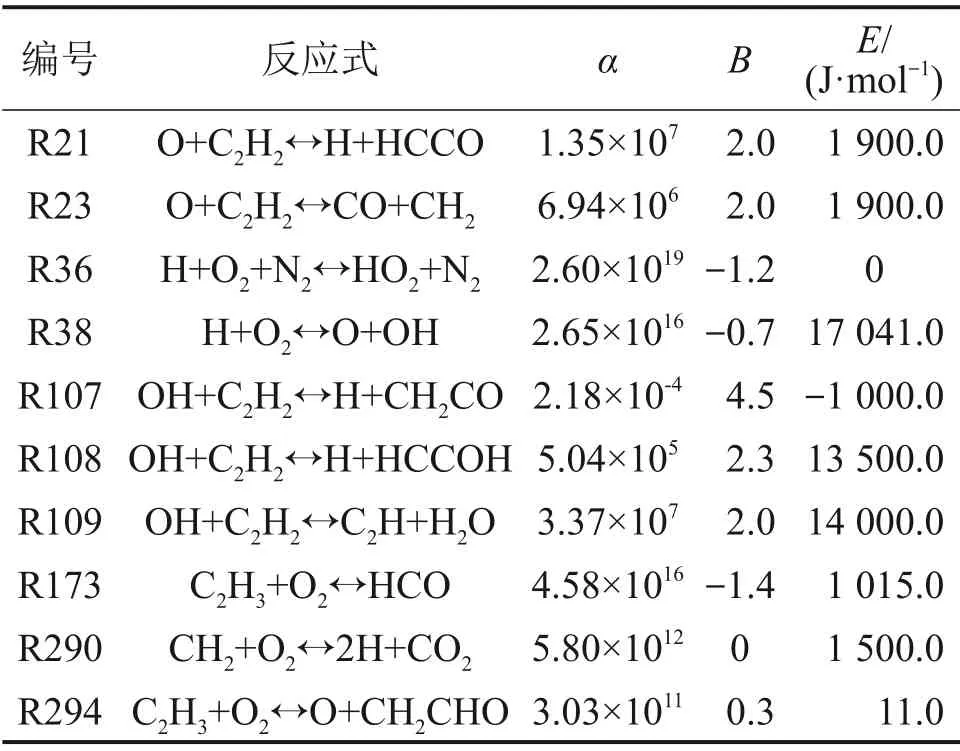
表2 C2H2爆炸部分关键基元反应Table 2 Part of important element reactions in C2H2 explosion
2 结果与分析
2.1 不同当量比下C2H2/空气爆炸特性
C2H2与空气的完全反应可近似表示为
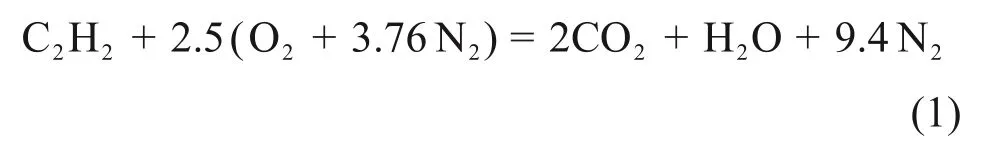
采用当量比φ表示不同C2H2浓度:

其中:n为C2H2和空气实际物质的量比;nst为C2H2与空气完全反应状态的物质的量比。当φ小于1时,表示完全反应状态为贫燃状态,当φ大于1时,表示完全反应状态为富燃状态[28]。
图2所示为化学当量比为1时C2H2/空气的典型爆炸压力时程曲线,其中,t1为点火时间,t2为Pex对应的时间,燃烧时间τ=t2-t1,(dP/dt)ex为同组实验的最大压升速率[29-30]。不同当量比下Pex的最大值定义为最大爆炸压力Pmax。

图2 典型C2H2/空气的爆炸压力时程曲线Fig.2 Typical pressure time history curve of C2H2/air explosion
2.1.1 爆炸压力与爆燃温度
图3 所示为φ=0.6~4.2 时,实验获得的C2H2/空气爆炸的Pex以及Chemkin 模拟计算的绝热压力。可见:当φ=0.6时,绝热压力实验值与模拟值相差较大;在其余条件下,压力实验值与模拟值的吻合度较高,这表明利用该模型获得的绝热压力对C2H2/空气的Pex进行预测的可信度较高。另外,模拟在绝热状态下进行,容器壁面的热损失被忽略,因此,模拟值略高于实验值;当φ=0.6时,压力接近可燃极限,壁面热损失效应对压力的影响显著,导致爆炸压力偏小[31];当φ<1.32 时,随着φ的增加,Pex快速上升;当φ=1.32时,压力最大值Pmax为0.84 MPa;当φ>1.32 时,随着φ增加,Pex下降并不明显,直至φ=4.20,Pex仍能维持在一个较高水平(0.65 MPa)。与甲烷等饱和烃燃料不同,C2H2/空气爆炸过程中,在经过快速上升期后,在实验φ范围内,Pex呈现一个类平台期。

图3 不同当量比φ下C2H2/空气的峰值爆炸压力Fig.3 Peak explosion pressure of C2H2/air under different equivalence ratios
图4 所示为不同当量比下的C2H2/空气爆炸的τ和(dP/dt)ex。从图4可见:随着φ的增加,τ先下降后上升,在φ=1.32 时,τ达到极小值50.07 ms;随着φ增加,(dP/dt)ex则呈现先上升后下降的趋势,极大值为460.51 MPa/s,这说明φ对C2H2/空气爆炸反应的强烈程度有影响。爆炸指数Kst是对(dP/dt)ex和反应容器体积归一化的处理结果,是表征爆炸猛烈程度的重要参数,当Kst>30 MPa·m/s时,爆炸猛烈程度达到最高等级[13]。图5 所示为不同φ下C2H2/空气爆炸的Kst和Chemkin 模拟的爆炸温度。由图5可见:在高燃料浓度时,C2H2/空气仍具有极强的爆炸性,对其爆炸特征参数准确掌握,可为相关化学反应釜的安全设计提供数据参考。另外,Chemkin 模拟得到C2H2/空气爆炸的最大爆炸温度为2 685.48 K,与高志崇[10]通过理论计算得到的C2H2在空气中的燃烧温度2 690 K 吻合,进一步验证了反应模型和参数设置的准确性。
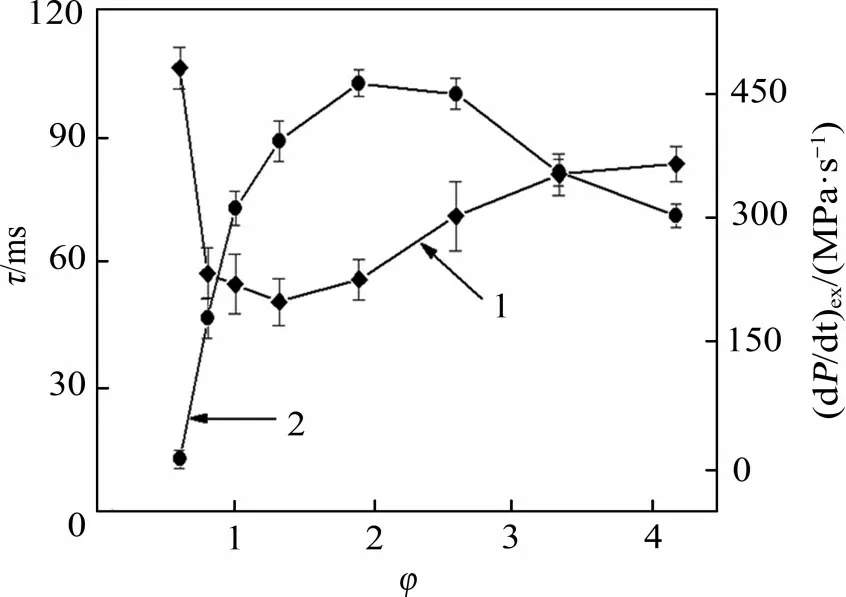
图4 不同当量比φ下C2H2/空气的燃烧时间和最大压升速率Fig.4 Combustion time and maximum pressure rise rate of C2H2/air under different equivalence ratios

图5 不同当量比φ下C2H2/空气的爆炸温度和爆炸指数Fig.5 Deflagration temperature and explosion index of C2H2/air under different equivalence ratios
C2H2/空气呈现上述爆炸特性可能是球罐中发生了如下反应:

在贫燃状态时,C2H2与空气发生如式(3)所示的反应,反应释放的热量随着当量比的增大而增多,从而导致Pex变大;当C2H2达到一定浓度后,O2含量开始不足,反应向式(4)过渡,此时,容器内将同时发生如式(3)和(4)所示的反应,但释放的总热量仍在增高,因此,Pmax出现在富燃料侧;当φ继续增加时,O2含量严重不足,反应释放的热量开始降低,Pex出现下降,但由于C2H2发生如式(5)所示的自分解反应,为压力上升提供了能量,因此,当O2严重不足时,Pex与表征爆炸危险程度的(dP/dt)ex和Kst仍维持在一个较高的水平。
2.1.2 组分体积分数的变化
为进一步探究C2H2/空气的爆炸特性,选取式(3)~(5)的终态产物CO,CO2和H2,利用Chemkin模拟φ为0.60,1.32 和2.60 时的组分体积分数变化,结果如图6所示。C2H2/空气燃烧反应是一个缓慢生成CO的过程,CO2和H2的体积分数在反应初期没有明显增加,在爆炸瞬间,CO的体积分数迅速升高并达到最大值。由图6(a)可见,当φ=0.60时,随着反应的进行,CO 氧化生成CO2,最终CO2体积分数高于CO 体积分数;由6(b)可见,当φ=1.32 时,由于O2含量不高,CO 氧化程度较低,最终造成容器内CO 体积分数远高于CO2体积分数,且H2的体积分数有所上升,说明富燃状态时,不完全燃烧起主导作用,并开始伴有C2H2的分解反应。这种现象在φ=2.60 时更为明显(如图6(c)),此时,CO2体积分数几乎为0,而H2的体积分数明显上升,反应基本上转变为不完全燃烧和C2H2的分解反应。这进一步验证了随着φ的增加,C2H2与空气的爆炸反应符合反应式(3)~(5)的推断。
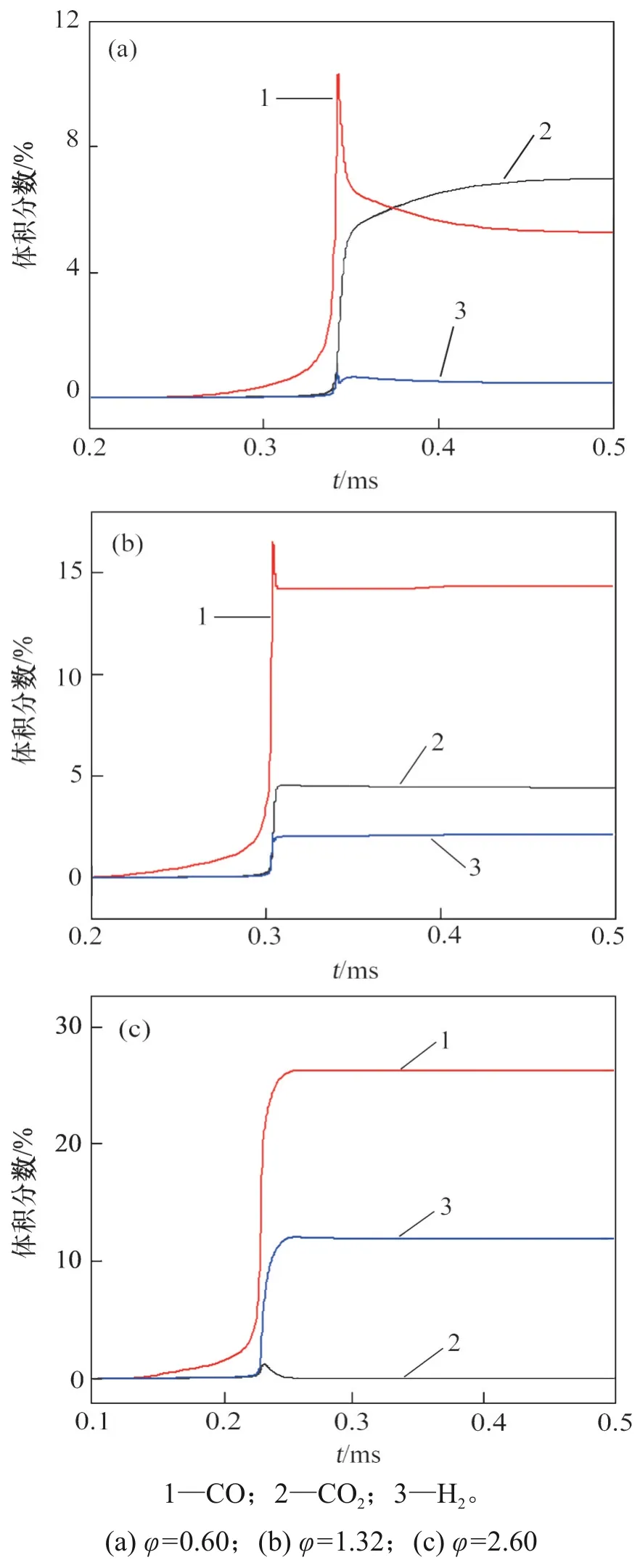
图6 不同当量比φ下C2H2/空气爆炸的组分体积分数变化Fig.6 Composition concentration variation of C2H2/air explosion under different equivalence ratios
2.1.3 关键反应步敏感性分析
结合Chemkin 软件敏感性分析模块对φ为0.60,1.32和2.60时C2H2对关键步基元反应的敏感性进行分析,关键步基元反应见表2。在不同当量比下,C2H2/空气的敏感性系数如图7 所示,其中,正值表示促进作用加快C2H2的生成,负值表示抑制C2H2的生成,敏感性系数的绝对值越高则表示基元反应对自由基的影响越大。
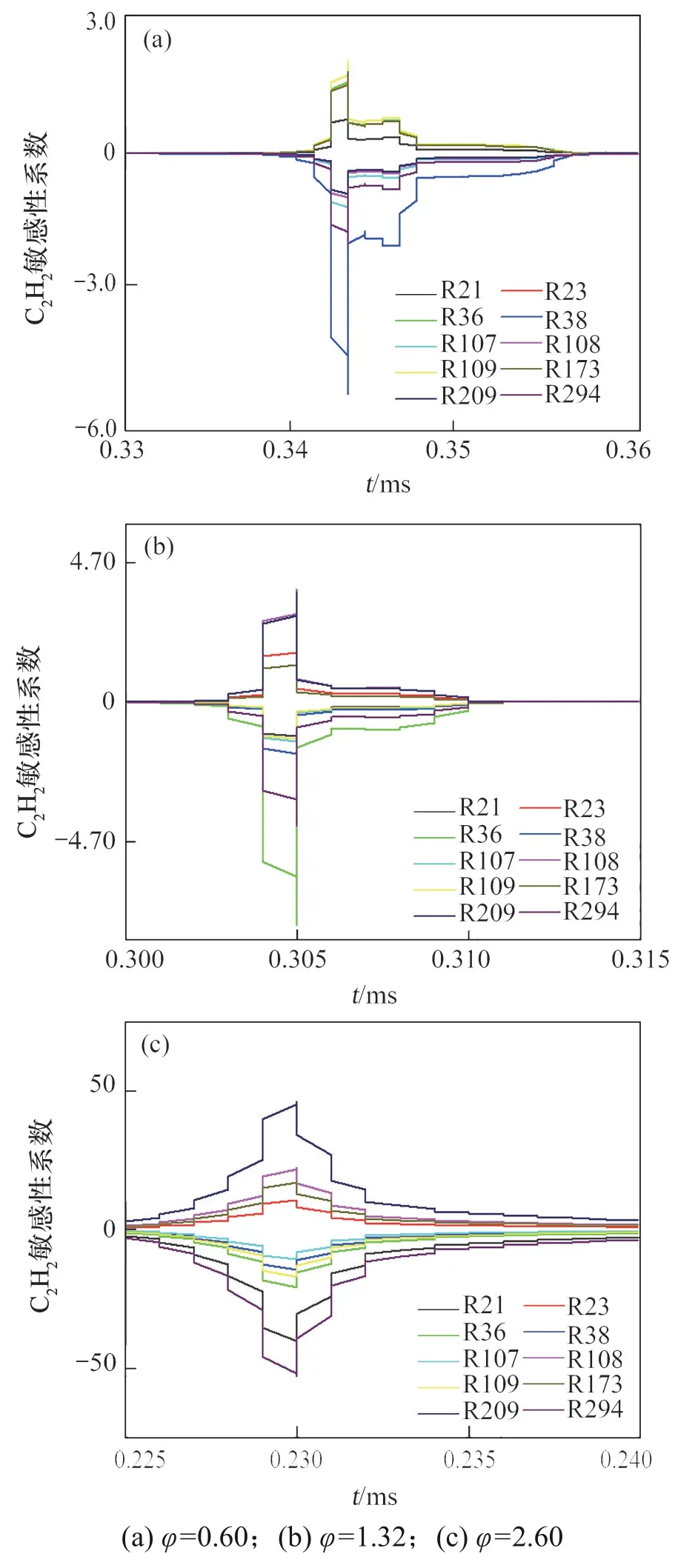
图7 不同当量比φ下C2H2的敏感性系数Fig.7 Sensitivity coefficient of C2H2 under different equivalence ratios
如图7(a)所示,当φ=0.60时,基元反应R38对C2H2分子的抑制作用最大,表明该反应加快了C2H2的消耗,这是因为基元反应R38是生成O自由基的主要途径,而O自由基通过基元反应R23消耗C2H2;当φ增大到1.32 时,由图7(b)可以看出,C2H2对基元反应R21 的敏感性由正值转变为负值,而对基元反应R23的敏感性则相反,说明此时O自由基消耗C2H2的主要基元反应由R23 转变为R21,其中反应生成的HCCO已被研究认为是生成CO和CO2的中间体[23]。在贫燃状态下,基元反应R36 对C2H2起促进作用,主要是因为其进行正向反应消耗O2,而在富燃状态,其逆向反应生成的O2加快了C2H2的消耗。同时,随着φ的增加,自由基OH和H 自由基也参与了对C2H2的消耗如基元反应R109和以下反应:
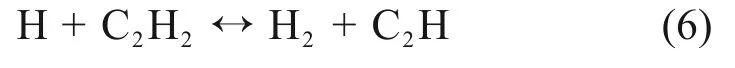
因此,对于C2H2与空气的爆炸,首先是O 自由基与C2H2分子结合发生反应,随着φ的增加,容器中O2含量逐渐减小,OH自由基和H自由基也参与对C2H2的消耗,反应生成的C2H 也是生成炭黑的重要前体。炭黑生成量的增加,火焰颜色会逐渐加深,这种变化也在图8中得到验证。
2.2 不同当量比下C2H2/空气火焰特征
2.2.1 火焰形态
图8 所示为火焰半径r为1.2 cm,不同φ时C2H2/空气的球形火焰图像。从图8可以看出:在贫燃状态下,火焰呈淡蓝色且亮度较低,随着φ的增加,火焰颜色从淡蓝色转变为青靛色进而变成明黄色。这是因为贫燃状态时,C2H2含量较小,球形火焰内部的温度较低,火焰颜色呈淡蓝色的氧化焰;随着φ的增加,火焰温度也逐步升高,形成青靛色的中性焰;当φ达到2.60时,不完全燃烧形成炭黑颗粒,火焰变成明黄色。

图8 不同当量比φ下C2H2/空气的球形火焰图(r≈1.2 cm)Fig.8 Spherical flame diagram of C2H2/air under different equivalence ratios
2.2.2 火焰传播速度Sn
提取火焰半径在0.5~2.5 cm 的图像进行处理,因为该范围下火焰轮廓较为光滑,燃烧不稳定作用及初始点火能量对火焰传播行为的影响较小,火焰传播速度的测量更为准确[32]。Sn为火焰锋面相对壁面的传播速度,用单位时间内火焰半径的变化率表示,可用于推算层流燃烧速度Su。图9所示为C2H2/空气的球形火焰半径与时间关系。
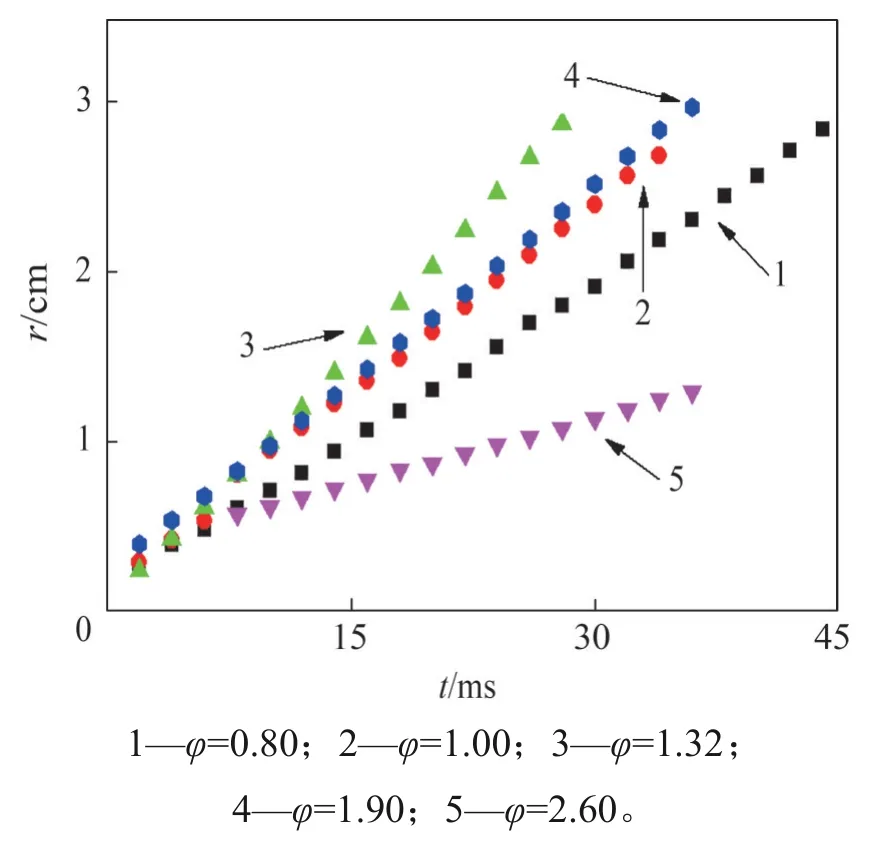
图9 火焰半径与时间的关系Fig.9 Flame radius versus time
不同时刻的Sn都会存在一定的波动,绘制r-Sn图像更能够反映火焰传播过程的细节。C2H2这种不饱和燃料在燃烧过程中H 自由基含量较小,适当提高C2H2浓度能够获得足够的H 自由基来增强关键的链分支反应R38[18];但当C2H2浓度过高时,反应体系中缺少O2,亦会抑制基元反应R38的进行。
不同半径处的火焰传播速度如图10 所示。从图10 可见,随着φ增加,Sn呈先增大后减小的趋势,在φ=1.32 时,达到最大值1 011.16 cm/s,相对φ=0.80(Sn=612.50 cm/s)和1.00(Sn=706.90 cm/s)时,分别提高了65.09%和43.04%;相对φ为1.90(Sn=751.50 cm/s)和2.60(Sn=269.51 cm/s)时,分别降低了25.68%和73.35%。此外,在贫燃工况下,Sn的波动较为剧烈,这是由于球形火焰受热扩散不稳定的影响,火焰容易失稳,而当φ增大时,这种波动逐渐减小,Sn逐渐趋于平稳。

图10 不同半径处的火焰传播速度Fig.10 Flame propagation speed at different radius
2.2.3 层流燃烧速度Su
对于球形膨胀火焰Sn,r和t的关系如式(7)所示。实际计算中采用式(8)。

其中:Sni为i时刻火焰的传播速度,ri+1和ri-1分别为i+1 和i-1 时刻的火焰半径;ti+1和ti-1分别为i+1 和i-1时刻。
随着球形火焰的扩张,火焰表面不断拉伸,球形火焰的拉伸率κ为
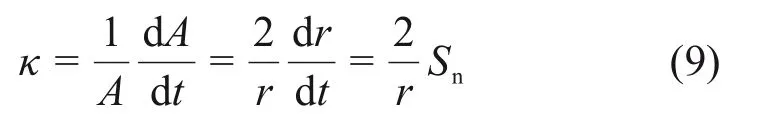
式中:A为火焰表面无限小面积[32]。
当φ为0.8,1.32和1.90时,将计算得到的κ与Sn作成散点图,进行线性拟合,火焰传播速度与火焰拉伸率的关系如图11 所示。根据马克斯坦长度理论[32-33],Sn与无拉伸层流火焰传播速度(Sn0)存在如下线性关系:
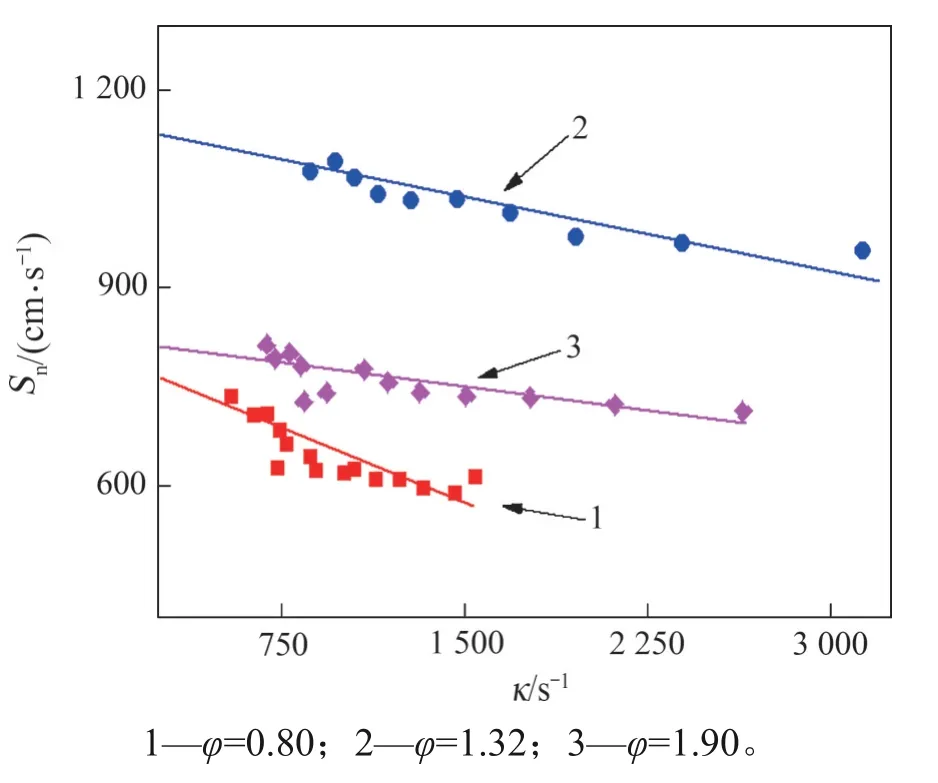
图11 火焰传播速度与火焰拉伸率的关系Fig.11 Relationship between flame propagation speed and flame stretch rate

式中:L为斜率,即马克斯坦长度,用来表征燃烧火焰的稳定性。通过外推法,令κ=0即可得出φ在0.80,1.32 和1.90 时,Sn0分别为763.58,1 122.17和807.78 cm·s-1,对应的标准误差分别为0.022,0.008和0.01,拟合效果较好。
Su通过式(11)进行计算:

式中:ρu和ρb分别为未燃和已燃气体密度,ρu由预混气体的初始状态决定,ρb通过Chemkin的化学平衡方法进行计算。最终得出φ分别为0.80,1.32和1.90 时,ρb/ρu分别约为0.15,0.12 和0.11,进而计算Su分别为114.6,135.4,89.5 cm/s。将通过该方法获得Su与Chemkin 的模拟结果进行对比,如图12 所示。从图12 可见:随着φ增加,Su实验值和模拟值呈现相同的变化趋势且相对误差为6.06%,并在φ=1.32时,达到最大值135.4 cm/s。

图12 不同当量比φ下的C2H2/空气的层流燃烧速度Fig.12 Laminar flame burning rate of C2H2/air under different equivalence ratios
3 结论
1)随着当量比的增加,C2H2/空气爆炸的Pex和爆燃温度均呈现先上升然后下降的趋势,当φ=1.32 时,Pmax的实验值和最大爆燃温度的计算值分别为0.84 MPa和2 685.48 K。Pex实验值与Chemkin的模拟结果吻合度较高,在富燃状态下,(dP/dt)ex和Kst也维持在较高水平,为C2H2/空气爆炸特征参数预测和事故反演提供新的技术手段。
2)C2H2/空气的爆炸反应首先是O 自由基结合C2H2分子生成CO,随着当量比的增加,OH 自由基和H 自由基也参与对C2H2的消耗,宏观上表现为C2H2分解生成氢气和炭黑,其自分解反应也是其存在较高爆炸危险性的重要原因。
3)随着当量比的增加,C2H2/空气球形火焰的颜色由淡蓝色逐渐转变为明黄色,Sn呈先增大后减小的趋势,最大传播速度和层流燃烧速度分别为1 011.16 cm/s 和135.4 cm/s,该结果可为C2H2生产和加工过程、反应容器的强度设计和安全距离的预留提供数据参考。
