枳实通降颗粒通过干预MK2磷酸化调控c-kit表达防治术后炎性肠梗阻的机制研究*
2022-03-28周平兰王华帅何永恒
莫 黎,李 倩,周平兰,王华帅,李 莹,黄 丽,何永恒
(1.湖南中医药大学第二附属医院 长沙 410005;2.湖南中医药大学研究生院 长沙 410208;3.湖南省中医药研究院附属医院 长沙 410006)
术后炎性肠梗阻(Postoperative inflammatory ileus,POI)是指腹部术后早期胃肠道收缩功能恢复前的一个特殊时期,以肠麻痹和肠壁水肿渗出粘连为特点,又称为术后肠梗阻或术后早期炎性肠梗阻。POI被认为是腹部,尤其是肠道手术后无法避免的并发症,其持续时间的长短直接影响到术后患者的康复,但目前临床仍缺乏高效安全的治疗手段和药物[1]。研究证实,神经机制与炎症机制是导致POI的发病的两种主要机制,二者相互影响,但炎症反应在其中起着关键性作用[2]。p38MAPK(Mitogen-activated protein kinase)信号通路是炎症反应发生的经典通路,其中MK2又是该通路中一个关键性的下游蛋白激酶,具有干预细胞因子产生、转录因子活化及影响炎症受体表达等作用,是调控炎症反应的关键分子。Cajal间质细胞(ICC)作为维持胃肠蠕动功能的关键性细胞,在各种胃肠蠕动功能障碍性疾病的发病中起着关键性作用,也是许多药物的靶点所在[3]。研究证实,手术操作等可损伤肠壁间神经网络、激活炎症启动细胞,激发瀑布式炎症反应,进而导致肠壁间的ICC受损,肠壁神经-平滑肌网络反应瘫痪,平滑肌起搏抑制,最终导致POI的发生[4]。
前期多中心临床研究证实[5],枳实通降颗粒对开腹及腹腔镜结直肠肿瘤术后POI的恢复有显著的促进作用,且POI的再发率、肺部感染等并发症的发生率均低于常规治疗组。其后的基础研究也显示:枳实通降颗粒具有较强的抗炎作用,作用强度与药物剂量在一定范围内呈正相关,但作用机制尚需进一步明确[6]。本研究继续以术后炎性肠梗阻模型大鼠为研究对象,观察枳实通降颗粒对模型大鼠小肠肠壁组织MK2磷酸化、炎症反应及c-kit表达的影响,探讨其防治POI的可能机制,对该药的深入开发和中医药在围手术期快速康复领域的推广应用具有重要意义。
1 材料与方法
1.1 实验药物
专利方枳实通降颗粒[7]由枳实10 g、乌药10 g、大腹皮10 g、广木香 10 g、黄柏10 g、泽泻12 g、三七6 g、西洋参6 g、川牛膝12 g、甘草6 g组成。实验所用传统中药饮片均由湖南新汇制药厂生产,由湖南省中医院(湖南中医药大学第二附属医院)门诊中药房提供,经湖南中医药大学第二附属医院药剂科周平兰教授鉴定,所有药材均达到合格标准。采用传统方法水煎浓缩后,制备成含药浓度为0.34 g·mL-1的药液,冷藏备用。阳性对照组采用琥珀酸普芦卡必利片(Janssen Cilag S.p.A,2 mg×7片/盒),批号:JGL6E00,以适量纯净水溶解制备成混悬液备用,含药浓度为0.036 mg·mL-1。
1.2 动物
SPF级SD大鼠84只 (合格证编号:110727191100 1708),鼠龄6周,雌雄各半,质量180-220 g。采购自斯莱克景达实验动物有限公司(湖南),许可证号:SCXK(湘)2016-0002,适应性喂养于湖南中医药大学动物实验中心实验室,许可证号:SYXK(湘)2019-0009,1周后开始实验。本实验已经该校实验动物理论委员会批准(LL2019092005)。
1.3 试剂
肿瘤坏死因子(TNF-α)、白介素-6(IL-6)及白介素-8(IL-8)试剂盒(上海晶天生物,E20200103012,E20200103011,E20200103010)、引物(上海生工,221020117)、逆转录试剂盒(美国 Promega,A3500)、PCR 试 剂盒(美 国 Promega,A6001)、TRIzol(美 国Invitrogen,15596018);G蛋白磁珠(美国Cell Signaling公司,9006S);蛋白质标志物(美国Thermo公司,26634);c-kit兔抗体(美国 ABclonal公司,A0357);β-Action兔抗体、羊抗兔IgG抗体(武汉贝茵莱生物科技有限公司,PAB36265 ,SAB43714)。
1.4 仪器
电泳仪、Real-time PCR仪(美国Bio-Rad);酶标仪(芬兰雷勃);全自动化学发光分析仪(上海天能)。
1.5 实验方法
1.5.1 动物分组及造模
84只SD大鼠按照随机数字表法随机分为7组:空白组、假手术组、POI模型组、中药(枳实通降颗粒)低、中、高剂量组和普芦卡必利组,每组各12只,雌雄各半,分别于术后24 h取材。所有大鼠于术前禁食24 h,禁水12 h,术后禁食不禁水。根据前期实验优化的造模方法[8]:3%戊巴比妥钠(3 mL·kg-1体质量腹腔注射)麻醉大鼠并固定,尽量按照无菌手术操作要求进行手术及取样:开腹,找到并以4号丝线结扎切除部分盲肠,然后用两根盐水棉签轻轻夹住肠管,由近心端小肠起始段向盲肠端轻柔摩擦肠壁,仅处理1次后即回纳肠管并关腹,手术时间控制在15 min左右;假手术组:仅单纯切开腹腔,湿盐水纱布覆盖切口后保持与手术组相同时间,不做其他任何操作,然后同法关腹。空白组不做处理。
1.5.2 给药方法
根据前期研究筛选的最优给药方法[6],于造模术后6 h,所有大鼠按5 mL·kg-1体重的剂量标准灌胃给药1次。给药剂量根据等效剂量计算公式进行折算后确定,中药低、中、高剂量组分别按照4.2 g·kg-1、8.3 g·kg-1、16.6 g·kg-1体重的标准给予枳实通降颗粒浓缩药液,普芦卡必利组按0.18 g·kg-1体重标准予混悬液,空白组、假手术组、模型组则给予同体积生理盐水。
1.5.3 检测肠道推进率及胃内容物残留率
术后23.5 h给予0.15 mL墨汁灌胃,30 min后麻醉大鼠,重新打开腹腔,夹闭胃的两端及小肠末端,自然状态下分别测量已染色部分及整个幽门以下肠管的长度,肠管黑染长度/全肠道长度×100%=肠道推进率(%)。完整取出胃体,分别测量全胃及胃内容物的质量,并按照(全胃质量-洗净后胃体质量)/全胃质量×100%的公式计算胃内容物残留率(%)。

表1 MK2及c-kit mRNA实时荧光定量PCR检测引物设计
表2 各组大鼠肠道推进率、胃内容物残留率比较(,%,n=12)

表2 各组大鼠肠道推进率、胃内容物残留率比较(,%,n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01。
胃内容物残留率26.13±8.30 33.40±5.27 82.46±4.64**63.61±6.03##55.58±6.27##52.91±3.82##52.95±6.96##组别空白对照组假手术组模型对照组中药低剂量组中药中剂量组中药高剂量组普芦卡必利组剂量---4.2 g·kg-1 8.3 g·kg-1 16.6 g·kg-1 0.18 mg·kg-1肠道推进率26.27±3.03 20.43±3.18 1.19±1.2**9.13±3.00##14.29±1.92##15.80±2.03##15.02±2.05##
1.5.4 ELISA法检测小肠组织中炎症因子IL-6、IL-8、TNF-α的含量
术后24 h,分别取大鼠靠近幽门端1段长2 cm的小肠肠管,-80℃冰箱保存,参照试剂盒要求进行裂解后匀浆、离心,取上清液进行检测。
1.5.5 免疫组化观察小肠组织的病理学改变及c-kit阳性细胞表达情况
术后24 h,取大鼠近幽门端长约2 cm的小肠一段,将标本进行切片及DAB染色,随机挑选3张切片进行分析,每张切片随机5个互不重叠视野在显微镜下(×200)观察检测,进行图像采集和分析,以胞膜出现棕黄色或褐色颗粒视为阳性表达,测定c-kit阳性细胞表达的平均光密度[9]。
1.5.6 Western blot检测小肠组织中MK2、p-MK2、ckit蛋白表达水平
术后24 h,取大鼠近幽门端长约2 cm的小肠组织,按照下列步骤进行检验:剪碎组织后加入适量裂解液,匀浆至完全裂解,离心后取上清液检测蛋白质含量。以定量结果为参考,取适量蛋白液与缓冲液混合,再次离心后依次加入一抗、二抗,转膜电泳,全自动化学发光分析仪检测分析,相关条带的灰度值采用TANONGIS软件读取,对比其蛋白相对表达量。
1.5.7 RT-PCR检测小肠组织中MK2、c-kit mRNA的相对表达水平
术后24 h,取大鼠近幽门端2段长约2 cm的小肠组织,首先从NCBI中下载基因序列,采用Primer 5.0软件设计引物,见表1。取组织20-50 mg,采用TRIzol法提取总RNA,即每个样本加入600 μL TRIzol,反复进行吹打、室温静置、离心等处理后,提取小肠组织中总的RNA,然后加入含有上下游引物、荧光染料的反应体系中,合成cDNA,接着配置反应体系、按照94℃4 min、94℃ 40 sec,60℃ 30 sec,×50 cycle完成扩增程序后行Real-time PCR检测,得到目的蛋白的CT值后,再以2-△△Ct法计算其mRNA的相对表达水平(RQ值)。
1.6 统计学方法
统计学处理采用SPSS 21.0软件进行分析。计量资料以平均值±标准差()表示,符合正态分布和方差齐性,多组比较则采用单因素方差分析,否则采用Kruskal-Wallis H检验。以α=0.05的标准,P<0.05为差异有统计学意义。
2 结果
2.1 比较各组大鼠肠道推进率、胃内容物残留率
与空白组及假手术组比较,模型组肠道推进率明显偏低,胃内容物残留率明显偏高(P<0.01);与模型组比较,中药各剂量组及普芦卡必利组能明显增加肠道推进率及降低胃内容物残留率(P<0.01),以枳实通降颗粒高剂量组疗效最好,但与中剂量组和普芦卡必利组比较,差异并无统计学意义(P>0.05)。见表2。
2.2 比较各组大鼠小肠组织中炎症因子IL-6、IL-8、TNF-α的含量
模型组小肠组织中IL-6、IL-8、TNF-α含量均明显高于空白组和假手术组(P<0.01);与模型组比较,药物治疗组炎症因子水平均明显低于模型组(P<0.01),以中药高剂量组效果最好,但与中剂量组及普芦卡必利组差异无统计学意义(P>0.05),优于中药低剂量组(P<0.05)。见表3。
表3 各组大鼠小肠组织中炎症因子含量比较(,pg·mg-1,n=12)
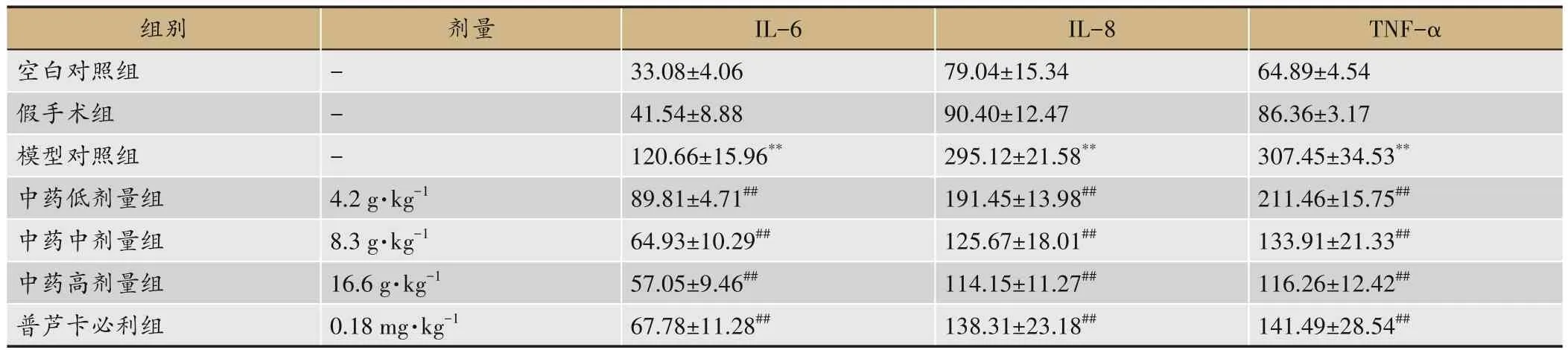
表3 各组大鼠小肠组织中炎症因子含量比较(,pg·mg-1,n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,##P<0.01。
组别空白对照组假手术组模型对照组中药低剂量组中药中剂量组中药高剂量组普芦卡必利组TNF-α 64.89±4.54 86.36±3.17 307.45±34.53**211.46±15.75##133.91±21.33##116.26±12.42##141.49±28.54##剂量---4.2 g·kg-1 8.3 g·kg-1 16.6 g·kg-1 0.18 mg·kg-1 IL-6 33.08±4.06 41.54±8.88 120.66±15.96**89.81±4.71##64.93±10.29##57.05±9.46##67.78±11.28##IL-8 79.04±15.34 90.40±12.47 295.12±21.58**191.45±13.98##125.67±18.01##114.15±11.27##138.31±23.18##

图1 各组大鼠小肠病理形态学改变及c-kit阳性细胞表达情况(×200)
表4 各组大鼠小肠组织中c-kit蛋白表达[WB(相对灰度)、免疫组化(平均光密度)]及m-RNA表达水平比较(,n=12)

表4 各组大鼠小肠组织中c-kit蛋白表达[WB(相对灰度)、免疫组化(平均光密度)]及m-RNA表达水平比较(,n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白对照组假手术组模型对照组中药低剂量组中药中剂量组中药高剂量组普芦卡必利组平均光密度0.37±0.05 0.32±0.04 0.16±0.02**0.22±0.03##0.29±0.03##0.31±0.03##0.27±0.02##剂量---4.2 g·kg-1 8.3 g·kg-1 16.6 g·kg-1 0.18 mg·kg-1相对灰度1.08±0.18 1.02±0.10 0.30±0.10**0.52±0.14#0.80±0.16##0.89±0.22##0.78±0.14##c-kit mRNA 1.14±0.21 1.05±0.13 0.31±0.09**0.50±0.15#0.82±0.14##0.89±0.17##0.79±0.10##
2.3 各组大鼠小肠组织病理形态改变及c-kit阳性细胞表达情况比较
与空白组及假手术组比较,模型组小肠组织可见明显水肿、炎症细胞浸润及组织坏死脱落,c-kit阳性细胞表达水平明显低于其他各组(P<0.01);药物治疗组病理组织结构改变较轻,c-kit阳性细胞(P<0.01),中药高剂量组效果最好,但与中剂量组及普芦卡必利组比较,差异无统计学意义(P>0.05)。见图1、表3。
2.4 比较各组大鼠小肠组织中MK2、p-MK2、c-kit蛋白及c-kit、MK2 mRNA的表达水平
与空白组及假手术组比较,模型组小肠组织中ckit、p-MK2蛋白及c-kit mRNA的表达水平明显低于其他各组(P<0.01);药物治疗组c-kit、p-MK2蛋白的表达明显高于模型组(P<0.01),以中药高剂量组最低,但与中剂量组及普芦卡必利组比较,差异无统计学意义(P>0.05)。各组MK2蛋白及mRNA的表达水平无明显差异(P>0.05)。见表4、5,图2。
表5 各组大鼠小肠组织中MK2、p-MK2蛋白及MK2 mRNA表达水平比较(,n=12)
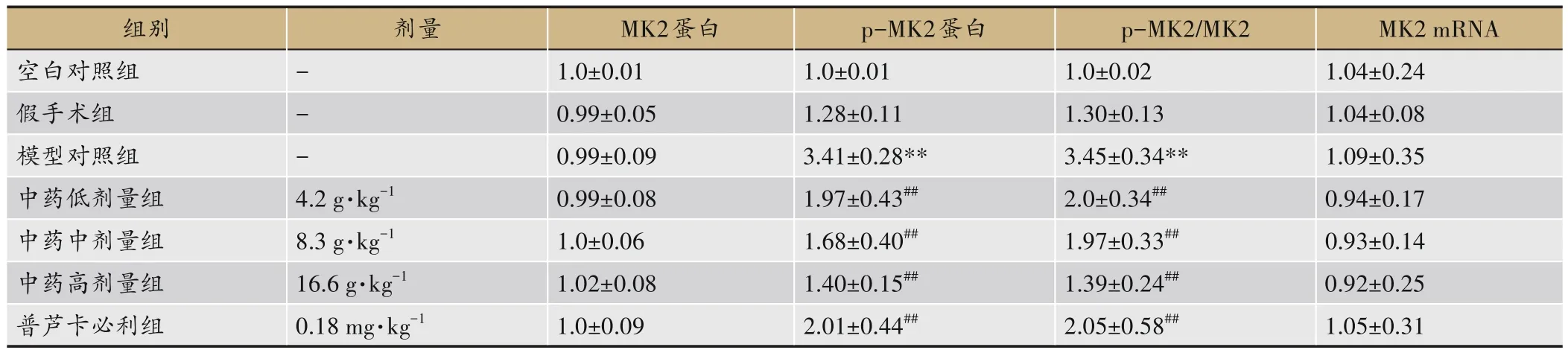
表5 各组大鼠小肠组织中MK2、p-MK2蛋白及MK2 mRNA表达水平比较(,n=12)
注:与空白组及假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白对照组假手术组模型对照组中药低剂量组中药中剂量组中药高剂量组普芦卡必利组MK2 mRNA 1.04±0.24 1.04±0.08 1.09±0.35 0.94±0.17 0.93±0.14 0.92±0.25 1.05±0.31剂量---4.2 g·kg-1 8.3 g·kg-1 16.6 g·kg-1 0.18 mg·kg-1 MK2蛋白1.0±0.01 0.99±0.05 0.99±0.09 0.99±0.08 1.0±0.06 1.02±0.08 1.0±0.09 p-MK2蛋白1.0±0.01 1.28±0.11 3.41±0.28**1.97±0.43##1.68±0.40##1.40±0.15##2.01±0.44##p-MK2/MK2 1.0±0.02 1.30±0.13 3.45±0.34**2.0±0.34##1.97±0.33##1.39±0.24##2.05±0.58##
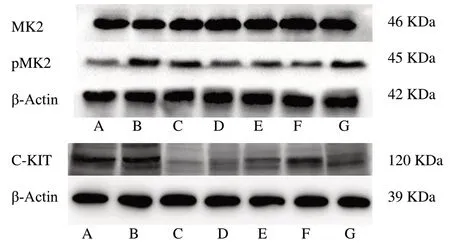
图2 各组大鼠小肠组织中MK2、p-MK2、c-kit蛋白表达条带图
3 讨论
炎症是导致POI的主要原因,炎症反应在手术后3-4 h开始逐渐明显,并于24 h左右达到最高峰,随后逐步下降。研究证实,术后早期若采取药物等措施抑制炎症反应的产生,可有效的促进POI的恢复及预防其相关并发症的发生[10]。ICC是一种连接于肠壁神经末梢和平滑肌细胞之间的网络状结构,可产生慢波电活动起搏肠壁平滑肌细胞产生收缩,是保障肠道蠕动功能的关键所在炎症等各种病理损害造成的胃肠功能障碍均与ICC细胞缺失/异常以及网络受损等密切相关[4],而胃肠蠕动功能障碍正是POI的主要特征之一,二者之间存在着密切的联系。c-kit是ICC的特异性标志物,观察c-kit在胃肠道的分布和表达,可准确的评估ICC细胞的活性及受损状态[11]。MK2作为调控炎症反应的关键分子[12-15],可因腹腔手术操作刺激而磷酸化,进而激活肠壁浆膜及平滑肌肌间神经丛处的常驻巨噬细胞[16],诱发IL-6、IL-8、TNF-α等炎症因子和细胞趋化因子的释放,诱导大量白细胞聚集并浸润于肠壁组织间,导致肠壁水肿、渗出、粘连,并使原癌基因c-kit表达受到抑制而无法促进肠壁ICC的分化成熟,最终导致肠壁平滑肌细胞电生理活动被抑制,起搏功能丧失,肠壁平滑肌麻痹,形成POI[17]。
枳实通降颗粒由经典方五磨饮子及三妙散加减而成,药理学研究证实,其所含有效成分具有较好的抗炎、抗感染、调节免疫、促进平滑肌收缩等作用[18-19]。方中枳实、广木香、乌药及大腹皮可促进胃肠道平滑肌蠕动;西洋参可调节机体免疫力,预防感染等作用;三七提取物能促进血液循环,保护小鼠缺血再灌注导致的肠道粘膜损害,促进肠道蠕动功能障碍恢复;黄柏具有较强的抗炎及抗感染作用,对多种致病细菌有较强的抑制作用;牛膝不仅可抗炎、镇痛,还能促进肠管收缩;泽泻具有较强的的利尿和调节免疫力的作用;甘草具有解毒、抗炎抑菌、抗病毒及调节免疫作用。全方行气活血、益气养血、清热利湿,行而不峻,补而不腻,清利而不伤津液,具有较强的抗炎、促进血液循环、增强免疫力和促进胃肠蠕动功能,切合于腹部术后本虚标实,气血亏虚,瘀血湿热内停的病机特点。
本实验研究结果证实:枳实通降颗粒能有效的抑制POI大鼠模型肠壁组织中MK2磷酸化,降低IL-6、IL-8、TNF-α等炎症因子的水平,促进术后胃排空及肠道蠕动,其作用强度与用药时间和剂量存在一定的正相关性,证实该方具有较强的抗炎和促进术后胃肠功能恢复的作用,这种作用主要是通过抑制MK2磷酸化来实现的。枳实通降颗粒各剂量组c-kit的表达明显高于模型组,从而提示其具有保护ICC细胞的功能。基于以上研究表明:枳实通降颗粒可通过抑制MK2磷酸化,有效的抑制因手术等原因导致的肠壁炎症反应,调控c-kit的表达水平,保护和恢复ICC细胞功能,从而达到防治术后炎性肠梗阻的目的。本次研究虽然从MK2,p-MK2及c-kit的表达作为研究的切入点论证了其作用机制,但中药复方的成分及作用机制非常复杂,是多靶点、多通路作用,其关键性启动点和各条通路之间的是否具有相互作用仍未明了,需待进一步的研究。
