地榆对脂多糖诱导的肠道屏障损伤模型的保护作用*
2022-03-28杨丽萍宋娜丽段小花
杨丽萍,宋娜丽,陈 普,段小花**
(1.云南中医药大学云南省傣医药与彝医药重点实验室 昆明 650500;2.云南省中医中药研究院 昆明 650223)
肠道黏膜是机体防御的第一道防线,具有选择通透性。完整的肠道屏障对维持上皮细胞通透性、机体内环境稳态有关键作用。肠道屏障功能的破坏可引起肠上皮通透性升高,导致肠腔内细菌和内毒素等通过肠上皮进入机体造成炎症反应,甚至可出现多器官功能衰竭[1]。肠屏障功能受多种细胞因子和细菌内毒素的调控,并且与多种疾病的发生发展有关,如炎症性肠道疾病、胰腺炎、肝病以及代谢紊乱性疾病等[2]。预防和治疗肠黏膜屏障功能损伤已成为当前研究的重要课题之一[3-4]。研究发现,肠道屏障在炎症性肠病的病理过程中起关键作用,肠黏膜屏障完整性的破坏是炎症性肠病发生和发展的基本过程,由此引发的肠道对细菌、内毒素等的吸收增加从而导致机体异常免疫调节和炎症反应,是病情进展的核心环节[5-6]。因此,保护肠屏障的完整性在一定程度上能够抑制炎症性肠病的病理进程,可作为改善炎症性肠病临床症状的潜在治疗方法之一[7]。
地榆(Sanguisorbae Radix)为蔷薇科植物地榆(Sanguisorba officinalis L.)或 长 叶 地 榆Sanguisorba officinalis L.var. longifolia (Bert). Yü et Li的干燥根,具有凉血止血、解毒敛疮的功效,有“痔科圣药”之称,常用来治疗直肠炎、溃疡性结肠炎等肠道疾病。动物实验发现,地榆对溃疡性结肠炎大鼠模型作用显著,其作用可能与抑制炎性细胞因子有关[8-9],其单药或复方在临床中也常治疗溃疡性结肠炎等肠道相关疾病[10-13]。李丽等[14]研究发现,地榆可通过调节急性溃疡性性结肠炎大鼠肠道菌群,修复肠道屏障而发挥治疗作用。但更进一步的,地榆对肠道屏障的修复是否还与调节肠道紧密连结和细胞凋亡等有关,目前暂未发现相关报道。
基于此,本研究利用LPS建立体内外肠道屏障功能损伤模型,通过肠上皮细胞凋亡、紧密连结以及细胞炎症因子等方面深入探讨地榆对肠道屏障功能的作用,以期从肠道屏障的角度为地榆的临床应用提供实验基础。
1 材料
1.1 动物和细胞株
昆明种小鼠SPF级72只,雌雄各半,体质量(20 ±2)g,购自四川省医学科学院实验动物研究所,生产许可证号:SCXK(川)2015-030;IEC-6细胞购自美国ATCC细胞库。
1.2 主要试剂和仪器
DMEM高 糖 培 养 基(BI,货 号 06-1055-57-1ACS);胰蛋白酶(BI,货号 03-050-1B);胎牛血清(BI,货号04-001-1A);青霉素/链霉素(BI,货号03-031-1B);脂多糖 LPS(sigma,货号 L2630-25MG);occludin(proteintech,货号 27260-1-AP);Goat antirabbit secondary antibody(proteintech,货号 SA00001-2);IL-1β ELISA Kit(proteintech,货 号 KE10003);TNF-α ELISA Kit(proteintech,货号 KE10002);DLactate Assay Kit(abcam,货号ab83429);总RNA提取试剂盒(promega,货号LS1040);Eastep RT Master Mix(5X) 逆转录预混液(promega,货号 LS2050);Eastep qPCR Master Mix(2X)试剂盒(promega,货号LS2062);Annexin V/PI试剂盒(凯基生物,货号KGA107);二氧化碳培养箱(美国nuaire,NU-4750E);酶标仪(美国Thermofisher,VariosKan Flash);倒置显微镜(日本尼康);流式细胞仪(德国CyFlow Cube6);荧光定量PCR仪(美国ABI,7500)。
1.3 地榆醇提物的制备
地榆购自云南鸿翔一心堂药业股份有限公司,经鉴定为质量合格的中药饮片。称取地榆药材1 kg,用10倍70%乙醇提取3次,每次1 h,合并3次提取液,浓缩至合适的体积后-20℃保存备用。
2 方法
2.1 体外实验
2.1.1 细胞培养和处理
IEC-6细胞以含10%胎牛血清和1%青霉素/链霉素的DMEM培养基在37℃、5% CO2条件下培养,等细胞融合至70%-80%进行传代。0.25%胰酶消化处于对数生长期的细胞并接种于96孔板中,分为空白组、LPS组、LPS+地榆不同剂量组(35,70,140,280,560 μg生药·mL-1),每组设6个重复,培养24 h后每组分别加入不同浓度的药物,1 h后加入100 μg·mL-1的LPS,继续培养24 h后检测相关指标。
2.1.2 MTT检测细胞活力
IEC-6 细胞以 1 × 105cells·mL-1接种于 96 孔 板24 h后,换入无血清培养基,24 h细胞周期同步化后,分组并加入相应药物及含血清培养基,继续培养24 h后进行MTT法检测细胞存活率,以吸光度(OD)表示细胞相对活力。
2.1.3 免疫荧光检测occludin蛋白的表达和分布
IEC-6细胞按1 × 104接种至6孔板培养过夜后更换培养基并加入地榆提取物,1 h后加LPS(100 μg·mL-1)继续培养。24 h后弃去培养基并用多聚甲醛固定,用0.1% Triton X 100透化并用羊血清封闭30 min,加一抗4℃过夜,PBS清洗后二抗37℃孵育30 min,封片并在荧光显微镜下观察和拍照。Image J软件进行平均光密度(AOD)分析。
2.1.4 ELISA检测IL-1β和TNF-α水平
IEC-6细胞按1 × 105cells·mL-1)接种于96孔板并过夜,分组并给予相应药物处理24 h后收集细胞上清液,3000 r·min-1离心20 min,收集上清液后按相应的ELISA试剂盒说明书用酶标仪检测IL-1β和TNF-α的水平。
2.1.5 流式细胞仪检测细胞凋亡
IEC-6细胞按 1 × 105cells·mL-1接种于 6 孔板,药物处理24 h后收集细胞,按照Annexin V/PI试剂盒说明书的步骤处理细胞并上流式细胞仪检测细胞凋亡水平。
2.2 体内实验
2.2.1 动物给药和分组
昆明小鼠分为正常对照组、LPS组和地榆高、低剂量组,参考文献建立小鼠肠道屏障损伤模型[15],正常组和LPS灌胃给予蒸馏水,剩下两组灌胃给予不同剂量的地榆(2.25,6.75 g·kg-1),在第7天灌胃结束2 h后,对除正常组外的其余组别小鼠一次性腹腔注射5 mg·kg-1的LPS,2 h后摘眼球取血分离血清检测相关指标,另取结肠部分于液氮中保存备用,另一部分在10%福尔马林中固定用于后续组织病理学检测。
2.2.2 ELISA检测小鼠血清D-乳酸水平
取小鼠血清,按ELISA试剂盒说明书,用酶标仪检测小鼠血清中D-乳酸水平,用来检测肠道通透性。
2.2.3 Western Blot检测occludin蛋白的表达
小鼠结肠用裂解液裂解后,BSA测蛋白浓度并调整浓度后采用SDS-PAGE凝胶电泳分离、转膜并封闭后一抗孵育过夜,后用二抗孵育2 h,曝光检测,以β-actin作为内参采用Image-J软件对条带进行量化分析。
2.2.4 RT-PCR检测小鼠结肠TNF-α mRNA和IL-1β mRNA的表达
将已取好的结肠在液氮下研磨后提取总RNA,紫外和电泳检测RNA纯度及完整度,按逆转录试剂盒说明书完成逆转录,以生成的cDNA为模板进行PCR扩增,扩增程序为:95℃ 5 min,( 95℃,15 s)× 40,60℃ 30 s。采用2-△△CT相对定量法计算各组结肠TNF-α mRNA和IL-1β mRNA的相对表达水平。引物序列见表1。
2.3 统计学方法
采用GraphPad prim 5软件进行数据分析,实验数据用均值 ± 标准差()表示,多组比较采用单因素方差分析,P< 0.05为差异具有统计学意义。
3 结果
3.1 地榆对IEC-6细胞活力的影响
图1结果显示,地榆在35-560 μg·mL-1范围内对正常IEC-6细胞活力无显著影响,各组间无统计学差异(P> 0.05),说明地榆在这个剂量范围内无明显毒性。加入100μg·mL-1的LPS处理24 h后,可显著抑制IEC-6细胞活力,差异具有统计学意义(P< 0.01),不同浓度地榆预孵育能减弱LPS对IEC-6细胞活力的抑制效应,差异具有统计学意义(P< 0.05),说明地榆对LPS诱导的IEC-6细胞损伤具有保护作用。
3.2 地榆对LPS导致的IEC-6细胞凋亡的影响(晚期Q2+早期Q3,%)
流式细胞术结果表明,和对照组相比,LPS刺激组细胞早凋和晚凋细胞数量明显增加,细胞凋亡率明显增加,差异具有统计学意义(P< 0.01),地榆预处理后可以明显减少LPS导致的细胞凋亡增加(P< 0.05)(见图2)。
3.3 地榆对IEC-6细胞紧密连接蛋白occludin表达的影响
图3免疫荧光结果表明,正常IEC-6细胞occludin蛋白主要分布在细胞膜,呈蜂巢状线性分布,在细胞周围形成环状结构。LPS处理后细胞膜上occludin的环状结构出现断裂,荧光信号较弱。地榆预处理后occludin在细胞膜上的荧光信号相对LPS组明显增强,且未出现明显断裂。

表1 RT-PCR引物序列
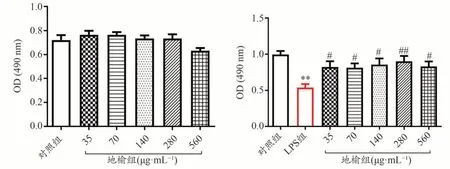
图1 地榆对IEC-6细胞活力的影响
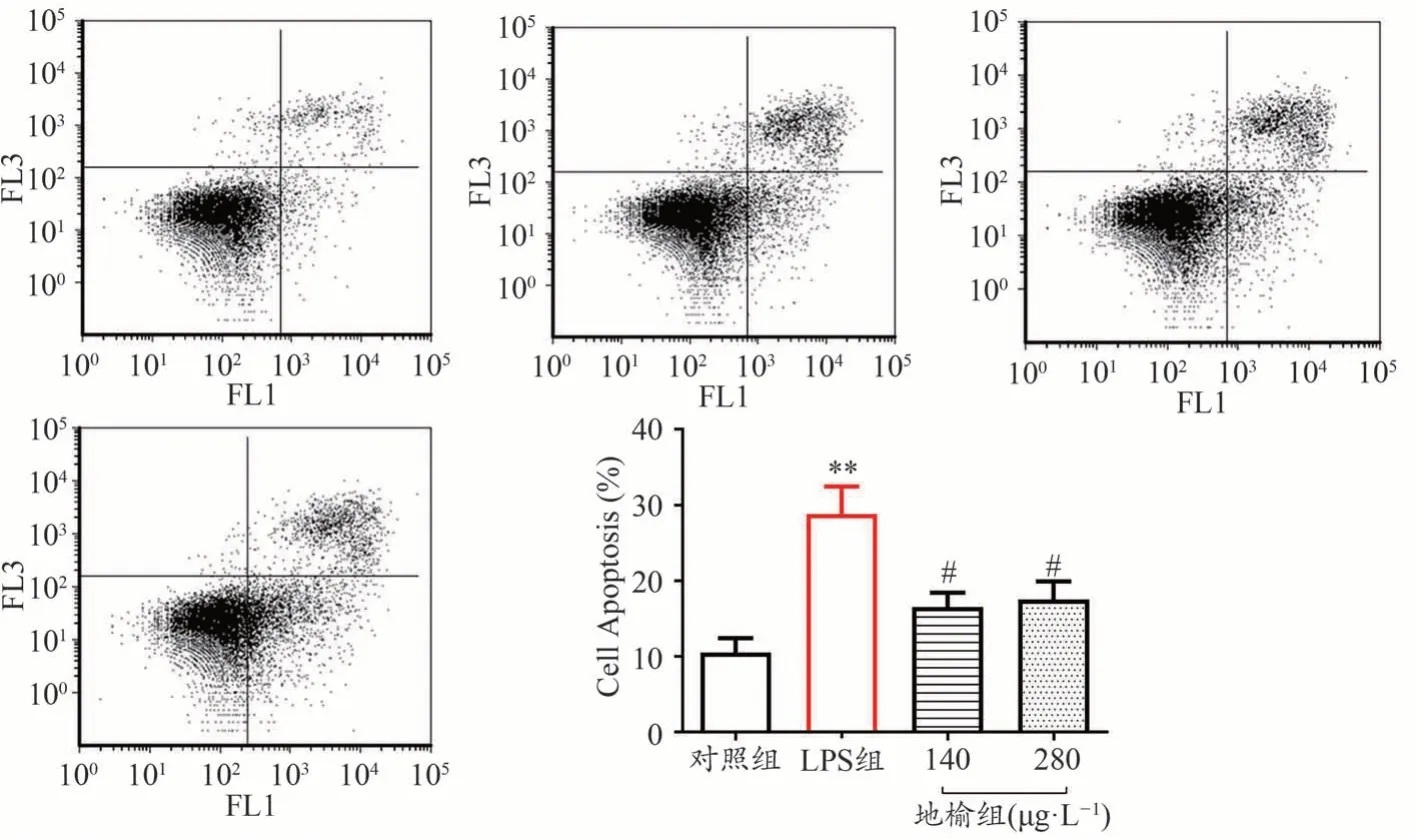
图2 地榆对LPS诱导的IEC-6细胞凋亡的影响

图3 地榆对LPS诱导的IEC-6细胞occludin紧密连接蛋白表达的影响(400X)
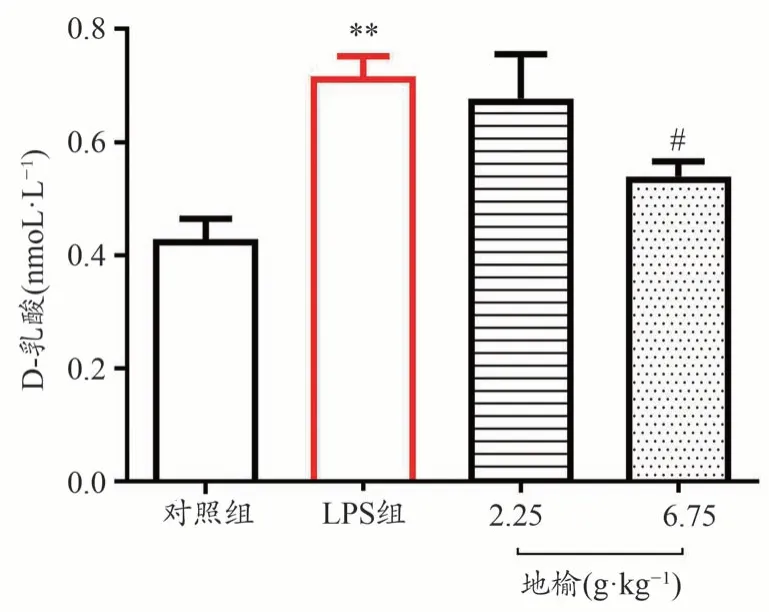
图4 地榆对小鼠血清D-乳酸水平的影响
3.4 地榆对LPS导致的小鼠肠道屏障通透性的影响
图4显示,腹腔注射LPS后,小鼠血中D-乳酸水平明显升高,说明肠道黏膜损伤后引起肠道通透性增加(P< 0.01),地榆在6.75 g·kg-1剂量下能显著减少小鼠血清中D-乳酸的水平(P< 0.05),表明地榆有利于LPS导致的小鼠肠道屏障完整性和通透性的改善。
3.5 地榆对小鼠结肠组织中紧密连接蛋白occludin表达的影响
与正常组比较,LPS组小鼠结肠occludin蛋白表达水平显著降低(P< 0.01),与LPS组比较,地榆高剂量组结肠的occludin表达显著升高(P< 0.01)。见图5。
3.6 地榆对LPS导致的炎症因子水平的影响

图5 地榆对小鼠结肠组织occludin表达水平的影响
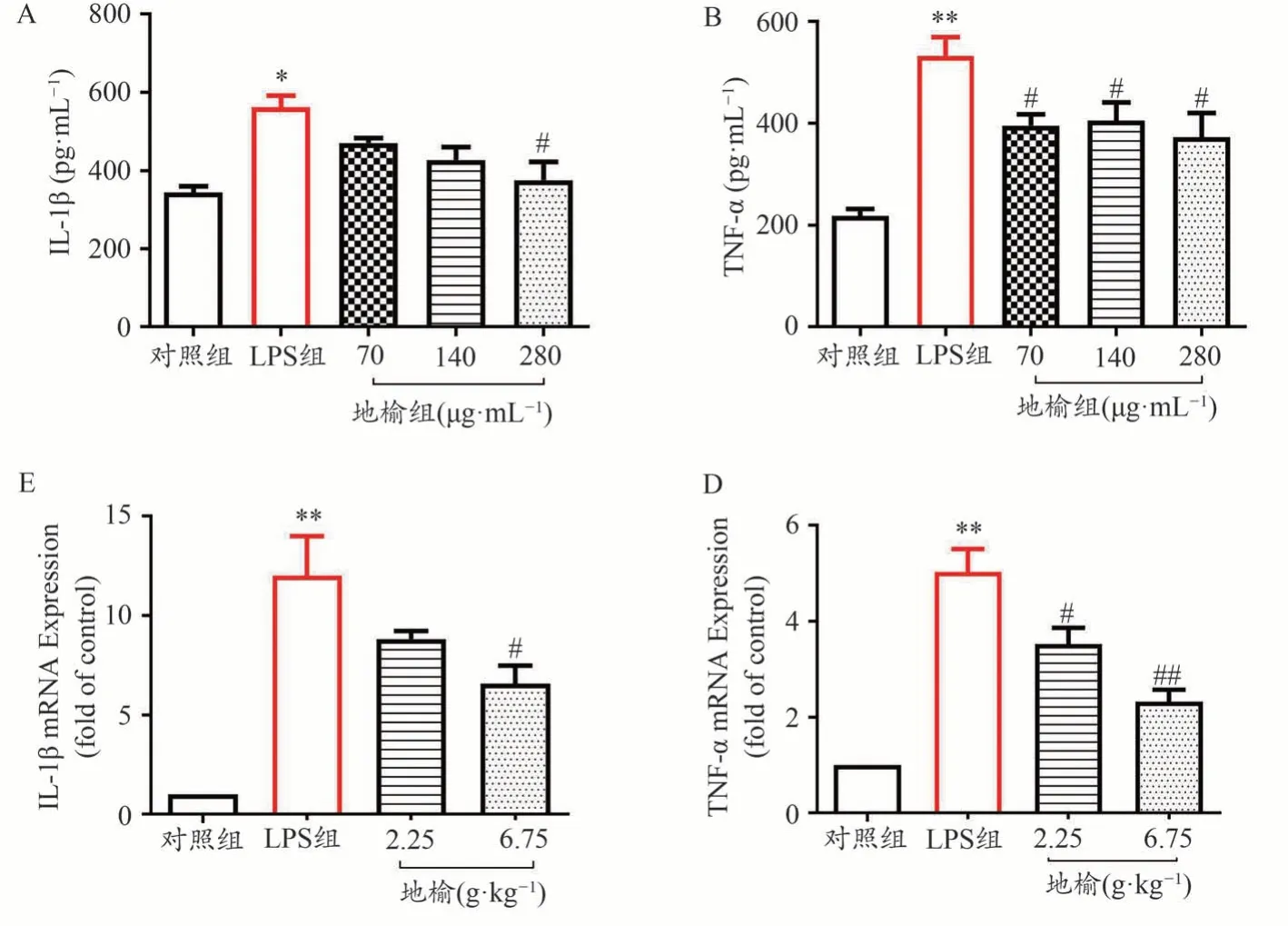
图6 地榆对IL-1β和TNF-α的影响
从图6可知,LPS组细胞上清液中IL-1β和TNF-α水平显著增加(P< 0.01),地榆预处理后能够明显抑制LPS导致的IL-1β和TNF-α水平增高(P< 0.05),表明地榆能够缓解LPS刺激导致的炎症因子的释放增加。RT-PCR检测结果表明,地榆能显著抑制LPS诱导后小鼠结肠中IL-1β和TNF-α的mRNA表达增加(P< 0.05),和体外实验结果一致。
4 讨论
肠道作为抵御各种病原体和抗原入侵的屏障,是由完整的肠上皮细胞和相邻细胞间的紧密连接及粘液层构成,肠道内的细菌、炎性物质、内毒素以及上皮细胞凋亡都会影响肠屏障功能[16]。当遭受损伤时,肠道内细菌通过受损部位进入血液循环,引起一系列炎症反应加重肠黏膜屏障损伤,导致肠道通透性升高,引起肠道细菌移位和促炎因子大量释放,进一步破坏肠黏膜屏障的完整性,导致全身炎症反应,从而加重原发疾病,甚至诱发多器官功能紊乱和衰竭[17]。LPS是革兰氏阴性菌内毒素,研究表明,LPS可刺激巨噬细胞和中性粒细胞释放炎症介质,损伤肠上皮紧密连接,诱导细胞凋亡发生,增加肠道通透性,诱发炎症反应导致肠道屏障功能障碍[18-19]。当屏障结构受到损伤时,引起肠道内细菌、内毒素等病原体穿过肠屏障入侵机体,引起机体的炎症反应等,从而危害机体健康。肠黏膜屏障在防止细菌和内毒素易位方面起着至关重要的作用[20]。
小肠隐窝上皮细胞在肠道细胞中是一种重要的功能性细胞,肠道黏膜损伤后主要依靠隐窝上皮细胞的不断增殖、分化来完成修复,以重建肠道的屏障功能,是对抗肠道细菌、毒素的第一道防线[21]。IEC-6细胞来源于大鼠小肠隐窝细胞,广泛用于肠屏障修复相关的研究[22]。研究报道LPS可抑制IEC-6细胞增殖[23-24],本文结果和文献报道一致,LPS在100 mg·mL-1浓度下能够明显抑制IEC-6细胞的活力,而地榆能够明显抑制LPS导致的IEC-6细胞毒效应,且在该有效浓度内对无明显毒性。研究表明,上皮细胞凋亡增加是肠道屏障功能障碍的原因之一[25],肠炎患者肠上皮细胞的凋亡速率增加,细胞凋亡后所留下的空隙不能被及时有效的填充,导致肠上皮细胞屏障连续完整性破坏,肠道通透性增加,细菌和内毒素等物质可通过肠道入血,刺激炎性细胞因子的过度释放[26]。本研究中细胞凋亡检测结果显示LPS可以诱导IEC-6肠上皮细胞的凋亡,地榆则可显著降低LPS引起的细胞凋亡率,可能是保护炎症环境下肠屏障功能的机制之一。
肠道紧密连接是一种肠黏膜上皮细胞间特殊的结构,由不同功能的蛋白质(occludin、ZO-1等)组成并包绕在细胞腔侧端,在维持肠上皮细胞通透性中起着极其重要的作用,它能够选择性的允许离子和小分子物质通过,阻止肠腔内病原微生物进入体内,紧密连接蛋白受损会引起肠道通透性改变[27-28]。D-乳酸是细菌发酵的代谢产物,在肠道黏膜屏障完整时不会进入血液循环,一旦肠道屏障受损,通透性增加,肠道大量D-乳酸会进入血液中,检测D-乳酸可以有效反映肠黏膜损害程度和肠道通透性的变化[29]。因此,D-乳酸被认为是肠黏膜损害和通透性增加的有效预警指标[30-31]。在LPS导致的小鼠肠道屏障损伤模型中,LPS组小鼠血清中D-乳酸显著高于正常组,提示LPS引起肠道屏障受损,导致肠道通透性增加。地榆可显著降低LPS导致的小鼠血清D-乳酸水平,结肠HE染色发现地榆对LPS导致的结肠病理损伤具有一定的改善作用。免疫荧光结果发现,LPS可引起IEC-6细胞紧密连接蛋白occludin表达和分布异常,而地榆预处理后可见occludin的表达明显增强。结果提示,地榆可以维持和保护LPS导致的肠道屏障功能受损。
细胞炎症因子在肠屏障功能损伤病变中具有非常重要的作用,参与了各类炎症反应的发生过程[32]。肠屏障受损时,肠腔内抗原分子移位并激活免疫细胞,产生大量炎性细胞因子,如IL-1β和TNF-α等,这些因子通过炎性反应调节紧密连接蛋白的表达,增加肠上皮屏障通透性,加剧肠屏障的损伤,导致恶性循环[33]。TNF-α为早期单核或巨噬细胞合成并释放的炎性因子,在炎症反应中主导激活细胞因子级联反应,启动其他一系列细胞因子的产生和释放,使炎症介质大量过度释放。研究表明,TNF-α是引起肠道屏障损伤的重要启动因子,它不仅可以通过破坏紧密连接蛋白使肠道通透性增加,而且还会诱导IL-1β和IL-6等细胞因子分泌,推动炎症级联反应,进一步加剧紧密连接的损伤[34-36]。IL-1β为单核细胞和巨噬细胞产生的高效促炎细胞因子,研究认为与肠道炎症的发展有关。在感染、粘膜损伤和压力的作用下,巨噬细胞能够释放IL-1β,进而刺激T细胞增殖并触发粘膜免疫反应,从而促进TNF-α表达的上调[37]。研究报道IL-1β还可通过激活肠上皮细胞NF-κB通路,增加肠道通透性,降低紧密连接蛋白的表达[38]。既往研究表明,地榆可以抑制溃疡性结肠炎大鼠血清IL-1β和肠组织中NF-κB表达,升高IL-10水平[8]。本文研究结果显示,LPS刺激后的IEC-6细胞以及小鼠均出现TNF-α和IL-1β表达显著上升的现象,地榆可以显著抑制LPS刺激导致的炎症细胞因子释放增加,提示地榆对肠道屏障功能的保护作用与减轻炎症有关。
综上所述,地榆可抑制炎症细胞因子释放和肠上皮细胞凋亡,促进紧密连接恢复,改善肠道通透性,从而维持和保护肠道屏障功能。通过研究结果,可推测地榆对肠道屏障的保护作用可能和其抗炎作用和抑制凋亡有关。
以往研究显示地榆可以通过改善溃疡性结肠炎模型大鼠的肠道菌群组成而修复肠黏膜屏障[14],本实验进一步深入探讨了地榆对肠道物理屏障关键指标的影响,为地榆在临床中治疗肠道相关疾病提供了实验证据。
近年研究结果显示,肠道屏障功能损伤除了和肠道相关疾病有关外,更和糖尿病、肝病、精神疾病等息息相关[39]。在后续的研究中,我们将对对地榆保护肠道屏障的作用组分或成分做进一步的研究和探索,并对其中相关机制进行深入研究,为保护肠道屏障功能的药物研发提供一定参考。
