桥尾蛋白磷酸化参与大鼠螺旋神经节神经元GABAA受体内化△
2022-03-28林晓宇韦芳玉覃江圆叶莞丽易健启陈慧英刘金兰覃继新苏纪平
林晓宇 韦芳玉 覃江圆 叶莞丽 易健启 陈慧英 刘金兰 覃继新 苏纪平
GABAA受体(GABA type A receptors,GABAARs)是神经系统中重要的抑制性受体,介导GABA发挥快速的突触抑制作用,与兴奋性受体共同维持神经元和神经网络的兴奋-抑制平衡[1]。GABAARs在胞膜表达,存在内化与外化的动态平衡,当胞膜GABAARs表达下降,兴奋-抑制失衡,将导致神经元兴奋毒性,从而介导多种神经系统疾病,如脑缺血、癫痫等。维持GABAARs在细胞膜上的动态平衡受多个环节、多种因素的影响,包括受体自身的翻译后修饰以及受体转运等,其中,与GABAARs相互作用的桥尾蛋白(gephyrin)对受体内化具有重要作用。桥尾蛋白(gephyrin)与GABAARsα1-3、γ2亚基直接结合或共定位,负责将GABAARs锚定在细胞膜上,敲除桥尾蛋白后突触后膜的GABAARs减少。桥尾蛋白的功能与其C域上存在多个磷酸化修饰位点有关,研究证明,糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)磷酸化修饰桥尾蛋白S270位点[2~4],C域上丝氨酸S270磷酸化增强会减弱微小抑制性突触后电流,抑制S270磷酸化增加GABAARs突触后密度[2]。尽管有报道耳蜗存在桥尾蛋白[5],但是,关于桥尾蛋白在听觉神经系统的作用却知之甚少。
Qin等[6]发现水杨酸钠(sodium salicylate,SS)抑制螺旋神经节神经元(spiral ganglion neurons,SGNs)膜上的GABAARs表达,可逆地抑制GABAARs电流,SGNs兴奋毒性与SS诱导的GABAARsβIII亚基S383磷酸化增强有关,然而,GABAARs磷酸化后的内化与桥尾蛋白的关系尚不清楚。考虑在SS作用下,SGNs中的桥尾蛋白S270磷酸化增强,介导GABAARs的内化增强,使膜上GABAARs表达减少,从而介导SGNs的兴奋毒性作用;锂离子通过竞争性结合GSK3β活性需求的Mg2+位点抑制GSK3β,体外1~2 mM的锂离子浓度即可抑制GSK3β活性[7],故可通过LiCl抑制S270磷酸化观察GABAARs内化是否恢复。本研究拟采用实时荧光定量PCR和免疫印迹技术,观察 SS作用下,SGNs膜表面GABAARsα2亚基及其总蛋白、桥尾蛋白的表达,继而探索桥尾蛋白S270磷酸化如何影响GABAARs内化,进一步探讨GABAARs内化的机制。
1 材料与方法
1.1实验动物及分组 新生2~3天SD大鼠12只,雌雄不分,由广西医科大学实验动物中心提供,大鼠随机分成四组:对照组、5 mM SS处理组(SS组)、1 mM LiCl处理组(Licl组)、5 mM SS联合1 mM LiCl处理组(SS+LiCl组),每组3只。
1.2主要试剂与仪器 主要试剂:10×多聚赖氨酸、100×青链霉素混合液、1×磷酸盐缓冲液(PBS)、鼠抗GAPDH购自北京索莱宝公司;DMEM/F-12培养基、胎牛血清、0.25%含EDTA胰蛋白酶购自美国Gibco公司;SS购自美国Sigma公司,LiCl购自上海阿拉丁公司,反转录试剂盒购自北京全式金公司,Mem-PERTMPlus Membrane Protein Extraction Kit膜蛋白提取试剂盒、PageRulerTMPrestained Protein Ladder,10 to 180 kDa购自美国Thermo Fisher公司;Trizol 、SYBR Green PCR试剂盒购自美国Invitrogen公司,BCA蛋白浓度测定试剂盒购自上海碧云天公司;兔抗GABRA2(GABAARsα2)抗体购自美国Abcam公司,兔抗Gephyrin抗体购自上海酶联公司,鼠抗Gephyrin phospho-S270购自德国SYSY公司,山羊抗兔或者山羊抗鼠荧光二抗购自美国CST公司。主要仪器:NanoDrop One 超微量核酸蛋白测定仪、细胞恒温培养箱购自美国Thermo Fisher公司,StepOne Plus qPCR反应仪购自美国ABI公司,电泳槽购自美国BIO-RAD,红外扫描仪购自美国Odyssey公司。
1.3实验方法
1.3.1SGNs原代培养与药物处理 各组SD大鼠用75%酒精消毒头颈部皮肤,断头后对半剪开并剔除脑组织,放4 ℃PBS备用。在解剖显微镜下,用显微镊将耳蜗完整取出,进一步去除基底膜和螺旋韧带,剩下富含SGNs的蜗轴;将蜗轴在显微镜下撕碎之后,放进0.25%含EDTA的胰酶中消化,之后终止消化、离心,倒掉上清液,加入含胎牛血清的DMEM/F-12培养基进行重悬,将细胞种植到用多聚赖氨酸预包被的培养皿上,放进细胞恒温培养箱。细胞培养48 h后,SS组、LiCl组和SS+LiCl组分别用5 mM SS、1 mM LiCl、5 mM SS联合1 mM LiCl处理 1 h,对照组不予处理。
1.3.2实时荧光定量PCR(RT-qPCR) 检测各组GABAARsα2亚基、桥尾蛋白基因表达的改变。用Trizol提取各组细胞总RNA之后,测定所提取的总RNA浓度和纯度,按照全式金逆转录试剂盒操作步骤,将样本的RNA逆转录成cDNA;采用SYBR Green荧光染料法对目的基因和内参基因进行扩增,引物序列由上海生工公司进行合成(表1),用2-△△Ct法计算目的基因的相对表达量。
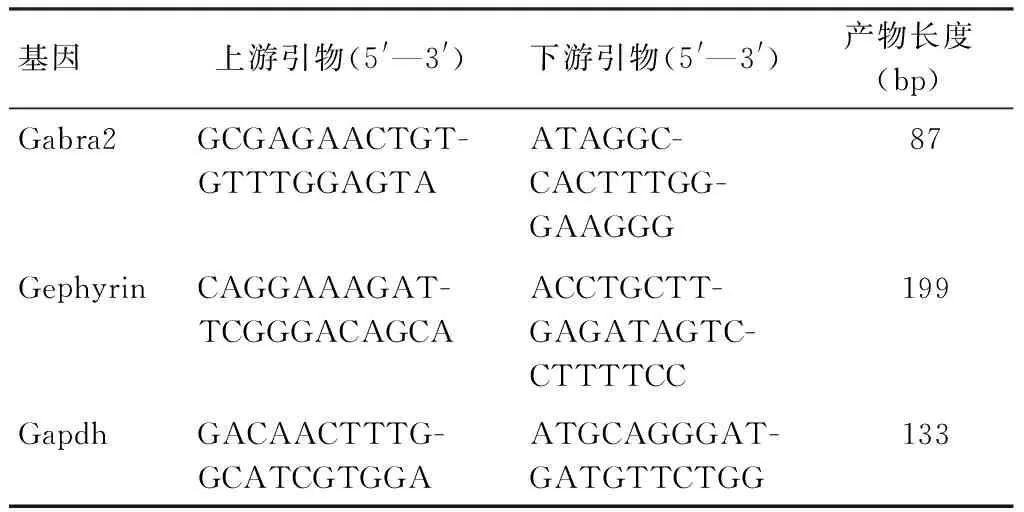
表1 相关基因的引物序列
1.3.3免疫印迹试验(Western blot,WB) 检测各组GABAARsα2膜蛋白和总蛋白表达的改变、桥尾蛋白及其S270位点磷酸化的改变。用膜蛋白提取试剂盒提取膜蛋白,用RIPA裂解液提取总蛋白,之后BCA试剂盒测定蛋白浓度,100 ℃金属浴热变性6 min;用10%SDS-PAGE凝胶电泳,每孔加入55 μg样品,根据蛋白Marker指示位置及目的蛋白分子量切胶,之后转膜、封闭,按照目的蛋白的抗体说明书比例稀释一抗,4 ℃孵育条带过夜;第二天用TBST洗膜3遍,每遍8 min,按照1∶15 000比例稀释荧光二抗,在室温孵育1.5 h,之后用TBST洗膜3遍,每遍8 min;最后用Odyssey红外扫描仪扫描条带,用Image-J软件计算条带密度值。桥尾蛋白S270磷酸化以桥尾蛋白总量标化,其余条带以GAPDH作为内参,计算目的蛋白的相对表达量。
2 结果
2.1各处理组GABAARsα2亚基、gephyrin基因表达变化 RT-qPCR结果显示,SS组、LiCl组、SS+LiCl处理组,GABAARsα2亚基基因表达较对照组无明显变化(F=1.764,P>0.05),各处理组gephyrin基因表达与对照组比较均无明显差异(F=0.802,P>0.05)(表2)。
2.2各组Western blot检测结果 SS组细胞膜表面GABAARsα2亚基较对照组表达显著下调,差异有统计学意义(P=0.003<0.01),总蛋白较对照组表达无明显变化(P=0.68>0.05)(图1,表3),与RT-qPCR结果一致,提示SS作用下GABAARs发生内化。SS组gephyrin总蛋白比对照组稍上升,但差异无统计学意义(P=0.183>0.05),gephyrin S270位点磷酸化较对照组显著增强(图2,表3),差异有统计学意义(P=0.000 135<0.001),提示SS作用下,GABAARs内化的同时,gephyrin S270位点磷酸化增强。
SS+LiCl组gephyrin S270位点磷酸化较SS组减弱(P=0.036<0.05),较对照组显著增强(P=0.003<0.01)(图2,表3),提示SS部分经由GSK3β增强gephyrin S270磷酸化修饰。同时,SGNs膜表面GABAARs α2亚基较SS组上调(P=0.027<0.05),较对照组表达稍下调(图1,表3),但差异无统计学意义(P=0.176>0.05),提示LiCl逆转SS对GABAARsα2亚基的内化作用。
LiCl组GABAARs α2亚基膜蛋白、总蛋白、gephyrin、gephyrin S270磷酸化与对照组比较均无明显变化(图1、2,表3)。

图1 各组GABAARsα2亚基膜蛋白、总蛋白的表达
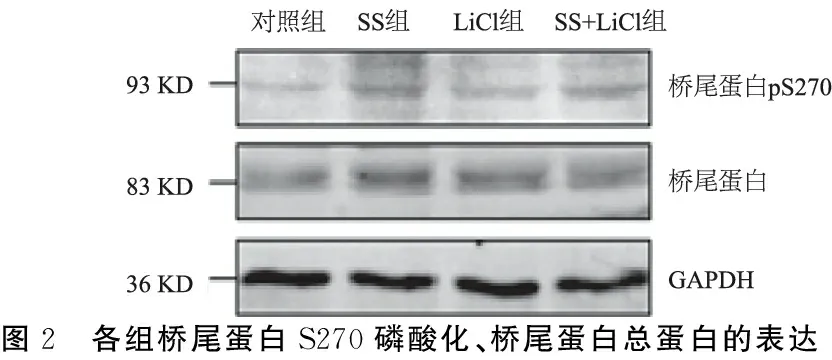
图2 各组桥尾蛋白S270磷酸化、桥尾蛋白总蛋白的表达

表2 各组GABAAR α2亚基、桥尾蛋白 mRNA相对表达量
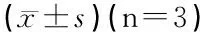
表3 各组GABAAR α2亚基膜蛋白、总蛋白及桥尾蛋白 S270磷酸化、总蛋白相对表达量
3 讨论
前期研究发现SGNs中GABAARs 的α2亚基在α亚单位族中表达量最高[8],提示新生大鼠GABAARs中α2亚基为主要成分之一。此外,研究证实含α2亚基的GABAARs与GABA递质亲和力高[9],提示α2亚基在GABAARs抑制性效能中有重要作用,其功能可能在SGNs兴奋毒性中发挥重要作用。因而,本研究通过观察α2亚基的改变了解GABAARs的变化。
胞膜表面GABAARs数量影响突触的抑制效能,特别是内化增强,可导致膜上受体数量减少,抑制性传递减弱,如:蜗背侧核、下丘、听皮层等突触前GABA分泌减少或伴随突触后甘氨酸受体、GABAARs减少参与耳鸣[10],在SS诱导的耳鸣模型中,听皮层中椎体神经元突触后微小抑制电流减弱(miniature inhibitory postsynaptic currents,mIPSCs)[11],SGNs也被证实是SS首要作用靶点[12]。前期研究也发现SS可逆地抑制SGNs GABAARs电流[13],本研究中,在 SS处理后1 h,SGNsGABAARα2亚基的mRNA和总蛋白无明显改变,但是膜蛋白降低,证实了SS作用下,SGNs 中GABAARs发生了内化。
GABAARs内化之前,需要先从突触的位置侧向扩散到突触外,其中涉及突触GABAARs与桥尾蛋白结合的减弱[14]。桥尾蛋白与GABAARsα2亚基胞内段的336~347氨基酸序列直接结合[15]。在海马神经元中过表达显性抑制桥尾蛋白,观察到突触GABAARs数量减少[16],除了数量上影响GABAARs在膜上的锚定,桥尾蛋白C结构域翻译后修饰亦能影响GABA能效能[17],其中S270位点的磷酸化对桥尾蛋白聚集GABAARs具有较强和多方面的影响,该位点分别受GSK3β和周期蛋白依赖性激酶5(cyclin-dependent kinase 5,CDK5)的调控,Tyagarajan等[2]发现,GSK3β磷酸化Ser270与GABAARs簇密度降低有关。Kuhse等研究显示CDK5依赖collybistin蛋白磷酸化Ser270[18],抑制CDK5与GABAARsγ2簇密度的降低相关[19];发生在同一个位点的磷酸化却发挥不同效应,提示该位点磷酸化具有重要功能,两种激酶协调该位点的功能保持稳定或者尚存其他未知影响因素。
桥尾蛋白是否在SS作用下对SGNs 中GABAARs内化过程起作用尚未知。本研究结果显示SS作用下SGNs中桥尾蛋白的蛋白表达较对照组稍上调,但差异无统计学意义,可能是细胞的代偿作用,外界环境作用下,蛋白的翻译后修饰相比蛋白合成对蛋白功能的影响更加迅速灵敏,同时观察到SS作用下桥尾蛋白S270磷酸化较对照组显著增强,提示S270磷酸化增强可能参与GABAARs内化。研究发现GSK3β磷酸化修饰桥尾蛋白S270位点[2~4],GSK3β与神经元的兴奋毒性有关,抑制GSK3β可以保护神经元[20],提示GSK3β可能参与了SS作用下桥尾蛋白S270磷酸化。本研究通过GSK3β抑制剂LiCl处理SGNs,之后联合SS处理,观察到联合处理组S270位点磷酸化减弱,并且GABAARs内化得到减弱,证实了桥尾蛋白S270磷酸化依赖于GSK3β。LiCl组S270磷酸化与对照组无明显变化,可能与S270位点同时接受CDK5磷酸化有关[18],但从LiCl联合SS作用之后S270磷酸化减弱以及受体内化改善的角度考虑SS主要通过GSK3β途径;下一步研究需要进一步明确GSK3β的具体作用。本研究结果提示S270磷酸化增强影响了GABAARs在膜上的动态平衡,但是S270磷酸化增强到什么程度才会使GABAARs内化还需要进一步量化。
综上所述,本研究证实SS诱导SGNs GABAARs内化,GSK3β依赖的桥尾蛋白S270磷酸化增强参与该内化过程,抑制桥尾蛋白S270磷酸化可以改善GABAARs内化,靶向桥尾蛋白磷酸化可以为耳鸣的防治提供新的方向。
