m6A修饰在鳞状细胞癌中的作用研究进展*
2022-03-28严沁宇刘桐任艺艺葛毅凌梁戈玉
严沁宇, 刘桐, 任艺艺, 葛毅凌, 梁戈玉
· 综述 ·
m6A修饰在鳞状细胞癌中的作用研究进展*
严沁宇, 刘桐, 任艺艺, 葛毅凌, 梁戈玉△
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏 南京 210009)
6-甲基腺苷修饰;转录后调控;鳞状细胞癌
近年来,RNA表观转录组学已成为生命科学领域研究的热点。作为真核细胞中最丰富的表观转录组修饰,6-甲基腺苷(6-methyladenosine, m6A)修饰是一种动态且可逆的过程[1]。研究表明,m6A可以通过调节RNA剪接、稳定性、定位、翻译和衰变,参与神经发育、免疫调节和细胞分化等各种生理行为。m6A修饰的失调会损害基因表达和细胞功能,最终导致癌症、精神疾病和代谢性疾病等疾病[2]。随着检测技术的快速发展和相关研究的逐步深入,已证实m6A修饰异常与肿瘤的发生发展密切相关,一些m6A调节因子已显示出作为肿瘤治疗生物标志物的临床价值[3]。
鳞状细胞癌是一种来源于鳞状上皮的恶性肿瘤,常见于皮肤、口腔、唇、食管、子宫颈、阴道等处。其中,头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)在世界癌症记录中排名第六[4],具有高死亡率和高复发率,严重危害人类健康。尽管近几十年来治疗方法有所改进,但鳞状细胞癌的5年总生存率仍保持较低的水平。大量前期研究提示m6A修饰相关酶在各种鳞状细胞癌的发生、发展及预后中起着至关重要的作用[5-9]。鉴于此,本文总结了目前m6A修饰在头颈部、口腔、食管等几大常见鳞状细胞癌中的相关研究进展,希望从新的角度阐释鳞状细胞癌发生发展的分子机制,并为其早期诊断与有效治疗提供潜在的生物标志。
1 m6A修饰的概述
m6A修饰是真核生物中最常见和最重要的RNA甲基化修饰之一,主要发生在mRNA、tRNA、rRNA及其他非编码RNA上。m6A修饰具有RRACH的共同序列,并且主要集中在3'非翻译区(untranslated region, UTR)终止密码子附近[10]。m6A修饰动态水平主要由三大类酶系统共同调控:甲基转移酶(methyltransferases, writers)、去甲基化酶(demethylases, erasers)和阅读蛋白(binding proteins, readers)。甲基转移酶主要包括METTL3(methyltransferase-like 3)、METTL14(methyltransferase-like 14)及WTAP(Wilms' tumor 1-associated protein),三者组成复合体催化底物发生RNA m6A修饰[11-12]。METTL16作为近期新发现的m6A甲基转移酶,是METTL3的同源物,主要作用是控制细胞-腺苷-L-蛋氨酸(-adenosyl-L-methionine, SAM)水平并将U6核小RNA甲基化[13]。去甲基化酶主要包括FTO(fat mass and obesity-associated protein)和ALKBH5(α-ketoglutarate-dependent dioxygenase alkB homolog 5)等一系列酶。去甲基化酶同氧分子、抗坏血酸、Fe(Ⅱ)和α-酮戊二酸一起从腺苷的6位点上去除甲基[14-15]。阅读蛋白主要包括YTH(YT521-B homology)家族、胰岛素生长因子2 mRNA结合蛋白(insulin-like growth factor 2 mRNA-binding proteins, IGF2BP)家族、核内不均一核糖核蛋白(heterogeneous nuclear ribonucleoproteins, HNRNP)家族和FMR1(fragile X mental retardation type 1)等[16],主要功能为识别mRNA上的m6A修饰并与其结合,调节RNA输出、翻译、降解等过程,从而调控基因的表达[17]。m6A修饰与各调控因子之间复杂的相互作用可能在多个水平调控mRNA的表达,参与生理和病理过程。
2 m6A修饰在鳞状细胞癌中的作用
目前国内外在m6A修饰与鳞状细胞癌方面的研究主要着重于对肿瘤细胞的增殖、侵袭、迁移、放化疗耐药、预后等方面的影响,其揭示的相关作用靶点和通路也将为鳞状细胞癌的早期诊断、治疗和预防提供新的思路。现分别介绍m6A修饰在头颈部、口腔、食管及其他鳞状细胞癌中的作用与潜在分子机制。
2.1HNSCCHNSCC是起源于鼻腔、口腔、喉部和咽部粘膜表面的鳞状细胞癌(不包括鼻咽癌)[18],是一类侵袭性强、基因复杂且难以治疗的的肿瘤[19],每年夺去约35万人的生命[20]。越来越多的证据表明,m6A甲基化修饰在HNSCC肿瘤生长、转移和预后中起着关键作用。
2.1.1m6A甲基转移酶与HNSCCArumugam等[21]发现在HNSCC中,KIAA1429通过频繁扩增和突变促进KIAA1429 mRNA的过度表达,与HNSCC癌症分期、肿瘤分级和淋巴结转移显著相关。Chen等[8]发现WTAP、METTL3和METTL14在HNSCC组织中的表达显著上调。WTAP的高表达与肿瘤分级、肿瘤临床分期和T分期相关,起肿瘤启动子的作用。METTL3是唯一一个与淋巴结分期相关的调节因子,并且与N分期呈负相关。METTL14的高表达导致患者的预后生存较差。
喉鳞状细胞癌(laryngeal squamous cell carcinoma, LSCC)在头颈部鳞状细胞癌中死亡率最高。Wang等[22]验证了RBM15在LSCC组织中过表达,并与不良预后相关。高表达的RBM15显著增加了TMBIM6 mRNA上的甲基化水平,并通过阅读蛋白IGF2BP3识别而增强其稳定性,从而促进LSCC细胞的增殖、侵袭、迁移和凋亡。上述研究表明,m6A甲基转移酶在调节HNSCC肿瘤进展及患者预后过程中发挥关键作用,可能作为癌症转化的预后标志物。
2.1.2m6A去甲基化酶与HNSCC在HNSCC中有7种去甲基化酶(ALKBH1、ALKBH2、ALKBH3、ALKBH4、ALKBH5、ALKBH8和FTO)的表达水平都显著升高。其中,ALKBH3和FTO的表达水平与原发性肿瘤大小(T分期)呈正相关。沉默、、和显著降低了HeLa细胞的存活率[23]。该研究提示单个或一组ALKBH蛋白的过度表达可作为诊断HNSCC和预测肿瘤进展的标志物,通过活检或手术获得的样本可以进行蛋白质印迹分析,但是具体机制有待进一步阐明。
2.1.3m6A阅读蛋白与HNSCC最近的一项研究显示,IGF2BP1、IGF2BP2和IGF2BP3在HNSCC中表达上调,且与患者的不良预后相关[24]。IGF2BP2的高表达经常与HNSCC中最常见的致癌基因的突变同时发生。IGF2BP家族通过稳定和翻译m6A修饰的致癌mRNA,包括HMGA2、TK1、HDGF、FSCN1、MKI67和CD44,促进肿瘤发生。Deng等[25]发现,IGF2BP2在HNSCC组织中表达上调,与HNSCC的T分期、HPV状态和总生存期相关,还与患者的局部晚期颈部和淋巴结转移密切相关。IGF2BP2通过m6A依赖性方式调节转录因子Slug的表达,以促进HNSCC细胞的上皮-间充质转化(epithelial-mesenchymal transition, EMT)过程和淋巴转移[26]。Geng等[27]发现,IGF2BP2的高表达与患者不良预后相关。LRRC59和STIP1可能作为IGF2BP2相关基因,在m6A修饰中起调节作用。IGF2BP2在HNSCC中发挥作用的机制可能包括Notch信号通路、ErbB信号通路、分解代谢、脂质代谢和氨基酸代谢[25]。IGF2BP2在HNSCC中的恶性标志可能包括基底细胞癌、Wnt信号通路、Hedgehog信号通路和一些与肿瘤免疫学相关的信号通路,如原发性免疫缺陷和产生IgA的肠道免疫网络[27],这可能为HNSCC的免疫治疗靶点提供新的见解,但具体的机制及所涉及的相关因子仍需进一步研究。
总之,高表达的IGF2BP家族可能通过多种机制联合促进HNSCC的发生与发展,在未来的研究中,需更深入地探索IGF2BP家族的关键蛋白及相关信号通路在HNSCC中的调控作用,从而为其诊疗提供更多的选择与理论依据。
Li等[28]发现,是一种在HNSCC组织中低表达的抑癌基因。YTHDC2低表达患者的总生存期(overall survival, OS)和无复发生存期均低于高表达患者。此外,YTHDC2表达与HNSCC中CD4+T细胞亚群浸润水平呈正相关,可能成为HNSCC预后和免疫浸润的潜在标志物。Zhou等[29]发现,YTHDC2是OS的独立危险因素,与较好的预后有关,YTHDC2高表达的患者长期生存率较高。GSEA分析表明,YTHDC2的高表达与细胞凋亡、泛素介导的蛋白水解、长时程增强和RIG-I-like受体信号通路等关键通路相关,揭示了HNSCC发病的潜在机制。由此可见,作为一种重要的抑癌基因,将来可能成为诊断HNSCC的一个关键靶点,为HNSCC的治疗与干预提供新的视野。
Ye等[30]发现,YTHDF1诱导下咽部鳞状细胞癌(hypopharynx squamous cell carcinoma, HPSCC)的发生取决于体内铁的代谢。YTHDF1通过m6A依赖性机制正向调节转铁蛋白受体(transferrin receptor, TFRC)mRNA的翻译,增强了HPSCC中TFRC的表达,导致FaDu细胞内铁含量、Fe2+和活性氧(reactive oxygen species, ROS)水平的升高。过量的铁导致氧化还原失衡并在肿瘤细胞中产生ROS,进而增加基因组的不稳定性和增殖。体内外实验表明,下调YTHDF1可以明显抑制肿瘤生长、集落形成和迁移。从治疗的角度来看,针对YTHDF1和TFRC介导的铁代谢可能是HPSCC的一个有希望的策略。
综合上文我们发现,m6A修饰在HNSCC中发挥着不可忽视的作用。参与HNSCC的m6A调控蛋白中,METTL14、IGF2BP3和YTHDF1都呈现高表达,与患者的不良预后相关;而YTHDC2是唯一一个低表达的修饰因子,与患者较好的预后相关。这些调控蛋白有望成为预测HNSCC预后的生物标志物。m6A修饰在HNSCC中作用及机制的总结见表1及图1。

表1 m6A修饰在头颈部鳞状细胞癌中的调控作用
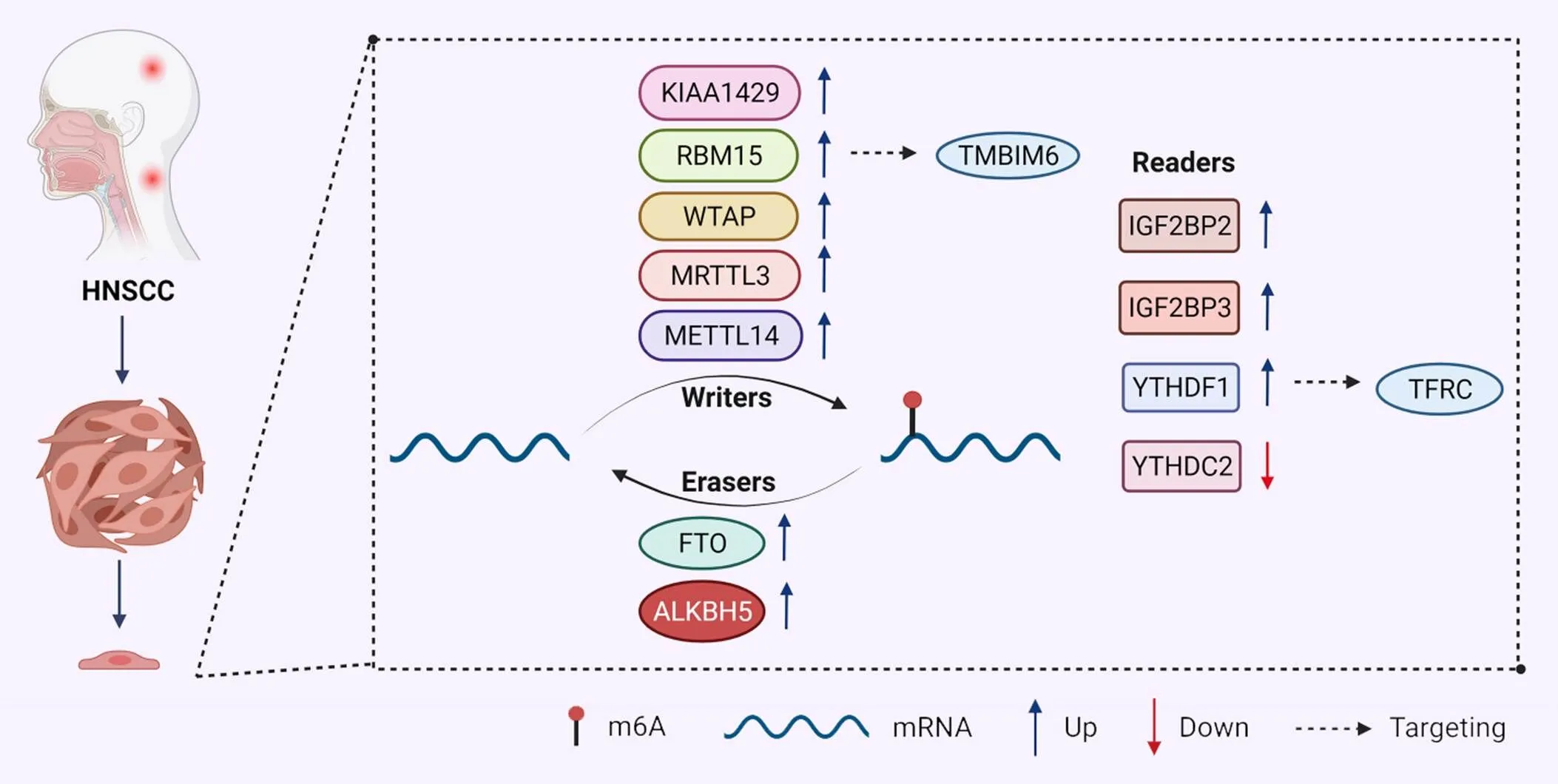
Figure 1.Role of m6A regulators in head and neck squamous cell carcinoma (HNSCC).
2.2口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)OSCC是口腔和颌面部最常见的肿瘤[31],治愈率低、淋巴转移风险和复发率都较高[32],严重影响患者的生命健康。m6A修饰调控蛋白的表达异常能导致OSCC的增殖、转移和耐药等。
2.2.1m6A甲基转移酶与OSCCLiu等[33]发现,METTL3在OSCC中高表达,与患者的预后不良有关。METTL3的表达水平与肿瘤分期、临床分期和淋巴结转移均呈显著正相关。METTL3能够识别BMI1 3'UTR上的m6A位点,并与IGF2BP1合作促进BMI1的翻译,促进OSCC的增殖和转移。Zhao等[34]发现,METTL3针对c-Myc转录本的3'UTR安装m6A修饰,并通过YTHDF1介导的m6A修饰增强了c-Myc的稳定性,从而引起了OSCC肿瘤的发生。Ai等[35]发现,METTL3通过调节PRMT5和PD-L1来增强OSCC的转移和增殖。这些研究提示METTL3可能通过调控多个下游靶基因促进OSCC的增殖和转移,与肿瘤的转归及预后密切相关。
2.2.2m6A去甲基化酶与OSCCLi等[36]的研究表明,高表达FTO的OSCC患者显示出更大的肿瘤大小、更高的TNM分期、更差的分化和更短的生存时间。敲减显著抑制了OSCC细胞活力、集落形成和肿瘤生长。此外,FTO在调节YAP1 mRNA稳定性中发挥重要作用,FTO的耗竭加速了YAP1 mRNA的降解,提示靶向FTO/YAP1轴可能是干预OSCC患者的一种新的策略。Wang等[37]发现,FTO通过靶向上调OSCC细胞系HSC3和CAL33的关键调控基因真核翻译起始因子γ1,在调节自噬和肿瘤发生中起关键作用。这表明FTO抑制剂可能成为治疗OSCC的潜在候选药物,将给OSCC的治疗带来新的希望。
此外,m6A去甲基化酶在OSCC的耐药发展中也起着重要的调节作用。OSCC最常用的化疗方案是顺铂,或单独使用,或与5-氟尿嘧啶和多西他赛联合使用。研究报道,RNA解旋酶DDX3(DEAD-box helicase 3 X-linked)通过ALKBH5直接调控m6A,降低肿瘤干细胞转录因子FOXM1(forkhead box protein M1)和NANOG的转录,导致化疗耐药[38-39]。这提示m6A去甲基化酶在参与OSCC发病机制的调控中是极其复杂的,今后针对其引起的耐药性仍需进一步研究,具体的分子机制仍需探索。
2.2.3m6A阅读蛋白与OSCCZhu等[40]发现,在OSCC组织中,HNRNPA2B1是众多m6A调节因子中最重要的预后位点,HNRNPA2B1的高表达与患者较差的总生存率显著相关,与肿瘤分期、T分期和淋巴结转移有关,但与分级无显著相关。机制上,HNRNPA2B1通过LINE-1/TGF-β1/Smad2/Slug信号通路靶向EMT,促进OSCC的癌变。
Huang等[41]发现,HNRNPC是OSCC中独立的预后生物标志物,HNRNPC的表达水平与晚期临床分期和淋巴结转移呈正相关,高表达的HNRNPC通过增强SCC9和CAL27细胞中N-钙黏蛋白、基质金属蛋白酶9和波形蛋白表达及抑制E-钙黏蛋白表达来触发EMT,从而促进OSCC的增殖、迁移和侵袭。
以上两项研究说明,m6A阅读蛋白主要通过促进EMT过程发挥致癌作用,这为研究OSCC的靶向治疗提供了新的路径。m6A修饰在OSCC中作用及机制的总结见表2及图2。

表2 m6A修饰在头颈部鳞状细胞癌中的调控作用
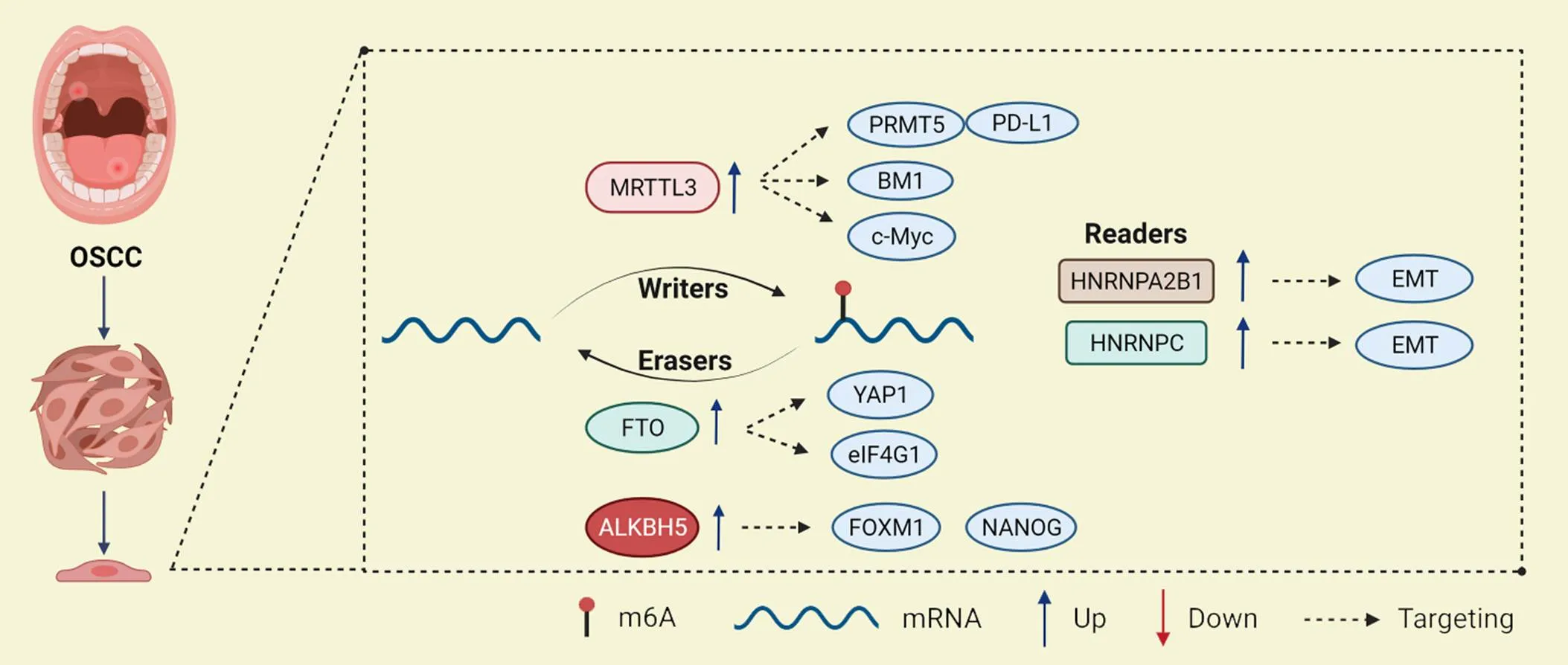
Figure 2.Role of m6A regulators in oral squamous cell carcinoma (OSCC).
2.3食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)ESCC是食管癌中最常见的病理类型,是一种高度侵袭性和耐药性的肿瘤,恶性程度高、复发率高、预后差[42]。大量研究显示,m6A修饰可通过多种机制参与到ESCC的肿瘤进展过程中。
2.3.1m6A甲基转移酶与ESCCHan等[43]观察到,METTL3在ESCC组织中表达上调,并与患者预后不良相关。METTL3的表达水平也与晚期肿瘤分级、癌症分期及高淋巴结转移活性有关。METTL3通过促进NOTCH1的表达和Notch信号通路的激活,提高ESCC细胞的生长、迁移和侵袭能力。Zou等[44]发现,METTL3可能通过p21依赖性模式调节ESCC细胞周期,通过p21轴诱导ESCC发生、发展。敲除可显著抑制体外ESCC的生长、侵袭和迁移,并诱导细胞凋亡,同时降低PI3K和AKT的磷酸化水平[45]。Chen等[46]证实,谷氨酰胺酶2(glutaminase 2, GLS2)是由METTL3通过m6A修饰调控的下游靶点,敲除导致GLS2在mRNA和蛋白水平上的表达显著下调,从而抑制ESCC细胞的迁移和侵袭。这些研究提示,高表达的METTL3可能通过多种调控机制协同促进ESCC细胞的恶性进展,METTL3作为ESCC患者预后恶化的预测因子及抑癌药物研发的靶点有很大的临床价值。
Liu等[47]在ESCC中发现了一个关键的调节性METTL14-miR-99a-5p-TRIB2正反馈回路,通过Akt/mTOR/S6K1/HDAC2抑制p21,从而促进ESCC中肿瘤干细胞的持久性和放射抗性。然而,目前关于METTL14调控ESCC发生发展进程的机制研究报道较少,具体调控机制有待进一步探索。
2.3.2m6A去甲基化酶与ESCCLiu等[48]发现,FTO在ESCC组织中高表达,与不良预后相关;FTO通过上调基质金属蛋白酶13促进ESCC的增殖和迁移。Cui等[49]的研究表明,上调的FTO可降低ESCC细胞中LINC00022的m6A水平,并使其与p21蛋白结合,通过泛素-蛋白酶体途径促进p21蛋白的衰变与降解,促进细胞增殖和肿瘤生长。
与之相反,Xiao等[42]发现,ALKBH5在ESCC中的表达下调,并且与肿瘤大小、淋巴结浸润程度、临床分期和组织学分级呈负相关。ALKBH5负调控ESCC细胞的增殖、致瘤性、迁移和侵袭,在ESCC中起抑癌作用。Xue等[50]报道,在ESCC细胞中,miR-193a-3p和ALKBH5之间存在正反馈调节,ALKBH5能够通过m6A修饰影响miR-193-3p的表达,从而抑制ESCC细胞系KYSE-150和ECA109的增殖、迁移和侵袭。这表明,虽然FTO和ALKBH5的作用均使得RNA发生去甲基化,但它们在ESCC中的表达水平不同,产生的作用效果也截然相反。我们推测其中的差异可能与FTO和ALKBH5具有不同的细胞内定位和组织分布有关,也可能是RNA被不同的m6A阅读蛋白选择性识别所致,具体的原因仍需更深层次探讨。
2.3.3m6A阅读蛋白与ESCCGuo等[51]发现,在ESCC中HNRNPA2B1显著高表达,HNRNPA2B1作为一种致癌因子,通过上调脂肪酸合成酶ACLY和ACC1加速脂肪酸合成,促进ESCC进展。实验表明,敲减可显著抑制ESCC细胞的增殖、迁移和侵袭。另有研究显示,YTHDF2主要通过与lncRNA LINC00022转录物结合并促进其在ESCC细胞中的衰变,发挥肿瘤抑制作用[49]。
综合上述结果可以推测,m6A修饰及其相关调控因子可能参与了不同信号通路介导的ESCC病理过程。这些发现为进一步了解ESCC的发病机制提供了新的依据,有望为其药物治疗提供新的靶点,提高疗效,预测和改善预后。m6A修饰在ESCC中作用及机制的总结见表3及图3。

表3 m6A修饰在食管鳞状细胞癌中的调控作用
Figure 3.Role of m6A regulators in esophageal squamous cell carcinoma (ESCC).
图3m6A调控因子在食管鳞状细胞癌中的作用
2.4其他鳞状细胞癌在肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)的发生发展中,也有一些m6A调节因子参与其中。有学者认为,FTO可能是LUSC的一个预后因素[52]。Liu等[53]发现,LUSC细胞系中FTO的表达显著升高,FTO通过降低MZF1 mRNA转录本中的m6A水平和mRNA稳定性来增强MZF1的表达,促进LUSC的发生。敲除可有效抑制LUSC细胞系L78和NCI-H520的增殖和侵袭,促进细胞凋亡。Sun等[54]的研究显示,YTHDC2在LUSC细胞中明显低表达,与分化不良、淋巴结转移、肿瘤大小和分期显著相关。Xu等[55]的研究表明,缺氧介导的YTHDF2过表达通过激活mTOR/AKT信号通路,并且诱导LUSC中的EMT过程,促进细胞增殖和侵袭,最终导致LUSC患者的预后较差。这些发现提高了目前对m6A修饰在LUSC发展过程中生物学作用的潜在机制的理解,并可能为LUSC的治疗提供潜在靶点。
在皮肤鳞状细胞癌(cutaneous squamous cell carcinoma, cSCC)组织中,METTL3表达上调,通过调节cSCC中ΔNp63的表达促进cSCC的细胞增殖、分化和肿瘤生长;敲除可减弱cSCC细胞的干性,包括体外集落形成能力和体内致瘤性[56]。
在宫颈鳞状细胞癌(cervical squamous cell carcinoma, CSCC)组织中,FTO的表达升高,并通过降低mRNA转录物中的m6A水平上调β-catenin的表达,进而增加ERCC1(excision repair cross complementing group 1)的活性,从而在体外和体内增强化疗-放疗的抗性[57]。Pan等[58]探索m6A调节因子在CSCC中的预后特征,发现HNRNPC、KIAA1429、WTAP和ZC3H13的高表达水平与较差的生存率相关,而YTHDC1和YTHDF1的高表达水平与较长的OS相关,该预后特征可能作为预测患者生存结果的有效工具。
m6A修饰在LUSC、cSCC和CSCC中作用及机制的总结见表4。

表4 m6A修饰在肺、皮肤和宫颈鳞状细胞癌中的调控作用
综上所述,m6A及其相关酶的变化与HNSCC、OSCC、ESCC、LUSC等多种鳞状细胞癌的发生发展关系密切;m6A修饰可通过影响mRNA稳定性、调控下游靶基因的表达、激活EMT、调节肿瘤细胞干性等多种机制在鳞状细胞癌的发生、发展及治疗中发挥重要作用。这些结果进一步丰富了m6A修饰与鳞状细胞癌的作用靶点和途径,也为后续从转录后水平研究鳞状细胞癌的病理、病理生理反应及临床诊治提供了更广阔的思路。
3 总结与展望
m6A修饰被认为是真核生物mRNA中最常见的修饰类型,主要通过甲基转移酶(writers)和去甲基化酶(erasers)的共同作用实现动态可逆调节,并且被阅读蛋白(readers)特异性识别并结合,发挥基因调控作用。从上述研究我们发现,在鳞状细胞癌中出现了多样化的m6A修饰,因其调控的靶基因不同,所涉及的肿瘤进程也不同,主要包括肿瘤细胞增殖、侵袭、迁移、肿瘤分级、临床分期、TNM分期、OS、预后等。
在众多参与鳞状细胞癌的m6A修饰调控因子中,METTL3和FTO的研究最为广泛,其机制研究也相对深入。METTL3和FTO在头颈部、口腔、食管及肺鳞状细胞癌中表达均显著上调,发挥致癌作用,提示其作为早期诊疗及预后判断有效生物标志的可能性。AKLBH5在HNSCC中高表达,促进肿瘤生长;在OSCC中可降低肿瘤干细胞转录因子的转录导致化疗耐药;而在ESCC中却呈现低表达,起到抑癌作用。同一个调节因子在不同类型的鳞状细胞癌中发挥截然不同的作用,推测可能是由于其调控的下游靶基因不同所致,也可能归因于来自不同部位的肿瘤的异质性。但其中具体的分子机制、细胞效应和信号通路尚不清楚,仍需进一步深入研究。值得注意的是,YTHDC2在HNSCC和LUSC中都呈现表达下调,过表达YTHDC2使肿瘤的增殖和迁移能力受到显著抑制,提示其将来有可能成为研究鳞状细胞癌的一个关键的抑癌因子和新的治疗靶点。
目前,已有相关研究探索m6A去甲基化酶的抑制剂在肿瘤治疗中的潜在作用。例如,R-2-羟基戊二酸(R-2-hydroxyglutarate, R-2HG)可通过抑制FTO活性,降低MYC/CEBPA转录物的稳定性,从而抑制白血病细胞增殖,发挥广泛的抗白血病活性[59]。R-2HG还可以通过调节FTO/m6A而甲基化ERα/miR16-5p/YAP1信号通路,从而抑制胆管癌生长[60]。
尽管目前有研究认为m6A相关调节因子及信号通路可以作为鳞状细胞癌的治疗靶点,但现有关于m6A修饰参与调节鳞状细胞癌的研究仍比较有限,大多止步于其在肿瘤中的表达水平及功能,而对调控肿瘤的分子机制的研究却不够深入。因此,迫切需要进一步开展m6A修饰在鳞状细胞癌相关领域的研究,以期发掘具有特异性和敏感性的生物标志物,为实现鳞状细胞癌的早期诊断和精准治疗提供科学依据。
[1] Zhou Z, Lv J, Yu H, et al. Mechanism of RNA modification6-methyladenosine in human cancer[J]. Mol Cancer, 2020, 19(1):104.
[2] Yang C, Hu Y, Zhou B, et al. The role of m6A modification in physiology and disease[J]. Cell Death Dis, 2020, 11(11):960.
[3] Zhou Y, Yang J, Tian Z, et al. Research progress concerning m6A methylation and cancer[J]. Oncol Lett, 2021, 22(5):775.
[4] Subha ST, Chin JW, Cheah YK, et al. Multiple microRNA signature panel as promising potential for diagnosis and prognosis of head and neck cancer[J]. Mol Biol Rep, 2022, 49(2):1501-1511.
[5] Zhang X, Lu N, Wang L, et al. Recent advances of m6A methylation modification in esophageal squamous cell carcinoma[J]. Cancer Cell Int, 2021, 21(1):421.
[6] Li DQ, Huang CC, Zhang G, et al. FTO demethylates YAP mRNA promoting oral squamous cell carcinoma tumorigenesis[J]. Neoplasma, 2021.
[7] Zhang K, Han Z, Zhao H, et al. An integrated model of FTO and METTL3 expression that predicts prognosis in lung squamous cell carcinoma patients[J]. Ann Transl Med, 2021,9(20):1523.
[8] Chen Y, Jiang X, Li X, et al. The methylation modification of m6A regulators contributes to the prognosis of head and neck squamous cell carcinoma[J]. Ann Transl Med, 2021, 9(16):1346.
[9] Zhang Y, Li L, Ye Z, et al. Identification of m6A methyltransferase-related genes predicts prognosis and immune infiltrates in head and neck squamous cell carcinoma[J]. Ann Transl Med, 2021, 9(20):1554.
[10] Sun T, Wu R, Ming L. The role of m6A RNA methylation in cancer[J]. Biomed Pharmacother, 2019, 112:108613.
[11] Ping XL, Sun BF, Wang L, et al. Mammalian WTAP is a regulatory subunit of the RNA6-methyladenosine methyltransferase[J]. Cell Res, 2014, 24(2):177-189.
[12] Liu L, Wang Y, Wu J, et al.6-Methyladenosine: a potential breakthrough for human cancer[J]. Mol Ther Nucleic Acids, 2020, 19:804-813.
[13] Shima H, Matsumoto M, Ishigami Y, et al.-Adenosylmethionine synthesis is regulated by selective6-adenosine methylation and mrna degradation involving METTL16 and YTHDC1[J]. Cell Rep, 2017, 21(12):3354-3363.
[14] Maity A, Das B.6-methyladenosine modification in mRNA: machinery, function and implications for health and diseases[J]. FEBS J, 2016, 283(9):1607-1630.
[15] Hu Y, Wang S, Liu J, et al. New sights in cancer: Component and function of6-methyladenosine modification[J]. Biomed Pharmacother, 2020, 122:109694.
[16] Zhou Z, Lv J, Yu H, et al. Mechanism of RNA modification6-methyladenosine in human cancer[J]. Mol Cancer, 2020, 19(1):104.
[17] Wang T, Kong S, Tao M, et al. The potential role of RNA6-methyladenosine in cancer progression[J]. Mol Cancer, 2020, 19(1):88.
[18] Chow L. Head and neck cancer. Reply[J]. N Engl J Med, 2020, 382(20):e57.
[19] Alsahafi E, Begg K, Amelio I, et al. Clinical update on head and neck cancer: molecular biology and ongoing challenges[J]. Cell Death Dis, 2019, 10(8):540.
[20] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424.
[21] Arumugam P, George R, Jayaseelan VP. Aberrations of m6A regulators are associated with tumorigenesis and metastasis in head and neck squamous cell carcinoma[J]. Arch Oral Biol, 2021, 122:105030.
[22] Wang X, Tian L, Li Y, et al. RBM15 facilitates laryngeal squamous cell carcinoma progression by regulating TMBIM6 stability through IGF2BP3 dependent[J]. J Exp Clin Cancer Res, 2021, 40(1):80.
[23] Pilžys T, Marcinkowski M, Kukwa W, et al. ALKBH overexpression in head and neck cancer: potential target for novel anticancer therapy[J]. Sci Rep, 2019, 9(1):13249.
[24] Paramasivam A, George R, Priyadharsini JV. Genomic and transcriptomic alterations in m6A regulatory genes are associated with tumorigenesis and poor prognosis in head and neck squamous cell carcinoma[J]. Am J Cancer Res, 2021, 11(7):3688-3697.
[25] Deng X, Jiang Q, Liu Z, et al. Clinical significance of an m6A reader gene, IGF2BP2, in head and neck squamous cell carcinoma[J]. Front Mol Biosci, 2020, 7:68.
[26] Yu D, Pan M, Li Y, et al. RNA6-methyladenosine reader IGF2BP2 promotes lymphatic metastasis and epithelial-mesenchymal transition of head and neck squamous carcinoma cells via stabilizing slug mRNA in an m6A-dependent manner[J]. J Exp Clin Cancer Res, 2022, 41(1):6.
[27] Geng X, Zhang Y, Zeng Z, et al. Molecular characteristics, prognostic value, and immune characteristics of m6A regulators identified in head and neck squamous cell carcinoma[J]. Front Oncol, 2021, 11:629718.
[28] Li Y, Zheng J N, Wang E H, et al. The m6A reader protein YTHDC2 is a potential biomarker and associated with immune infiltration in head and neck squamous cell carcinoma[J]. PeerJ, 2020, 8:e10385.
[29] Zhou X, Han J, Zhen X, et al. Analysis of genetic alteration signatures and prognostic values of m6A regulatory genes in head and neck squamous cell carcinoma[J]. Front Oncol, 2020, 10:718.
[30] Ye J, Wang Z, Chen X, et al. YTHDF1-enhanced iron metabolism depends on TFRC m6A methylation[J]. Theranostics, 2020, 10(26):12072-12089.
[31] Zhou X, Xue D, Qiu J. Identification of biomarkers related to glycolysis with weighted gene co-expression network analysis in oral squamous cell carcinoma[J]. Head Neck, 2022, 44(1):89-103.
[32] Cheng Y, Li S, Gao L, et al. The molecular basis and therapeutic aspects of cisplatin resistance in oral squamous cell carcinoma[J]. Front Oncol, 2021, 11:761379.
[33] Liu L, Wu Y, Li Q, et al. METTL3 promotes tumorigenesis and metastasis through BMI1 m6A methylation in oral squamous cell carcinoma[J]. Mol Ther, 2020, 28(10):2177-2190.
[34] Zhao W, Cui Y, Liu L, et al. METTL3 facilitates oral squamous cell carcinoma tumorigenesis by enhancing c-Myc stability via YTHDF1-mediated m6A modification[J]. Mol Ther Nucleic Acids, 2020, 20:1-12.
[35] Ai Y, Liu S, Luo H, et al. METTL3 intensifies the progress of oral squamous cell carcinoma via modulating the m6A amount of PRMT5 and PD-L1[J]. J Immunol Res, 2021, 2021:6149558.
[36] Li DQ, Huang CC, Zhang G, et al. FTO demethylates YAP mRNA promoting oral squamous cell carcinoma tumorigenesis[J]. Neoplasma, 2022, 69(1):71-79.
[37] Wang F, Liao Y, Zhang M, et al.6-methyladenosine demethyltransferase FTO-mediated autophagy in malignant development of oral squamous cell carcinoma[J]. Oncogene, 2021, 40(22):3885-3898.
[38] Jing FY, Zhou LM, Ning YJ, et al. The biological function, mechanism, and clinical significance of m6A RNA modifications in head and neck carcinoma: a systematic review[J]. Front Cell Dev Biol, 2021, 9:683254.
[39] Shriwas O, Priyadarshini M, Samal SK, et al. DDX3 modulates cisplatin resistance in OSCC through ALKBH5-mediated m6A-demethylation of FOXM1 and NANOG[J]. Apoptosis, 2020, 25(3/4):233-246.
[40] Zhu F, Yang T, Yao M, et al. HNRNPA2B1, as a m6A reader, promotes tumorigenesis and metastasis of oral squamous cell carcinoma[J]. Front Oncol, 2021, 11:716921.
[41] Huang GZ, Wu QQ, Zheng ZN, et al. M6A-related bioinformatics analysis reveals that HNRNPC facilitates progression of OSCC via EMT[J]. Aging (Albany NY), 2020, 12(12):11667-11684.
[42] Xiao D, Fang TX, Lei Y, et al. m6A demethylase ALKBH5 suppression contributes to esophageal squamous cell carcinoma progression[J]. Aging (Albany NY), 2021, 13(17):21497-21512.
[43] Han H, Yang C, Zhang S, et al. METTL3-mediated m6A mRNA modification promotes esophageal cancer initiation and progression via Notch signaling pathway[J]. Mol Ther Nucleic Acids, 2021, 26:333-346.
[44] Zou J, Zhong X, Zhou X, et al. The m6A methyltransferase METTL3 regulates proliferation in esophageal squamous cell carcinoma[J]. Biochem Biophys Res Commun, 2021, 580:48-55.
[45] Hu W, Liu W, Liang H, et al. Silencing of methyltransferase-like 3 inhibits oesophageal squamous cell carcinoma[J]. Exp Ther Med, 2020, 20(6):138.
[46] Chen X, Huang L, Yang T, et al. METTL3 promotes esophageal squamous cell carcinoma metastasis through enhancing GLS2 expression[J]. Front Oncol, 2021, 11:667451.
[47] Liu Z, Wu K, Gu S, et al. A methyltransferase-like 14/miR-99a-5p/tribble 2 positive feedback circuit promotes cancer stem cell persistence and radioresistance via histone deacetylase 2-mediated epigenetic modulation in esophageal squamous cell carcinoma[J]. Clin Transl Med, 2021, 11(9):e545.
[48] Liu S, Huang M, Chen Z, et al. FTO promotes cell proliferation and migration in esophageal squamous cell carcinoma through up-regulation of MMP13[J]. Exp Cell Res, 2020, 389(1):111894.
[49] Cui Y, Zhang C, Ma S, et al. RNA m6A demethylase FTO-mediated epigenetic up-regulation of LINC00022 promotes tumorigenesis in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2021, 40(1):294.
[50] Xue J, Xiao P, Yu X, et al. A positive feedback loop between AlkB homolog 5 and miR-193a-3p promotes growth and metastasis in esophageal squamous cell carcinoma[J]. Hum Cell, 2021, 34(2):502-514.
[51] Guo H, Wang B, Xu K, et al. m6A reader HNRNPA2B1 promotes esophageal cancer progression via up-regulation of ACLY and ACC1[J]. Front Oncol, 2020, 10:553045.
[52] 张哲明, 吴艳, 卞涛. RNA m6A修饰在肺部疾病中的研究进展[J]. 中国病理生理杂志, 2021, 37(9):1719-1723.
Zhang ZM, Wu Y, Bian T. Progress in role of RNA m6A modification in lung diseases[J]. Chin J Pathophysiol, 2021, 37(9):1719-1723.
[53] Liu J, Ren D, Du Z, et al. m6A demethylase FTO facilitates tumor progression in lung squamous cell carcinoma by regulating MZF1 expression[J]. Biochem Biophys Res Commun, 2018, 502(4):456-464.
[54] Sun S, Han Q, Liang M, et al. Downregulation of m6A reader YTHDC2 promotes tumor progression and predicts poor prognosis in non-small cell lung cancer[J]. Thorac Cancer, 2020, 11(11):3269-3279.
[55] Xu P, Hu K, Zhang P, et al. Hypoxia-mediated YTHDF2 overexpression promotes lung squamous cell carcinoma progression by activation of the mTOR/AKT axis[J]. Cancer Cell Int, 2022, 22(1):13.
[56] Zhou R, Gao Y, Lv D, et al. METTL3 mediated m6A modification plays an oncogenic role in cutaneous squamous cell carcinoma by regulating ΔNp63[J]. Biochem Biophys Res Commun, 2019, 515(2):310-317.
[57] Zhou S, Bai ZL, Xia D, et al. FTO regulates the chemo-radiotherapy resistance of cervical squamous cell carcinoma (CSCC) by targeting β-catenin through mRNA demethylation[J]. Mol Carcinog, 2018, 57(5):590-597.
[58] Pan J, Xu L, Pan H. Development and validation of an m6A RNA methylation regulator-based signature for prognostic prediction in cervical squamous cell carcinoma[J]. Front Oncol, 2020, 10:1444.
[59] Su R, Dong L, Li C, et al. R-2HG exhibits anti-tumor activity by targeting FTO/m6A/MYC/CEBPA signaling[J]. Cell, 2018, 172(1/2):90-105.
[60] Gao Y, Ouyang X, Zuo L, et al. R-2HG downregulates ERα to inhibit cholangiocarcinoma via the FTO/m6A-methylated ERα/miR16-5p/YAP1 signal pathway[J]. Mol Ther Oncolytics, 2021, 23:65-81.
Progress in role of m6A modification in squamous cell carcinoma
YAN Qin-yu, LIU Tong, REN Yi-yi, GE Yi-ling, LIANG Ge-yu△
(,,,,210009,)
As one of the most widespread RNA modifications in eukaryotes,6-methyladenosine (m6A) modification regulates target gene expression by affecting RNA splicing, stability, localization, translation and decay, which plays an important role in post-transcriptional regulation. Dysregulation of m6A modification is involved in the development of squamous cell cancers of the head and neck, oral cavity, and esophagus, affecting tumor proliferation, invasion, migration and correlating with their prognosis and drug resistance. This study summarizes the biological functions and molecular mechanisms of m6A modification in the development of squamous cell carcinoma from a new perspective of RNA methylation regulation, aiming to provide scientific basis for early diagnosis, prognosis and targeted therapy of squamous cell carcinoma.
6-methyladenosine modification; Post-transcriptional regulation; Squamous cell carcinoma
R730.2; Q354
A
10.3969/j.issn.1000-4718.2022.03.020
1000-4718(2022)03-0543-10
2022-01-12
2022-02-22
[基金项目]国家自然科学基金(科研纵向)资助项目(No. 81972998)。
Tel: 13851720165; E-mail: lianggeyu@163.com
(责任编辑:卢萍,罗森)
