机械力敏感离子通道Piezo1参与高血压诱导心房纤维化的机制研究*
2022-03-28刘慧意饶芳叶兴东金书羽付路邓春玉杨慧邝素娟吴书林薛玉梅
刘慧意, 饶芳, 叶兴东, 金书羽,2, 付路, 邓春玉,杨慧, 邝素娟, 吴书林, 薛玉梅△
机械力敏感离子通道Piezo1参与高血压诱导心房纤维化的机制研究*
刘慧意1, 饶芳1, 叶兴东1, 金书羽1,2, 付路1, 邓春玉1,杨慧1, 邝素娟1, 吴书林1, 薛玉梅1△
(1广东省心血管病研究所心内科,广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080;2南方医科大学医学院,广东 广州 510515)
利用小鼠心房成纤维细胞探讨机械敏感离子通道Piezo1在调控高血压所致心房纤维化,进而导致房颤中的作用及可能机制。采用酶消化法分离培养6~8周龄雄性C57BL/6小鼠的原代心房成纤维细胞,并采用课题组自制的加压装置(专利号201420109263.1)建立高血压模型,Western blot比较不同静水压(0、20和40 mmHg)干预下细胞Piezo1、Src/p-Src及纤维化指标I/III型胶原蛋白α1链(Col1A1/3A1)和基质金属蛋白酶2/9(MMP-2/9)蛋白表达水平。高静水压(40 mmHg)干预下的心房成纤维细胞,分别给予不同浓度(1、3和 10 µmol/L)的Piezo1抑制剂GsMTx4,或转染siRNA质粒降低Piezo1的表达,以及不同浓度(5和10 µmol/L)的Src抑制剂PP1,观察细胞中Src/p-Src和纤维化相关因子蛋白水平的变化。常压下给予不同浓度(1、3和10 µmol/L)的Piezo1特异性激动剂Yoda1,观察心房成纤维细胞中Src/p-Src和纤维化相关因子蛋白水平的变化。随着压力升高,小鼠心房成纤维细胞中Piezo1、Src/p-Src及纤维化指标Col1A1/3A1和MMP-2/9蛋白表达水平显著升高(<0.05);GsMTx4/siRNA或PP1处理后,可使高静水压导致的Src/p-Src及纤维化相关因子水平下降(<0.05)。而细胞给予Piezo1特异性激动剂Yoda1可模拟出高静水压干预的结果(<0.05)。在小鼠心房成纤维细胞中,机械敏感通道蛋白Piezo1可能通过调控Src/p-Src参与高血压所致的心房纤维化。
Piezo1蛋白;高血压;心房成纤维细胞;心房颤动
心房颤动(房颤)是临床中常见的心律失常之一,我国总体发病率高达1.14%[1]。房颤危害严重,可引起脑卒中、充血性心力衰竭,甚至危及生命。高血压是心房颤动最常见的危险因素。高血压合并房颤时可显著增加不良事件风险,包括脑卒中、心血管事件、全因死亡风险等[2]。然而,高血压促进房颤形成机制仍不明确。
长期高血压状态使左心室后负荷增加,左心房长期被动牵拉导致其内径增大、顺应性增加及收缩力下降,且这种生物力学牵拉能直接诱导心房纤维化的产生以及引起离子通道电流改变,成为房颤发生的基础[3]。但目前关于高血压导致心房纤维化,进而导致房颤的具体分子机制仍不明确。
新型离子通道Piezo1是近年来鉴定出的哺乳动物的机械门控离子通道,主要在暴露于流体压力的非感觉组织中表达,广泛参与血管发育、动脉重塑和血压调节、上皮细胞稳态和红细胞体积调节等病理生理过程[4-5]。研究表明,Piezo1在小动脉平滑肌细胞中表达并可被拉伸力激活,通过上调细胞中Ca2+浓度,升高交联酶活性,调节高血压时小动脉的直径和壁厚,影响小动脉血管结构重塑[6]。此外,Piezo1在心肌梗死心衰大鼠心脏中表达增加,并可被血管紧张素受体阻滞剂氯沙坦所抑制;体外予以血管紧张素II刺激新生大鼠心室肌细胞可通过AT1受体依赖性途径上调Piezo1表达[7]。但高血压导致心房压力增加时,Piezo1是否参与心房纤维化尚未见报道。
此外,编码膜相关的酪氨酸激酶,参与细胞生长和分化。近年来的研究表明,在博来霉素诱导的肺纤维化大鼠模型和氯化钴处理的L929细胞(小鼠成纤维细胞)中,新型肽类Src抑制剂KX-01显著抑制p-Src,降低α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和胶原的表达[8]。我们的前期研究提示Src参与了高静水压下心房肌细胞的Ca,L以及L型钙通道α1c亚单位(L-type calcium channel α1C,Cav1.2)的表达,促进房颤发生[9]。然而,在高血压患者中,心房组织中的Src是否通过调节心房纤维化参与房颤的发病,心房组织中的Piezo1是否通过Src调节心房结构重构尚不清楚。因此,本研究中,我们拟证实小鼠心房成纤维细胞膜上的新型离子通道Piezo1,在机械应力的作用下激活,激活Src激酶,促进心房纤维化,参与房颤的发生和维持。
材料和方法
1 动物
6~8周龄SPF级雄性C57BL/6J小鼠由广东省广州中医药大学实验动物中心提供,20~25 g,共30只,许可证号为SCXK(粤)2013-0034。SPF级Wistar大鼠和自发性高血压大鼠(spontaneously hypertensive rat, SHR)各3只,30~35周龄,购自北京维通利华,生产许可证号为SCXKD(京)2016-0006。所有的动物实验已通过广东省人民医院(广东省医学科学院)动物实验伦理审查(No. 201904010451)。
2 主要试剂
Opti-MEM培养液、特级澳洲胎牛血清和0.25%胰蛋白酶-EDTA(Gibco);成纤维细胞基础培养液(Lonza);蛋白Marker(Fermentas);4×蛋白上样缓冲液(Bio-Rad);RIPA裂解液(强)和BCA试剂盒(Beyotime);抗Piezo1抗体(Alomone);抗I型胶原蛋白α1链(collagen type I α1 chain, Col1A1)抗体、抗III型胶原蛋白α1链(collagen type III α1 chain, Col3A1)抗体和抗基质金属蛋白酶2/9(matrix metalloproteinase-2/9, MMP-2/9)抗体(Abcam);抗GAPDH抗体、抗Src抗体和抗p-Src抗体(Cell Signaling Technology);GsMTx4和Yoda1(MedChemExpress);PP1(Selleck);siRNA和阴性对照(RiboBio);Lipofactamine 3000脂质体(Thermo Fisher Scientific)。
3 主要方法
3.1原代心房成纤维细胞分离培养及质粒转染6~8周龄的雄性C57BL/6J小鼠,颈椎脱臼处死,75%乙醇消毒小鼠,高压灭菌后的眼科剪剪开胸腔,取出心脏,剪下左右心耳及心房组织,洗清残血,剪碎组织至1 mm×1 mm×1 mm大小。无菌巴氏管吸取5 mL 0.25%胰酶至离心管中,轻轻吹打消化约3 min,静置1 min,将上清转移至含胎牛血清的终止液中,终止消化,如此反复至组织块基本消失。将消化所得的混悬液经100目过滤网过滤后,410×离心15 min,弃上清,用5 mL 10%培养液重悬后接种到25 cm2的培养瓶中,置于37 ℃、5% CO2培养4 h后换液。第2~4代细胞用于实验。细胞接种于6孔细胞培养板中,待细胞密度达70%~80%时进行质粒转染。250 μL Opti-MEM培养液稀释5 μg质粒,轻轻混匀;250 μL Opti-MEM培养液稀释6 μL Lipofectamine 3000试剂,分别震荡混匀。然后将含有质粒和脂质体的稀释液充分混匀,室温孵育15 min后,加入细胞中,6 h后换液,放入培养箱继续培养2 d。
3.2Western blot实验细胞长至90%时,吸去培养液,PBS洗3次后加入100 μL含蛋白酶抑制剂RIPA裂解液(强),冰上裂解20 min后收集细胞。4 ℃、13 200×离心15 min,取上清,BCA试剂盒测定蛋白浓度。在20 µg蛋白质样品中加入4×蛋白上样缓冲液,55 ℃变性10 min。配制10% SDS-PAGE分离蛋白样品,湿转法将蛋白转移到PVDF膜上。TBST配制5%脱脂牛奶,室温封闭1 h。TBST洗3次,每次5 min。对应的Ⅰ抗4 ℃孵育过夜,TBST洗3次,每次5 min。Ⅱ抗室温孵育1 h,TBST洗3次,每次5 min。配制ECL发光液,PVDF膜蛋白面朝上均匀滴加ECL发光液,放入化学发光成像仪中自动曝光。
3.3细胞免疫荧光染色待细胞密度长到80%~90%时,弃去培养液,PBS洗3次,每次5 min。4%多聚甲醛固定30 min后弃去,PBS浸洗3次,每次5 min。0.5% Triton X-100通透15 min后弃去,PBS洗3次,每次5 min。4%牛血清白蛋白封闭30 min,去除封闭液直接滴加稀释好的Ⅰ抗放入装有湿棉球的避光盒,4 ℃孵育过夜。第2天取出共聚焦皿,PBS浸洗3次,每次5 min。加入相应的荧光Ⅱ抗室温孵育1 h。PBS浸洗3次,每次5 min。避光滴加DAPI封片剂后在共聚焦显微镜下观察。
3.4CCK-8法检测细胞活力将小鼠心房成纤维细胞培养并传至p2代,分别转染negative control RNA及siRNA,6 h后换液并消化,将细胞定量至2×107L-1,接种于96孔板中,每组设5个副孔,每孔加入100 μl细胞悬液,空白组加入100 μL 10%胎牛血清培养液,放入高静水压培养箱培育。0、12、24、48和72 h时取出细胞,每孔加入10 μL CCK-8工作液,孵育2 h后在450 nm波长处测定吸光度()。
4 统计学处理
采用统计软件SPSS 25.0分析处理数据。数据以均数±标准差(mean±SD)表示。两组间比较用检验;多组间比较用单因素方差分析,两两比较采用LSD-检验或SNK-检验。以<0.05为差异有统计学意义。
结果
1 原代心房成纤维细胞的分离与鉴定
将原代分离培养的成纤维细胞传代至第2代,接种于共聚焦皿上,免疫荧光法检测成纤维细胞的标志蛋白α-SMA。结果显示,第2代细胞中α-SMA染色呈阳性(图1),说明从小鼠心房组织分离的细胞是成纤维细胞。

Figure 1.Immunofluorescence image of primary mouse atrial fibroblasts. Blue is the nucleus, and red is α-SMA. The scale bar=100 μm.
2 Wistar大鼠及SHR左心房组织中Piezo1蛋白表达水平检测
基线资料显示,SHR组收缩压、平均血压、舒张压及心率均显著高于Wistar组(<0.05),见表1。
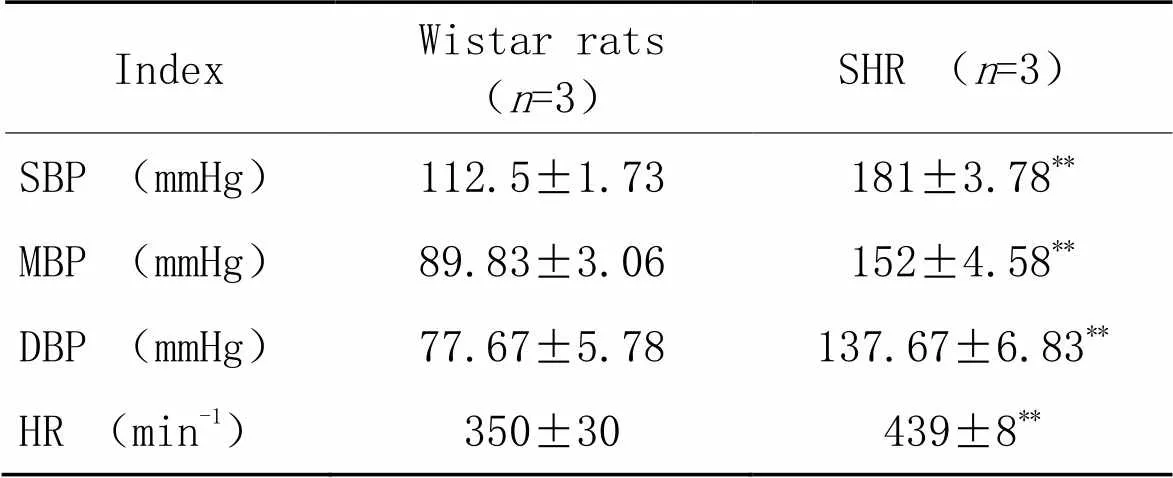
表1 Wistar大鼠和SHR的血压和心率
SBP: systolic blood pressure; MBP: mean blood pressure; DBP: diastolic blood pressure.**<0.01Wistar rats.
Western blot结果显示,SHR组左心房组织中的Piezo1表达水平显著高于Wistar组(<0.01),见图2。这表明高血压促进心脏组织Piezo1蛋白表达。

Figure 2.The protein expression of Piezo1 in left atrial tissue of Wistar and SHR. Mean±SD. n=4. **P<0.01 vs Wistar.
3 高静水压处理对小鼠心房成纤维细胞Piezo1及纤维化相关蛋白表达的影响
借助课题组自行研制的自加压装置,将小鼠心房成纤维细胞置于不同压力(0、20及40 mmHg)下培养48 h[9],Western blot检测细胞中Piezo1、Src/p-Src及纤维化相关因子Col1A1/3A1和MMP-2/9表达。结果显示,随着压力升高,机械门控离子通道Piezo1表达水平显著升高(<0.05);Src表达量稍有升高,但无显著差异,p-Src蛋白水平在20 mmHg及40 mmHg下均有升高,以20 mmHg组最显著(<0.01);纤维化相关蛋白Col1A1/3A1水平随压力梯度逐渐升高(<0.05),MMP-2表达量也显著升高,以20 mmHg升高最为显著(<0.05),MMP-9表达量在40 mmHg升高最显著(<0.01),见图3。

Figure 3.The protein expression of Piezo1, Src/p-Src and fibrosis-related factors in mouse atrial fibroblasts cultured with different pressure. A and B: representative immunoblots of Piezo1, Src/p-Src, and fibrosis-related factors; C: the level of Piezo1; D: the level of p-Src; E: the level of Src; F: the level of Col1A1; G: the level of Col3A1; H: the level of MMP-2; I: the level of MMP-9. Mean±SD. n=3. *P<0.05,** P<0.01 vs 0 mmHg group.
4 GsMTx4对高静水压所致的小鼠心房成纤维细胞Src激活及纤维化相关指标表达增加的影响
为了确定Piezo1在高静水压与心房成纤维细胞纤维化中发挥的关键作用,我们在40 mmHg压力下,以不同浓度(1、3和10 μmol/L)Piezo1抑制剂GsMTx4[9]处理心房成纤维细胞48 h,Western blot检测细胞中Piezo1、Src/p-Src及纤维化相关因子表达。结果显示,与对照组相比,GsMTx4处理组细胞中Piezo1和Src/p-Src表达量呈浓度依赖性下降,以高浓度显著(<0.05),p-Src蛋白水平在3和10μmol/L组均显著下降(<0.01);GsMTx4亦可明显逆转高静水压所致纤维化指标Col1A1、Col3A1及MMP-2/9表达增加(<0.05),见图4。

Figure 4.Effects of GsMTx4 on the expression of Piezo1, Src/p-Src and fibrosis-related factors in mouse atrial fibroblasts at 40 mmHg. A and B: representative immunoblots of Piezo1, Src/p-Src, and fibrosis-related factors; C: the level of Piezo1; D: the level of p-Src; E: the level of Src; F: the level of Col1A1; G: the level of Col3A1; H: the level of MMP-2; I: the level of MMP-9. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L group.
5 敲减Piezo1对高静水压下小鼠心房成纤维细胞中Src/p-Src和纤维化蛋白表达及细胞活力的影响
为了进一步探索Piezo1在高静水压与心房成纤维细胞纤维化中的作用,我们在40 mmHg压力下,对小鼠心房成纤维细胞行siRNA质粒转染降低Piezo1的表达,观察Src/p-Src和纤维化因子表达及细胞活力的变化。结果显示,质粒转染后Piezo1表达量显著下降(<0.05),提示敲减成功;p-Src蛋白水平也显著降低(<0.05),Src蛋白水平轻微降低,无显著差异;与negative control组相比,敲减后,纤维化指标Col1A1和MMP-2/9亦显著降低(<0.05);CCK-8结果显示,在质粒转染初期(0、12和24 h),两组值无显著差异,培养至48及72 h后,siRNA组值显著低于negative control组(<0.01),见图5。
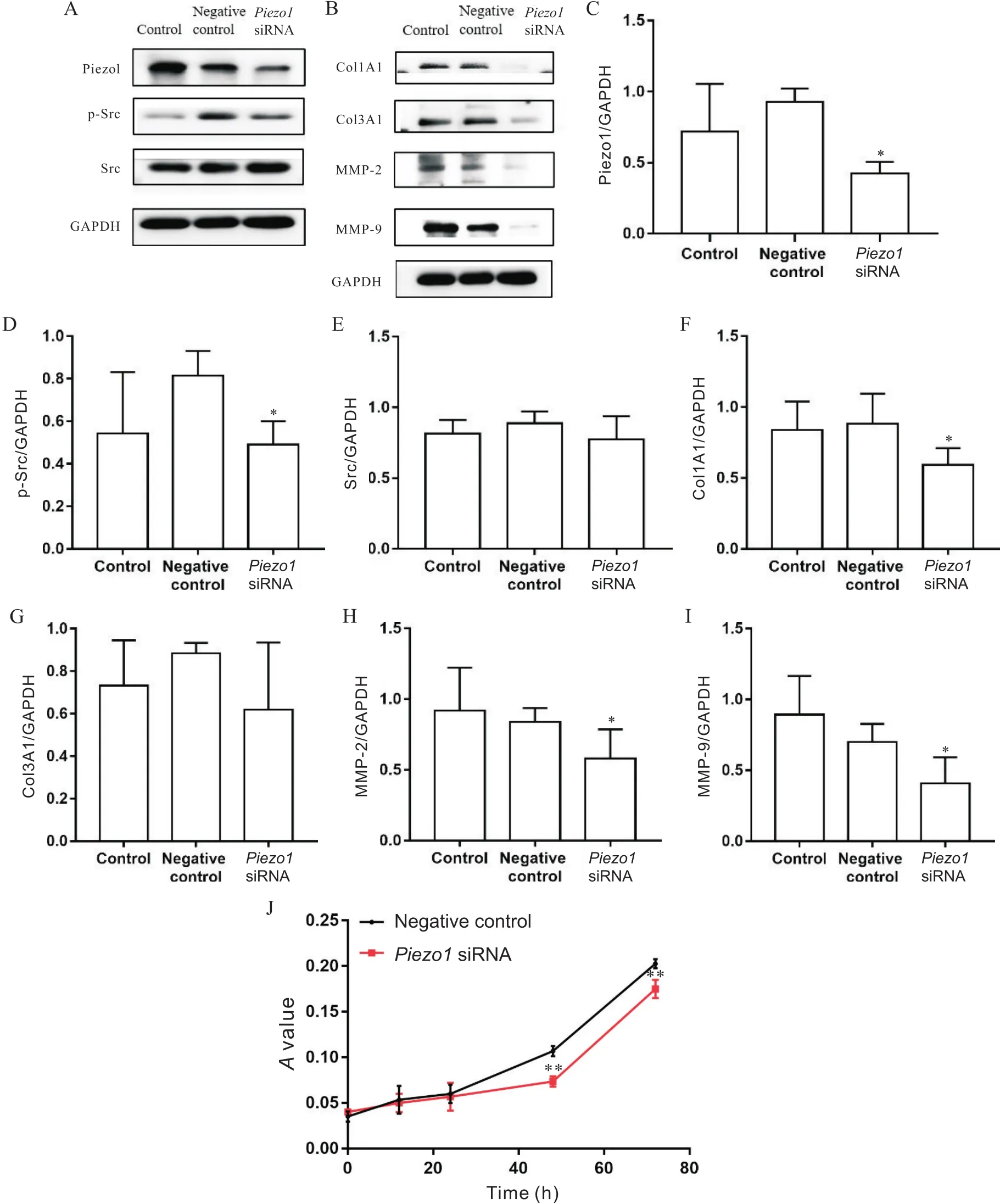
Figure 5.Effects of Piezo1 siRNA on the expression of Src/p-Src and fibrosis-related factors, and cell viability in mouse atrial fibroblasts at 40 mmHg. A and B: representative immunoblots of Piezo1, Src/p-Src, and fibrosis-related factors; C: the level of Piezo1; D: the level of p-Src; E: the level of Src; F: the level of Col1A1; G: the level of Col3A1; H: the level of MMP-2; I: the level of MMP-9; J: A value (at 450 nm) changes of the cells transfected with negative control or Piezo1 siRNA under high hydrostatic pressure. Mean±SD. n=3. *P<0.05 vs negative control group.
6 PP1干预对高静水压所致小鼠心房成纤维细胞纤维化的影响
为了探索Src在高血压与心房纤维化中的作用,我们在40 mmHg下,以不同浓度(5和10 μmol/L)的Src抑制剂PP1处理心房成纤维细胞48 h,Western blot检测细胞中Src/p-Src及纤维化相关蛋白表达。与0 mmHg组相比,高静水压(40 mmHg)组p-Src表达量显著上升(<0.05),加入PP1后p-Src表达量显著下降,以10 μmol/L组明显(<0.05);Src蛋白水平有下降趋势,但无显著差异;纤维化指标Col1A1/3A1和MMP-2/9蛋白水平在40 mmHg组显著上升(<0.05),PP1处理后纤维化因子Col1A1/3A1和MMP-2/9表达量呈浓度依赖性递减,以10 μmol/L组下降最显著(<0.01),见图6。

Figure 6.Effects of PP1 on the expression of Src/p-Src and fibrosis-related factors in mouse atrial fibroblasts at 0 mmHg or 40 mmHg. A and B: representative immunoblots of Src/p-Src and fibrosis-related factors; C: the level of p-Src; D: the level of Src; E: the level of Col1A1; F: the level of Col3A1; G: the level of MMP-2; H: the level of MMP-9. Mean±SD. n=3. #P<0.05, ##P<0.01 vs 0 mmHg group; *P<0.05, **P<0.01 vs DMSO group.
7 Yoda1对小鼠心房成纤维细胞Piezo1、Src/p-Src及纤维化蛋白表达的影响
以不同浓度(1、3和10 μmol/L)的特异性Piezo1激动剂Yoda1[10]处理心房成纤维细胞48 h,Western blot检测细胞中Piezo1、Src/p-Src及纤维化相关蛋白表达。结果显示,与DMSO组相比,Yoda1干预组的小鼠心房成纤维细胞Piezo1表达量呈浓度依赖性升高,以10 μmol/L蛋白水平达到最高(<0.05);p-Src在10 μmol/L时表达量达到最高(<0.05),而Src无显著差异;纤维化蛋白Col1A1和MMP-2在高浓度Yoda1(10 μmol/L)处理组表达量显著升高(<0.01),而MMP-9在3 μmol/L浓度下蛋白水平升高最显著(<0.05),Col3A1虽有升高趋势,但无显著差异,见图7。

Figure 7.Effects of Yoda1 on the expression of Piezo1, Src/p-Src and fibrosis-related factors in mouse atrial fibroblasts. A and B: representative immunoblots of Piezo1, Src/p-Src, and fibrosis-related factors; C: the level of Piezo1; D: the level of p-Src; E: the level of Src; F: the level of Col1A1; G: the level of Col3A1; H: the level of MMP-2; I: the level of MMP-9. Mean±SD. n=3. *P<0.05, **P<0.01 vs DMSO group.
讨论
以上研究表明,高静水压激活心房成纤维细胞中的机械敏感通道Piezo1,Src蛋白表达水平及磷酸化增加,最后导致细胞中的纤维化相关因子水平升高。抑制Piezo1功能可显著降低Src和p-Src的表达,减少纤维化相关蛋白的分泌;敲减可以显著抑制小鼠心房成纤维细胞的增殖。Src特异性抑制剂PP1可显著抑制心房成纤维细胞中的纤维化相关蛋白分泌。应用Piezo1特异性激动剂Yoda1可使细胞内Src/p-Src及纤维化相关因子水平升高。说明小鼠心房成纤维细胞中Piezo1/Src在高静水压所致的心房纤维化中起重要作用。
高血压患者左心房压力增加,心房壁紧张度增加,其主要的机械应力变化为静水压和牵张力的增加。且高血压可导致心房纤维化,房性心律失常易感性增加[11]。MMPs几乎能降解细胞外基质的所有蛋白,在组织和细胞外基质重塑中起着基础性的作用,参与器官扩张和结构重塑。活化的MMP-2定位于细胞穿透基质的突出部位,在酶解细胞间基质成分及基底膜的主要成分Ⅳ型胶原中起重要作用。在体研究表明,机械负荷的变化与细胞外基质的调节有关,机械力的增加有助于细胞外基质成分的表达和沉积或纤维化的增强,病理性纤维化可导致许多器官系统功能障碍[12]。但高静水压如何转变成生物信号,导致纤维化相关因子的分泌增加,参与房颤的病理过程,尚未见报道。
机械门控通道蛋白Piezo1通过直接的膜张力进行门控,任何改变膜张力的生理作用力都可激活通道,如戳刺、拉伸、流体剪切力等。人造液滴脂质双分子层实验表明,Piezo1的机械敏感性是固有的,不需要其他蛋白质或第二信使信号激活[13]。Piezo1也可借助附属蛋白调节通道的敏感性,如在触觉敏感细胞中,Piezo1与气孔素样蛋白3(stomatin-like protein 3, STOML3)相互作用,从而调节Piezo1通道,极大地提高了Piezo1的敏感性[14]。Piezo1在心血管系统中起重要作用。有研究发现,动脉血流激活血管壁的Piezo1通道,内皮细胞释放ATP,同时激活P2Y2/Gq/G11通路,调控NO生成,调节血管收缩反应[15]。本研究表明,高静水压激活小鼠心房成纤维细胞的Piezo1通道,继而调控纤维化和细胞外基质重塑。由此证实Piezo1在高血压所致纤维化中起着重要作用。
此外,本研究还探索了Src激酶在连接Piezo1和纤维化中的作用。Src是细胞蛋白质酪氨酸激酶成员之一,是具有代表性的一种非受体膜结合酪氨酸激酶,在各种细胞信号通路中发挥重要作用,是许多基本生命活动所需级联反应的重要节点。Src也参与细胞纤维化的过程。有研究显示,Src激酶介导单侧输尿管梗阻引起的肾间质纤维化,机制研究Src激酶通过激活ERK和Akt促进肾肌成纤维细胞聚集、促纤维化因子分泌和炎症反应[16]。在Graves眼病中,Src通过TGF-β/Smad、NF-κB及PI3K/Akt等信号通路诱导眶成纤维化细胞分化成肌成纤维细胞,继而分泌促纤维化因子,引起眼外肌纤维化[17]。本研究首次发现,高静水压下的小鼠心房成纤维细胞中Src和p-Src表达量升高,并促进纤维化蛋白分泌,细胞外基质重塑。但高静水压下Piezo1如何激活Src,仍需进一步探索。
综上所述,本研究初步证实机械力敏感通道蛋白Piezo1可能通过激活Src参与小鼠心房成纤维细胞高静水压相关纤维化,最终导致AF的发生和发展。
(致谢:本研究在广东省人民医院医学研究部心血管药理实验室进行,在此非常感谢各位实验室成员对本实验研究所付出的艰辛和努力!)
[1] Wang Z, Chen Z, Wang X, et al. The disease burden of atrial fibrillation in China from a national cross-sectional survey[J]. Am J Cardiol, 2018, 122(5):793-798.
[2] Grundvold I, Skretteberg PT, Liestøl K, et al. Upper normal blood pressures predict incident atrial fibrillation in healthy middle-aged men: a 35-year follow-up study[J]. Hypertension, 2012, 59(2):198-204.
[3] Carver W, Goldsmith EC. Regulation of tissue fibrosis by the biomechanical environment[J]. Biomed Res Int, 2013, 2013:101979.
[4] Beech DJ, Kalli AC. Force sensing by piezo channels in cardiovascular health and disease[J]. Arterioscler Thromb Vasc Biol, 2019, 39(11):2228-2239.
[5] Ridone P, Vassalli M, Martinac B. Piezo1 mechanosensitive channels: what are they and why are they important[J]. Biophys Rev, 2019, 11(5):795-805.
[6] Retailleau K, Duprat F, Arhatte M, et al. Piezo1 in smooth muscle cells is involved in hypertension-dependent arterial remodeling[J]. Cell Rep, 2015, 13(6):1161-1171.
[7] Liang J, Huang B, Yuan G, et al. Stretch-activated channel Piezo1 is up-regulated in failure heart and cardiomyocyte stimulated by Ang Ⅱ[J]. Am J Transl Res, 2017, 9(6):2945-2955.
[8] Wang X, Ren R, Xu Z, et al. Tirbanibulin attenuates pulmonary fibrosis by modulating Src/STAT3 signaling[J]. Front Pharmacol, 2021, 12:693906.
[9]何苏月, 马卓琳, 范昕然, 等. 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常[J]. 中国病理生理杂志, 2021, 37(4):577-585.
He S, Ma Z, Fan X, et al. Mechanosensitive piezo1 channel is involved in visceral hypersensitivity and abnormal 5-HT metabolism of rats with irritable bowel syndrome induced by chronic water avoidance stress[J]. Chin J Pathophysiol, 2021, 37(4):577-585.
[10] 刘佳丽, 徐攀高, 张蕾, 等. 机械敏感性离子通道Piezo1在心血管疾病中的研究进展[J]. 中国病理生理杂志, 2021, 37(7):1310-1316.
Liu J, Xu P, Zhang L, et al. Research progress of mechanosensitive ion channel Piezo1 in cardiovascular diseases[J]. Chine J Pathophysiol, 2021, 37(7):1310-1316.
[11] Choisy SC, Arberry LA, Hancox JC, et al. Increased susceptibility to atrial tachyarrhythmia in spontaneously hypertensive rat hearts[J]. Hypertension, 2007, 49(3):498-505.
[12] Carver W, Goldsmith EC. Regulation of tissue fibrosis by the biomechanical environment[J]. Biomed Res Int, 2013, 2013:101979.
[13] Syeda R, Florendo MN, Cox CD, et al. Piezo1 channels are inherently mechanosensitive[J]. Cell Rep, 2016, 17(7):1739-1746.
[14] Poole K, Herget R, Lapatsina L, et al. Tuning piezo ion channels to detect molecular-scale movements relevant for fine touch[J]. Nat Commun, 2014, 5:3520.
[15] Wang S, Chennupati R, Kaur H, et al. Endothelial cation channel piezo1 controls blood pressure by mediating flow-induced ATP release[J]. J Clin Invest, 2016, 126(12):4527-4536.
[16] Takano H, Zou Y, Hasegawa H, et al. Oxidative stress-induced signal transduction pathways in cardiac myocytes: involvement of ROS in heart diseases[J]. Antioxid Redox Signal, 2003, 5(6):789-794.
[17] Hao M, Sun J, Zhang Y, et al. Exploring the role of src in extraocular muscle fibrosis of the Graves' ophthalmopathy[J]. Front Bioeng Biotechnol, 2020, 8:392.
Involvement of mechanically activated Piezo1 channels in atrial fibrosis induced by elevated hydrostatic pressure
LIU Hui-yi1, RAO Fang1, YE Xing-dong1, JIN Shu-yu1,2, FU Lu1, DENG Chun-yu1, YANG Hui1, KUANG Su-juan1, WU Shu-lin1, XUE Yu-mei1△
(1,,,,510080,;2,,510515,)
To investigate the role and possible mechanism of mechanosensitive ion channel Piezo1 in hypertension-induced atrial fibrosis and even atrial fibrillation.Primary atrial fibroblasts from 6-to-8-week-old male C57BL/6 mice were isolated and cultured by enzyme digestion, and the cell hypertension model was established using self-made pressure device. Western blot analysis was conducted to compare the expression levels of Piezo1, Src/p-Src, and fibrosis indicators collagen type I/III α1 chain (Col1A1/3A1) and matrix metalloproteinase-2/9 (MMP-2/9) in the cells under different pressure interventions (0, 20 and 40 mmHg). At 40 mmHg, the cells were given different concentrations (1, 3 and 10 µmol/L) of ion channel inhibitor GsMTx4 orsiRNA, or Src inhibitor PP1 (5 and 10 µmol/L), and the changes of Src/p-src and fibrosis-related factor protein levels were observed. The changes of Src/p-Src and fibrosis-related factor protein levels were also observed when the cells were given different concentrations of Piezo1-specific agonist Yoda1 (1, 3 and 10 µmol/L).Higher hydrostatic pressure (20 and 40 mmHg) increased the expression of Piezo1 and Src in mouse atrial fibroblasts (<0.05), accompanied by increases in Src/p-Src, and fibrosis indicators Col1A1/3A1 and MMP-2/9. GsMTx4,siRNA or PP1 significantly reversed the above changes (<0.05). In addition, Piezo1 agonist Yoda1 simulated the changes of electrical remodeling and related signal molecules in atrial myocytes induced by high hydrostatic pressure (<0.05).Mechanosensitive ion channel Piezo1/Src kinase signaling pathway is activated during hypertension, leading to the decreases in Col1A1/3A1 and MMP-2/9 and the electrical remodeling of atrial myocytes.
Piezo1 protein; Hypertension; Atrial fibroblasts; Atrial fibrillation
R541.7+5; R363.2
A
10.3969/j.issn.1000-4718.2022.03.002
1000-4718(2022)03-0394-09
2021-09-24
2021-12-06
[基金项目]国家自然科学基金资助项目(No. 81870254)
Tel: 020-83827812; E-mail: xymgdci@163.com
(责任编辑:卢萍,罗森)
