水通道蛋白1在切应力调节血管内皮细胞迁移和血管生成中的作用及机制*
2022-03-28张敏孙玉杜大鹏王小波于建新王汉琴
张敏, 孙玉, 杜大鹏, 王小波, 于建新, 王汉琴△
水通道蛋白1在切应力调节血管内皮细胞迁移和血管生成中的作用及机制*
张敏1,2, 孙玉1, 杜大鹏1,2, 王小波1, 于建新1, 王汉琴1,2△
(1湖北医药学院附属随州医院转化医学研究中心,湖北 随州 441300;2湖北医药学院基础医学院解剖学教研室,湖北 十堰 442000)
探讨流体切应力作用下水通道蛋白1(AQP1)的表达对血管内皮细胞迁移和血管生成的影响及可能的机制。取雄性C57BL/6小鼠主动脉弓和胸主动脉血管壁组织,用qPCR和Western blot检测体内不同切应力作用部位血管壁AQP1表达的差异。原代培养人脐静脉内皮细胞(HUVECs),体外采用平行平板流动腔系统给HUVECs分别加载层流(LF,15 dyn/cm2单向层切应力)和扰流[DF,(0.5±4) dyn/cm2振荡切应力],用特异性小干扰RNA(siRNA)转染技术沉默基因,采用Transwell实验和Matrigel小管形成实验检测HUVECs迁移和血管生成能力;用Western blot检测内皮型一氧化氮合酶(eNOS)Ser1177和Ser633磷酸化水平。在体胸主动脉中AQP1的mRNA和蛋白表达显著高于主动脉弓(<0.05)。HUVECs静态下敲减可以显著抑制细胞迁移和血管生成(<0.01)。与DF组相比,LF显著上调HUVECs中AQP1的mRNA和蛋白表达(<0.05),促进HUVECs迁移(<0.01)和血管生成能力(<0.05),同时显著增加eNOS Ser1177(<0.01)和Ser633(<0.05)磷酸化水平。转染siAQP1后,LF诱导的AQP1表达增强被抑制(<0.01),HUVECs的迁移和血管生成能力也随之降低(<0.01),同时eNOS Ser1177和Ser633的磷酸化水平降低(<0.05或<0.01)。eNOS抑制剂G-硝基-L-精氨酸甲酯(L-NAME)预处理HUVECs后,LF诱导的细胞迁移和血管生成能力被抑制(<0.01)。AQP1在流体切应力调节血管内皮细胞迁移和血管生成中发挥作用,其机制可能和eNOS信号有关。
水通道蛋白1;切应力;血管生成;血管内皮细胞;内皮型一氧化氮合酶
水通道蛋白1(aquaporin 1, AQP1)是细胞膜上的疏水跨膜蛋白,也是目前唯一发现在内皮有表达的水通道蛋白[1]。研究表明,AQP1在恶性肿瘤的微血管内皮高表达,能促进内皮细胞迁移影响肿瘤血管形成[2];还有研究证实AQP1与血管内皮生长因子各自独立地调节视网膜微血管内皮细胞的血管新生[3]。除微血管内皮外,AQP1表达水平显著影响体外培养的小鼠主动脉内皮细胞迁移和血管生成能力[2]。显然,AQP1对血管内皮细胞的功能调节值得深入探讨。
在人体生理状态下,血流在动脉直段流体多为层流(laminar flow, LF),对血管内皮有保护作用,能抵抗动脉粥样硬化发生;而在动脉分支、分叉和弯曲等处血流为扰流(disturbed flow, DF),易损伤内皮,诱发动脉粥样硬化发生[4]。Fontijn等[5]在动物实验中观察到AQP1在没有斑块发生的血管内膜高表达,而在有斑块的内膜表达缺失。体外实验显示,12 dyn/cm2的LF切应力可以上调人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)中AQP1的表达,并在细胞迁移中起作用[6]。近期还发现静水压力通过AQP1促进HUVECs小管形成[7]。以上研究都说明了机械应力对血管内皮细胞AQP1表达的调节作用,但是,AQP1对流体切应力的响应及下游的信号机制尚不完全清楚。
本研究利用平行平板流动腔系统,对体外原代培养的HUVECs施加流体切应力刺激,LF为加载15 dyn/cm2单向层切应力(laminar shear stress),DF为加载(0.5±4) dyn/cm2振荡切应力(oscillatory shear stress),检测AQP1的表达与HUVECs迁移和血管生成能力的改变,并观察内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)信号的激活,从力学生物学角度进一步探讨AQP1对血管内皮功能的调节作用。
材料和方法
1 主要试剂
胎牛血清(fetal bovine serum, FBS)和M199培养液购自Gibco;酸性成纤维细胞生长因子(acidic fibroblast growth factor, aFGF)购自Sigma;Trizol和Lipofectamine™ 3000购自Invitrogen;逆转录试剂盒K1621购自Thermo;iTaqTMUniversal SYBR Green Supermix购自Bio-Rad。G-硝基-L-精氨酸甲酯(G-nitro-L-arginine methyl ester, L-NAME)购自TargetMol;AQP1抗体购自GeneTex;总eNOS抗体和p-eNOS (Ser1177)抗体购自Novus;p-eNOS (Ser633)抗体购自BD;β-actin抗体和BCIP/NBT碱性磷酸酶显色试剂盒购自上海碧云天生物技术有限公司。Matrigel购自BD;Transwell小室购自Corning。
2 方法
2.1HUVECs的培养及鉴定采用我们既往报道方法[8]。取新鲜新生儿脐带(湖北医药学院附属随州医院产科提供,标本采集经过患者家属知情同意及医院伦理委员会批准)。找到脐静脉后用0.125%胰酶消化,将细胞悬液接种在已用0.1 g/L多聚赖氨酸包被的培养瓶中,加入内皮细胞培养液(含20% FBS的M199培养液中加入100 mmol/L HEPES、10 nmol/L胸苷、2 mmol/L谷氨酰胺、4 g/L aFGF和5 000 U/L肝素),置于5% CO2、37 ℃培养箱中静置8 h,待细胞贴壁后换液,大约7 d长至融合状态。胰酶消化后传代,血管性血友病因子(von Willebrand factor, vWF)免疫荧光鉴定,取第2~4代用于实验。
2.2动物及取材6~8周龄SPF级雄性C57BL/6小鼠28只,体质量18~22 g,由湖北医药学院实验动物中心提供,许可证号为SCXK(鄂)2017-0012。用戊巴比妥钠经腹腔注射麻醉后,固定、充分暴露小鼠胸腔,剪开右心耳分离出主动脉,取胸主动脉直段和主动脉弓小弯侧血管壁组织,用EP管置于液氮中保存。
2.3流体切应力加载平行平板流动腔系统(购自上海泉众机电科技有限公司)用于流体切应力加载。该系统包括恒流泵、储液瓶、管道及流室,细胞沿中轴方向种植于7.62 cm×2.54 cm×0.12 cm(长×宽×高)经过用0.1 g/L多聚赖氨酸包被的载玻片上。载玻片置入流室后,在载玻片上方形成高度0.02 cm、宽度2.30 cm的流道,采用=6/2计算切应力强度。为壁面切应力(Pa),为流量(cm3/s),为液体黏度(Pa·s),和分别为流动腔的宽和高(cm)。其中和恒定,平行平板流动腔系统所用灌流液均为含1%FBS的M199。通过调节恒流泵改变值,达到实验所需15 dyn/cm2单向层切应力(LF组);在灌流液进入流室前,增加一个扰流泵,通过调节扰流泵往复频率,获得(0.5±4) dyn/cm2振荡切应力(DF组)。
2.4Transwell迁移实验将预先处理好的HUVECs以每孔2×104的数量(总体积200 μL,含1%FBS)接种于Transwell小室的上室,下室每孔加入500 μL含20% FBS的M199完全培养液,常规培养12 h后取出小室,PBS清洗小室2遍,用棉签轻轻擦去微孔膜上层未迁移的细胞。将迁移的细胞用4%多聚甲醛固定20 min,结晶紫染色10 min,三蒸水漂洗3次,晾干,倒置相差显微镜观察并拍照计数。
2.5Matrigel小管形成实验在96孔板中加入50 μL提前稀释的Matrigel,放入37 ℃培养箱孵育30 min,尽可能避免气泡产生。将预先处理好的HUVECs消化后用含1% FBS的M199培养液制成细胞悬液,以每孔2×104个细胞的密度接种于96孔板,置于37 ℃、5% CO2培养箱中孵育4 h,显微镜下观察小管形成、拍照,使用ImageJ软件测量成管数量、长度。
2.6siRNA干扰实验依据GenBank中人基因全长cDNA序列,委托广州锐博生物科技有限公司合成特异性靶向基因的siRNA片段。待HUVECs生长融合至80%时,用Lipofectamine™ 3000介导siRNA转染,实验方法按说明书进行。转染后36 h用qPCR检测。阴性对照RNA(scrambled siRNA,siScr)序列正义链为5'-UUCUCCGAACGUGUCACGUTT-3',反义链为5'-ACGUGACACGUUCGGAGAATT-3'。筛选出最佳siAQP1序列正义链为5'-UGGCUGUACUCAUCUACGAdTdT-3',反义链为5'-UCGUAGAUGAGUACAGCCAdTdT-3'。
2.7实验分组加载15 dyn/cm2单向层切应力(LF组)为实验组,加载(0.5±4) dyn/cm2振荡切应力(DF组)为对照组。HUVECs分别转染阴性对照乱序RNA(siScr)和有效干扰序列(siAQP1)后,移入流动腔系统,siScr+LF和siAQP1+LF为实验组,siScr+DF和siAQP1+DF为平行对照组。HUVECs用L-NAME(20 μmol/L)和DMSO孵育30 min后,移入流动腔系统,DMSO+LF和L-NAME+LF为实验组,DMSO+DF和L-NAME+DF为平行对照组。
2.8qPCR实验使用Trizol试剂从细胞或组织中分离总RNA,使用逆转录试剂盒获得cDNA,采用SYBR Green PCR试剂盒进行qPCR。GAPDH用于标准化AQP1的相对表达,采用2-ΔΔCt法计算相对表达量,每个样品设3个复孔。人源AQP1的上游引物序列5'-GGACACCTCCTGGCTATTGA-3',下游引物序列5'-GAATGGCCCCACCCAGAAAA-3';人源GAPDH的上游引物序列5'-ATGGAAATCCCATCACCATCTT-3',下游引物序列5'-CGCCCCACTTGATTTTGG-3'。小鼠源AQP1的上游引物序列5'-GCGCCGAGACTTAGGTGG-3',下游引物序列5'-GCCAGTGTAGTCAATCGCCAG-3';小鼠源GAPDH的上游引物序列5'-GGGTTCCTATAAATACGGACTGC-3',下游引物序列5'-TCTACGGGACGAGGCTGG-3'。
2.9Western blot检测将预先处理好的细胞,用冷PBS清洗一次(组织用液氮碾磨后),加入蛋白裂解混合液(RIPA裂解液与蛋白酶抑制剂混合物的比例为49∶1),超声波粉碎变性后备用;用10% SDS-PAGE分离,转膜后用5%牛血清白蛋白室温封闭至少2 h;Ⅰ抗[AQP1、eNOS、p-eNOS (Ser633)、p-eNOS (Ser1177)和β-actin,均按1∶1 000比例稀释]4℃摇床孵育过夜;Ⅱ抗(碱性磷酸酶标记的山羊抗兔和山羊抗小鼠IgG,1∶2 000比例稀释),室温孵育2 h;TBST清洗膜后加入BCIP/NBT显色液显色。β-actin作为内参照。
3 统计学处理
数据以均数±标准差(mean±SD)表示,应用GraphPad Prism 8.0软件进行数据处理和分析。实验数据均为至少3次独立重复实验结果,两组间均数比较采用Student's检验,多组间比较采用单因素方差分析(one-way ANOVA)。以0.05表示差异具有统计学意义。
结果
1 体内、体外不同切应力对血管内皮细胞AQP1表达的影响
如图1A所示,取C57BL/6小鼠胸主动脉直段(受层流作用部位)和主动脉弓小弯侧(受扰流作用部位)血管壁组织。qPCR和Western blot结果显示,胸主动脉直段AQP1的mRNA和蛋白表达显著高于主动脉弓小弯侧(<0.05),见图1B。
体外静态培养HUVECs(static, ST组),以及加载单向层切应力刺激(LF组)和振荡切应力刺激(DF组)。首先,从形态上观察(图1C),ST组和DF组细胞呈现无规则排列,而LF组中细胞沿流体方向整齐排列并被拉长,细胞状态良好;其次,qPCR和Western blot结果显示,LF组AQP1的mRNA和蛋白表达显著高于DF组和ST组(<0.01或<0.05),见图1D。

Figure 1.Effect of shear stress on the AQP1 expression in aortic tissues of mice and in HUVECs cultured invitro. A: the diagram of aortic arches and straight segments of thoracic aortas obtained from C57BL/6 mice; B: AQP1 mRNA and protein levels in aortas were detected by qPCR and Western blot, respectively; C: representative morphological images of HUVECs exposed to static control (ST), laminar flow (LF) and disturbed flow (DF) for 24 h (the arrow points to the direction of the force on HUVECs; scale bar=10 μm); D: AQP1 mRNA and protein levels in HUVECs under ST, LF and DF conditions for 8 h. Mean±SD. n=3. △P<0.05 vs aortic arch group; *P<0.05, **P<0.01 vs ST group; #P<0.05 vs LF group.
2 敲减AQP1抑制HUVECs迁移和血管生成
HUVECs转染特异性siRNA(siAQP1),Western blot结果显示(图2A),与siScr组相比较,siAQP1组AQP1蛋白表达显著降低(<0.01)。Transwell迁移形成实验表明(图2B),siAQP1组HUVECs迁移细胞数量显著低于siScr组(<0.01)。Matrigel小管形成实验表明(图2C),siAQP1组细胞成管数量显著少于siScr组(<0.01)。

Figure 2.Effect of AQP1 knockdown on the migration and angiogenesis of HUVECs. HUVECs were treated with siScr or siAQP1 transfection. A: Western blot was used to confirm the down-regulation of AQP1 protein; B: the migration of HUVECs was detected by Transwell assay; C: the angiogenesis of HUVECs was determined by tube formation assay. The scale bar=50 μm. Mean±SD. n=4. **P<0.01 vs siScr group.
3 切应力对HUVECs迁移和血管生成的影响
HUVECs加载DF和LF,Transwell迁移实验显示(图3A),LF组迁移细胞数量显著高于DF组(<0.01);Matrigel小管形成实验显示(图3B),LF组细胞成管数量显著高于DF组(<0.05)。

Figure 3.Effect of shear stress on the migration and angiogenesis of HUVECs. HUVECs were exposed to LF or DF for 8 h. A: Transwell assay was performed to detect the migration of HUVECs; B: tube formation assay was performed to assess the angiogenesis of HUVECs. The scale bar=50 μm. Mean±SD. n=3. *P<0.05, **P<0.01 vs DF group.
4 敲减AQP1对切应力诱导的HUVECs迁移和血管生成的影响
HUVECs转染siAQP1和siScr后,加载LF和DF,Western blot结果显示(图4A),siScr+LF组细胞AQP1蛋白表达显著高于siScr+DF组(<0.01);与siScr+LF组比较,siAQP1+LF组上调的AQP1蛋白表达显著被抑制(<0.01)。Transwell迁移(图4B)和Matrigel小管形成实验(图4C)显示,siScr+LF组迁移细胞和成管数量均显著高于siScr+DF组(<0.01);而与siScr+LF组比较,siAQP1+LF组迁移细胞和细胞成管数量均显著被抑制(<0.01)。
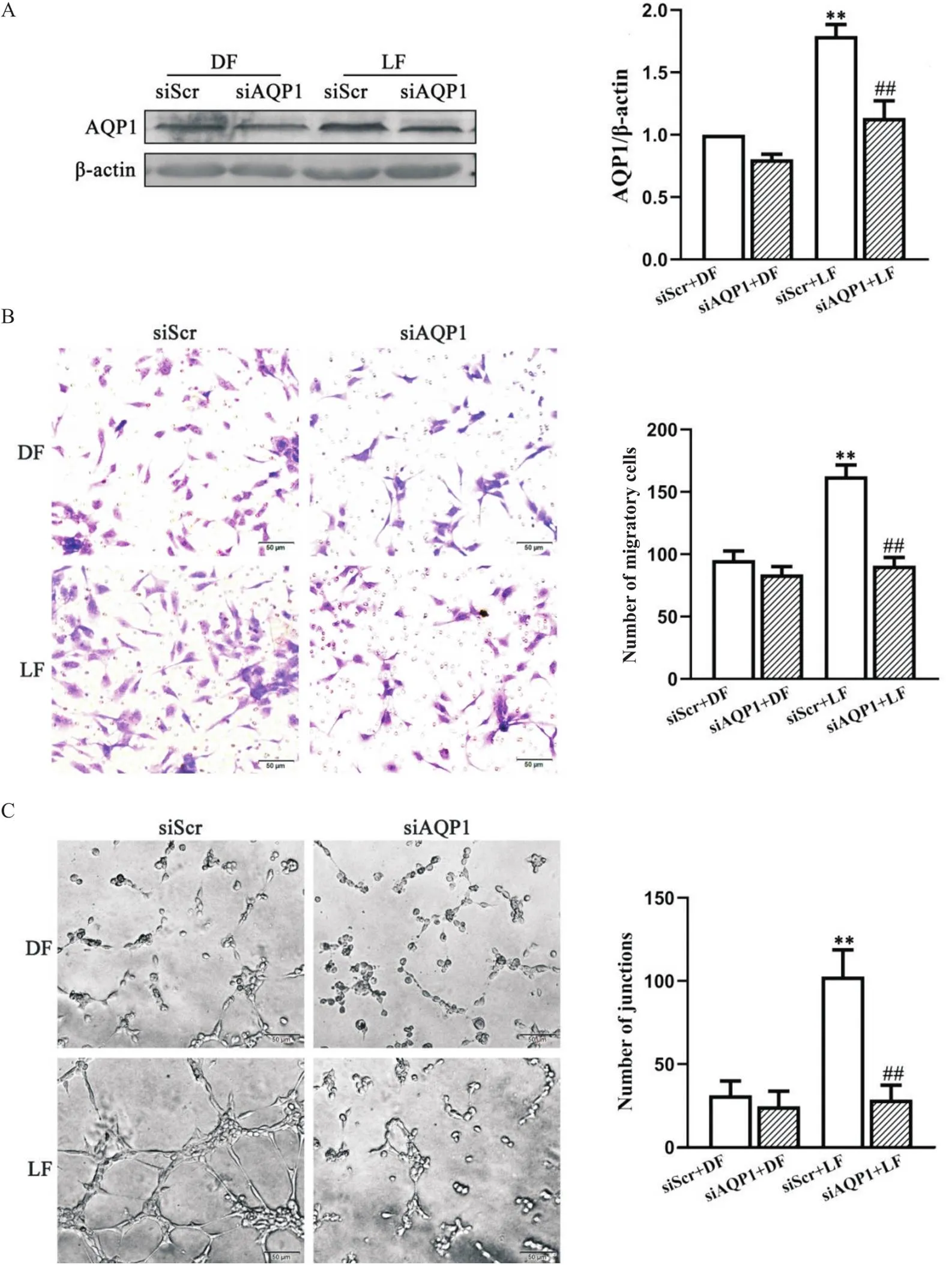
Figure 4.Effectof AQP1 knockdown on the migration and angiogenesis of HUVECs induced by LF. HUVECs were treated with siScr or siAQP1 transfection and then exposed to DF or LF for 8 h. A: AQP1 protein level was detected by Western blot; B: the migration of HUVECs was determined by Transwell assay; C: the angiogenesis of HUVECs was assessed by tube formation assay. The scale bar=50 μm. Mean±SD. n=3. **P<0.01 vs siScr+DF group; ##P<0.01 vs siScr+LF group.
5 切应力通过AQP1调节eNOS Ser1177和Ser633位点磷酸化
Western blot结果显示(图5A),与DF相比,LF能显著上调eNOS Ser1177(<0.01)和Ser633(<0.05)磷酸化水平。HUVECs转染siAQP1和siScr后,再加载LF和DF,Western blot结果显示,siScr+LF组eNOS的Ser1177和Ser633磷酸化水平显著高于siScr+DF组(<0.01);而siAQP1+LF组显著抑制了siScr+LF组上调的eNOS Ser1177(<0.05)和Ser633(<0.01)磷酸化水平,见图5B。
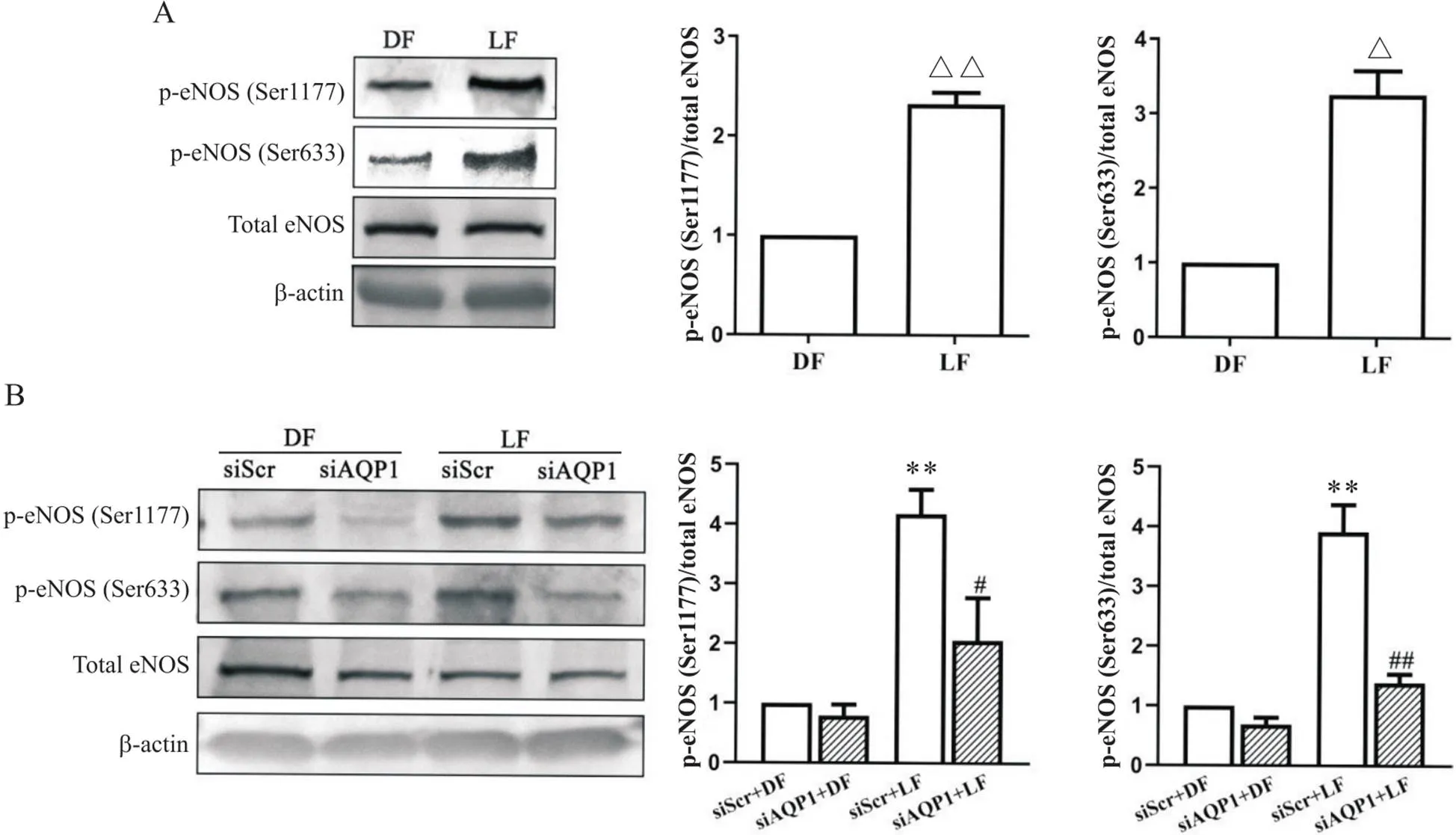
Figure 5.Effectof AQP1 knockdown on LF-induced phosphorylation of eNOS in HUVECs. A: HUVECs were exposed to LF or DF for 8 h, and the phosphorylation of eNOS at Ser1177 and Ser633 was determined by Western blot; B: HUVECs were treated with siScr or siAQP1 transfection and then exposed to DF or LF for 8 h, and the phosphorylation of eNOS at Ser1177 and Ser633 was assessed by Western blot. Mean±SD. n=3. △P<0.05, △△P<0.01 vs DF group; **P<0.01 vs siScr+DF group; #P<0.05, ##P<0.01 vs siScr+LF group.
6 eNOS抑制剂L-NAME对切应力诱导的HUVECs迁移和血管生成的影响
为了进一步检测eNOS对HUVECs迁移和血管生成能力的作用。细胞用eNOS抑制剂L-NAME(20 μmol/L)孵育30 min后,加载LF和DF,Transwell迁移和Matrigel小管形成实验结果统计分析如图6所示,DMSO+LF组迁移细胞和成管数量均显著高于DMSO+DF组(<0.05,<0.01);而与DMSO+LF组相比较,L-NAME+LF组迁移细胞和细胞成管数量均显著减少(<0.01)。

Figure 6.Effect of L-NAME on the migration and angiogenesis of HUVECs induced by LF. HUVECs were pretreated with L-NAME or DMSO for 30 min and then exposed to DF or LF for 8 h. A: the migration of HUVECs was determined by Transwell assay; B: the angiogenesis of HUVECs was assessed by tube formation assay. Mean±SD. n=3. *P<0.05, **P<0.01 vs DMSO+DF group; ##P<0.01 vs DMSO+LF group.
讨论
既往研究报道,各种形式的机械刺激作用血管内皮细胞,比如流体切应力[6, 9]、静水压力[7, 10]、高血压[11]等,都可以调节AQP1的表达,说明AQP1对机械应力敏感。在人体生理环境下血管流体切应力波动较大,动脉管壁切应力大小在10 dyn/cm2以上,流体为层流,能诱导动脉粥样硬化保护性基因的表达;在动脉分支、分叉和弯曲处等动脉粥样硬化好发部位,切应力低(<4 dyn/cm2)且多为扰流[4]。为了在体外探讨流体切应力对血管内皮细胞的影响,本研究选择以加载15 dyn/cm2单向层切应力为层流刺激;加载(0.5±4) dyn/cm2(频率1 Hz)的振荡切应力为扰流刺激,模拟在体血流切应力环境。结果显示,和静止培养的HUVECs相比,层流切应力促进了AQP1表达,这一点与既往结果一致[6]。考虑到在体血管内皮细胞始终受到血流刺激,一般不存在完全静止状态,因此,以(0.5±4) dyn/cm2的振荡切应力为对照,我们观察到AQP1在层流组表达水平显著高于扰流组,这一点在动物体内也得到验证(AQP1在受层流刺激的小鼠胸主动脉中的表达显著高于受扰流刺激的主动脉弓)。以上结果提示,AQP1在具有内皮保护作用的切应力刺激下高表达,而在促动脉粥样硬化发生的扰流作用下表达被抑制,可能在动脉粥样硬化发生过程中发挥作用。
和已有的研究结果一致[2, 12],敲减表达后,我们观察到HUVECs迁移和血管生成能力均降低。和扰流刺激相比,层流在显著上调AQP1表达的同时,HUVECs迁移和血管生成能力均显著增强,的敲减,会抑制层流刺激下的HUVECs这些功能。说明AQP1的表达水平在内皮细胞功能变化中起作用,流体切应力可以通过AQP1来调节血管内皮细胞功能。
eNOS在调节内皮细胞增殖、迁移和血管生成中发挥重要作用[13-14]。有研究报道AQP1参与了人主动脉内皮细胞中eNOS的活化[15]。eNOS活性调节的一个重要方式就是磷酸化位点的调控,其中Ser1177、Ser615、Ser633和Tyr81位点的磷酸化水平增高可使该酶活性增强[8, 16-17]。我们首先检测到层流切应力在上调HUVECs中AQP1蛋白表达同时还显著增加磷酸化eNOS(Ser1177和Ser633位点)表达,敲减后,层流切应力上调的磷酸化eNOS(Ser1177和Ser633位点)均被抑制,这就说明层流切应力可能通过AQP1调节eNOS活性,而且对eNOSSer1177和Ser633位点都有调节作用。同时,我们用eNOS抑制剂后,发现层流切应力增加的HUVECs迁移和血管生成能力被抑制,说明AQP1可能是通过调节eNOS的活化而发挥作用。当然,有关AQP1对eNOS不同磷酸化位点的调控还值得深入研究。
综上所述,本研究初步证实了生理层流切应力可通过AQP1调节HUVECs迁移和血管生成能力,其中可能与AQP1调节eNOS Ser1177和Ser633位点的磷酸化有关。
[1]李向东, 杨跃进. 水通道蛋白1与内皮细胞功能[J]. 基础医学与临床, 2010, 30(9):995-998.
Li XD, Yang YJ. Aquaporin-1 and endothelial function[J]. Basic Clin Med, 2010, 30(9):995-998.
[2] Saadoun S, Papadopoulos MC, Hara-Chikuma M, et al. Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption[J]. Nature, 2005, 434(7034):786-792.
[3] Kaneko K, Yagui K, Tanaka A, et al. Aquaporin 1 is required for hypoxia-inducible angiogenesis in human retinal vascular endothelial cells[J]. Microvasc Res, 2008, 75(3):297-301.
[4] Hahn C, Schwartz MA. Mechanotransduction in vascular physiology and atherogenesis[J]. Nat Rev Mol Cell Biol, 2009, 10(1):53-62.
[5] Fontijn RD, Volger OL, van der Pouw-Kraan TC, et al. Expression of nitric oxide-transporting aquaporin-1 is controlled by KLF2 and marks non-activated endothelium[J]. PLoS One, 2015, 10(12):e0145777.
[6] Mun GI, Jang SI, Boo YC. Laminar shear stress induces the expression of aquaporin 1 in endothelial cells involved in wound healing[J]. Biochem Biophys Res Commun, 2013, 430(2):554-559.
[7] Yoshino D, Funamoto K, Sato K, et al. Hydrostatic pressure promotes endothelial tube formation through aquaporin 1 and Ras-ERK signaling[J]. Commun Biol, 2020, 3(1):152.
[8]张敏, 孙玉, 唐平静, 等. 切应力通过Pim1/eNOS途径调节人脐静脉内皮细胞NO分泌[J]. 中国病理生理杂志, 2020, 36(1):17-21.
Zhang M, Sun Y, Tang PJ, et al.Shear stress regulates NO production in vascular endothelial cells through Pim1/eNOS pathway[J]. Chin J Pathophysiol, 2020, 36(1):17-21.
[9] Ryu JY, Kim YH, Lee JS, et al. Oscillatory shear stress promotes angiogenic effects in arteriovenous malformations endothelial cells[J]. Mol Med, 2021, 27(1):31.
[10] Nguyen T, Toussaint J, Xue Y, et al. Aquaporin-1 facilitates pressure-driven water flow across the aortic endothelium[J]. Am J Physiol Heart Circ Physiol, 2015, 308(9):H1051-H1064.
[11] Toussaint J, Raval CB, Nguyen T, et al. Chronic hypertension increases aortic endothelial hydraulic conductivity by upregulating endothelial aquaporin-1 expression[J]. Am J Physiol Heart Circ Physiol, 2017, 313(5):H1063-H1073.
[12] 张红旭,张明昌, 陈宏. RNA干扰抑制水通道蛋白1对血管内皮细胞迁移影响的研究[J]. 中华眼科杂志, 2008, 44(8):741-744.
Zhang HX, Zhang MC, Cheng H. RNA interference targeting aquaporin-1 on inhibition of human vascular endothelial cell migration[J]. Chin J Ophthalmol, 2008, 44(8):741-744.
[13] Tanaka M, Nakamura S, Maekawa M, et al. ANKFY1 is essential for retinal endothelial cell proliferation and migration via VEGFR2/Akt/eNOS pathway[J]. Biochem Biophys Res Commun, 2020, 533(4):1406-1412.
[14] Ishii M, Nakahara T, Ikeuchi S, et al. β-Amyrin induces angiogenesis in vascular endothelial cells through the Akt/endothelial nitric oxide synthase signaling pathway[J]. Biochem Biophys Res Commun, 2015, 467(4):676-682.
[15] Madonna R, Pieragostino D, Rossi C, et al. Simulated hyperglycemia impairs insulin signaling in endothelial cells through a hyperosmolar mechanism[J]. Vascul Pharmacol, 2020, 130:106678.
[16] Garcia V,Sessa WC. Endothelial NOS: perspective and recent developments[J]. Br J Pharmacol, 2019, 176(2):189-196.
[17] 秦思, 张倩, 王敬杰, 等. 蛋白磷酸酶4在棕榈酸降低人脐静脉内皮细胞eNOS Ser633位点磷酸化中的作用[J]. 中国病理生理杂志, 2020, 36(5):803-809.
Qin S, Zhang Q, Wang JJ, et al. Roles of protein phosphatase 4 in down-regulation of eNOS Ser633 phosphorylation induced by palmitic acid in human umbilical vein endothelial cells[J]. Chin J Pathophysiol, 2020, 36(5):803-809.
Role of aquaporin 1 in shear stress-regulated endothelial cell migration and angiogenesis
ZHANG Min1,2, SUN Yu1, Du Da-peng1,2, WANG Xiao-bo1, YU Jian-xin1, WANG Han-qin1,2△
(1,,,441300,;2,,,442000,)
To investigate the role of aquaporin 1 (AQP1) in shear stress-regulated migration and angiogenesis of endothelial cells, and to explore the underlying mechanisms.The aortic arches and straight segments of thoracic aortas were obtained from C57BL/6 mice. Human umbilical vein endothelial cells (HUVECs) were isolated from fresh human umbilical cord. The parallel plate flow chamber system was used to load unidirectional laminar flow (LF, 15 dyn/cm2laminar shear stress) and disturbed flow [DF, (0.5±4) dyn/cm2oscillatory shear stress] on HUVECs. qPCR and Western blot were used to detect the expression of AQP1 at mRNA and protein levels, respectively. Silencing ofwas performed by-specific siRNA. Assays of Transwell and tube formation in Matrigel were performed to detect cell migration and angiogenesis. The protein levels of endothelial nitric oxide synthase (eNOS) and phosphorylated eNOS at Ser633 and Ser1177 were measured by Western blot.The mRNA and protein expression of AQP1 was up-regulated in the straight thoracic aorta compared with the inner of the aortic arch (<0.05). Knockdown ofin HUVECs at static condition markedly reduced cell migration and angiogenesis (<0.01). Exposure of HUVECs to LF for 8 h obviously induced AQP1 expression and promoted HUVEC migration and angiogenesis (<0.05 or<0.01). LF also significantly increased eNOS phosphorylation both at Ser1177 (<0.05) and Ser633 (<0.01). As expected,silencing abolished the above effects of LF-stimulated HUVECs (<0.05 or<0.01).G-nitro-L-arginine methyl ester (L-NAME), an eNOS inhibitor, also prevented LF-induced HUVEC migration and angiogenesis (<0.01).AQP1 plays a crucial role in the regulation of migration and angiogenesis in shear stress-stimulated endothelial cells, and its mechanism may be related to the eNOS signaling pathway.
Aquaporin 1; Shear stress; Angiogenesis; Endothelial cells; Endothelial nitric oxide synthase
R363.2; R329.2+5
A
10.3969/j.issn.1000-4718.2022.03.003
1000-4718(2022)03-0403-09
2021-09-07
2022-01-04
[基金项目]国家自然科学基金资助项目(No. 31670961);湖北医药学院研究生科技创新项目(No. YC2019038)
Tel: 0722-3252556; E-mail: hanqin.wang@hbmu.edu.cn
(责任编辑:卢萍,罗森)
