动脉内脑局部低温联合再灌注治疗急性缺血性卒中大鼠*
2022-03-28陈玥郝磊刘书翊曾育琦范勇赵振华陈骐李永坤
陈玥, 郝磊, 刘书翊, 曾育琦, 范勇, 赵振华, 陈骐, 李永坤△
动脉内脑局部低温联合再灌注治疗急性缺血性卒中大鼠*
陈玥1, 郝磊2, 刘书翊1, 曾育琦3, 范勇4, 赵振华1, 陈骐5, 李永坤1△
(1福建医科大学省立临床医学院神经内科,福建 福州 350001;2徐州医科大学附属第二医院神经内科,江苏 徐州 221006;3福建医科大学附属协和医院神经内科,福建 福州 350001;4福建医科大学附属福州市第一医院中心实验室,福建 福州 350009;5福建省师范大学生命科学院,中国南方生化研究中心,福建省天然免疫重点实验室,福建 福州 350117)
研究动脉内脑局部低温联合再灌注对急性缺血性卒中(AIS)大鼠脑组织的保护作用及其机制。将雄性SD大鼠随机分为假手术(sham)组、缺血(I,大脑中动脉永久闭塞)组、缺血再灌注(I/R,大脑中动脉闭塞后再灌注)组及低温(H,动脉内脑局部低温联合再灌注)组,每组24只。H组再灌注后经颈内动脉灌注约6.7 mL 4 ℃的生理盐水,灌注流量0.33 mL/min,灌注时间20 min。缺血24 h后对各组大鼠进行神经功能缺损评分(mNSS),2,3,5-氯化三苯基四氮唑(TTC)染色和核磁共振检测脑梗死体积,干湿重法测量脑组织含水量;通过伊文思蓝(EB)示踪法测定血脑屏障通透性,使用Western blot法检测紧密连接蛋白ZO-1、闭锁蛋白(occludin)、密封蛋白5(claudin-5)及水通道蛋白4(AQP4)和基质金属蛋白酶2和9(MMP2和MMP9)的蛋白表达水平。缺血24 h后,与I和I/R组相比,H组大鼠的mNSS、脑梗死体积、脑含水量及EB渗透量均显著降低(<0.05)。H组大鼠的ZO-1、occludin和claudin-5蛋白表达水平均显著高于I/R组(<0.05),MMP2和MMP9蛋白表达水平显著低于I/R组(<0.05)。动脉内脑局部低温联合再灌注对AIS大鼠具有脑保护作用,可能与其抑制MMP2和MMP9蛋白的表达、减少紧密连接蛋白降解、维持血脑屏障完整性有关。
急性缺血性卒中;动脉内脑局部低温;再灌注损伤;血脑屏障;紧密连接蛋白;基质金属蛋白酶
急性期开通闭塞血管,挽救缺血脑组织,已成为急性缺血性卒中(acute ischemia stroke, AIS)的标准治疗方法,但仍有近半数的患者血管再通后神经功能缺损并未改善甚至反而加重,其原因主要与缺血/再灌注(ischemia/reperfusion, I/R)损伤有关[1]。因此亟需找寻有效的脑保护策略联合再灌注治疗,在恢复脑血流灌注的同时减轻脑I/R损伤。
既往研究显示,治疗性低温可作用于I/R损伤的多个病理生理环节,如降低细胞代谢、抑制兴奋性毒性、细胞凋亡及减轻炎症等[2]。全身性低温因降温效率低且副作用多[3],限制了其临床应用[4-5]。动脉内脑局部低温(intra-arterial local brain hypothermia, IAH)可实现局部脑组织快速降温,对全身体温影响很小,减少全身性低温带来的副作用。近年来,血管内取栓技术的成熟使得IAH联合再灌注治疗成为可能[6]。既往研究通过计算机模拟、动物模型,对IAH的临床可行性和安全性进行研究,提示IAH是安全可行的[7]。
本项工作通过构建大鼠大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型,在闭塞血管再通同时采用动脉内脑局部低温治疗,研究IAH联合再灌注对AIS大鼠的脑保护作用,并探究其可能机制,为IAH联合再灌注治疗急性缺血性脑梗死的临床转化提供实验依据。
材料和方法
1 动物
无特定病原体(SPF)级的Sprague-Dawley(SD)大鼠96只,雄性,8周龄,240~265 g,由上海斯莱克实验动物有限责任公司提供,许可证号为SYXK(沪)2017-0008。所有大鼠均按照实验动物饲养规范进行饲养,饲养温度保持在(25±1 ℃)范围内,维持正常昼夜,明暗视野12 h交替(8:00开灯,20:00熄灯)。本研究经福建师范大学实验动物伦理委员会批准,对实验动物的所有操作均依据《实验动物管理与使用指南》进行。
2 主要试剂
伊文思蓝(Evans blue, EB)购于北京索莱宝科技有限公司;大鼠抗大鼠紧密连接蛋白ZO-1(zonula occludens-1)单克隆抗体和兔抗大鼠密封蛋白5(claudin-5)多克隆抗体购于Millipore;兔抗大鼠闭锁蛋白(occludin)单克隆抗体、兔抗大鼠水通道蛋白(aquaporin-4, AQP4)单克隆抗体及兔抗大鼠基质金属蛋白酶2(mtrix metalloproteinase 2, MMP2)多克隆抗体购于Abcam;羊抗大鼠基质金属蛋白酶9(matrix metalloproteinase 9, MMP9)多克隆抗体购于Santa Cruz Biotechnology;兔抗大鼠GAPDH单克隆抗体购于Cell Signaling Technology;II抗IRDye 800CW驴抗兔IgG(H+L)、IRDye 680CW驴抗羊IgG(H+L)和IRDye 680CW驴抗大鼠IgG(H+L)购于LI-COR。
3 主要实验方法
3.1动物分组、模型制备及低温干预采用随机数字表法将96只SD大鼠分为假手术(sham operation, sham)组、缺血(ischemia, I)组(大脑中动脉永久闭塞)、I/R组(大脑中动脉闭塞后再灌注)及低温(hypothermia, H)组(动脉内脑局部低温联合再灌注),每组24只。大鼠术前禁食12 h,禁水6 h,取大鼠称重,以2%戊巴比妥钠(3 mL/100 kg)腹腔注射麻醉成功后,sham组仅暴露右侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)及颈内动脉(internal carotid artery, ICA),不做其他处理;I、I/R及H组均采用改良的Longa线栓法并稍加改进制备右侧MCAO模型[8]。备皮后取仰卧位颈正中切口,暴露右侧CCA、ECA及ICA。血管夹临时夹闭CCA和ICA并结扎ECA远心端,然后于结扎处近心端剪一“V”型切口,插入线栓至颈内劲外动脉分叉处,剪断ECA远端,将ECA与CCA平行,双手持显微镊配合将线栓经ECA插入ICA,松开ICA的血管夹,继续将线栓送入约18~20 mm,有阻力感时停止推送线栓。用6-0外科手术缝合线在ECA残端打一活结,松开CCA的血管夹。I组不再取出线栓,I/R组缺血2 h后取出线栓,用电凝笔将ECA血管残端闭合,4-0外科手术缝合线逐层缝合伤口,医用酒精消毒。H组大鼠实施MCAO后腹腔注射肝素(500 U/kg)进行全身肝素化,并将微导丝、微导管消毒后备用;待缺血2 h后,静脉夹夹闭CCA,小心撤出线栓,并临时夹闭ICA;然后以0.008 in. (0.203 mm)或 0.014 in. (0.3556 mm)微导丝引导,经ECA残端将1.5 F (0.5 mm)微导管送入ICA内,松开ICA上的静脉夹,使微导管进入ICA约0.8~1.2 cm。用静脉夹夹闭ECA残端,松开CCA上的静脉夹,退出微导丝,将微导管连接微注泵,以0.33 mL/min泵入4 ℃生理盐水,持续灌注20 min。灌注期间使用动物加热垫维持大鼠体表温度恒定在(37.0±0.5) ℃。灌注结束后撤出微导管,结扎ECA残端,缝合颈部皮肤。各组大鼠待完全苏醒后将其放回饲养笼中,使其正常活动饮食。缺血24 h,I和I/R组大鼠的死亡率约为15%,H组大鼠的死亡率约为10%,实验结果已排除24 h内死亡及收集脑样本时发现蛛网膜下腔出血的大鼠。实验分组、造模及IAH流程见图1。
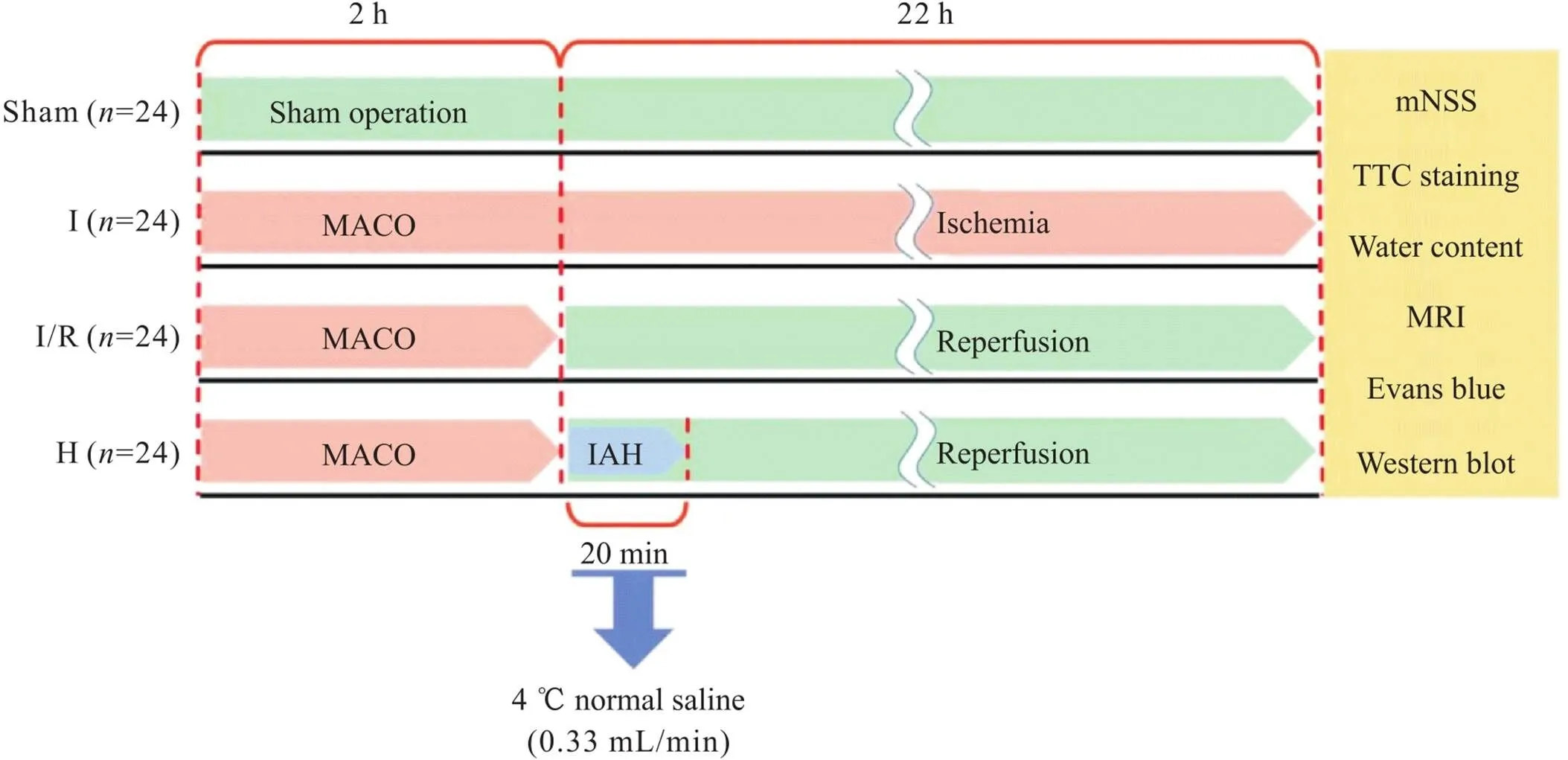
Figure 1.Flow chart of animal grouping, establishing model, and intra-arterial local brain hypothermia (IAH). Sham: sham operation group; I: ischemia group (permanent middle cerebral artery occlusion); I/R: ischemia/reperfusion group (middle cerebral artery ischemia/reperfusion); H: hypothermia group (IAH combined with reperfusion); MACO: middle cerebral artery occlusion; mNSS: modified neurological severity score; TTC: 2,3,5-triphenyltetrazolium chloride; MRI: magnetic resonance imaging.
3.2神经功能缺损评估缺血后24 h采用改良神经功能缺损评分(modified neurological severity score, mNSS)评估各组大鼠的运动、感觉、平衡和反射行为[9]。神经功能评分区间为0~18分,评分越高表示大鼠的神经功能损伤越严重。
3.3脑梗死体积测定缺血24 h后进行大鼠脑部核磁共振成像(magnetic resonance imaging, MRI)检测,采用福建中医药大学的3.0T动物线圈核磁共振检测仪对各组大鼠脑部进行影像学检测(T2和DWI序列),并比较各组脑梗死体积。大鼠做完MRI后,参照潘宋斌等[10]的方法进行2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)染色,将大鼠麻醉处死取脑,去除嗅球和小脑,清除软脑膜,将脑组织置于-80 ℃冰箱冷冻8~10 min,将脑组织冠状连续等距切取6个冠状脑片,片厚约2 mm,置于新鲜配制的0.1% TTC中染色,37 ℃孵育20 min,采用TTC染色显示梗死区域。染色期间将脑片翻转一次,正常非梗死组织被染成深红色,梗死组织未被染红呈白色。染色完成后将脑片放入4%多聚甲醛中固定,拍照后用ImageJ (National Institutes of Health)软件进行图像分析,采用简单积分法测定脑梗死体积,计算公式为:梗死体积百分比(%)=梗死面积/脑片面积×100%。
3.4脑组织含水量参照乔建新等的方法[11],缺血24 h后麻醉处死取脑,去除嗅球和小脑,清除软脑膜,用冷生理盐水冲洗脑表面,滤纸吸干水分,称取湿重,随后放入100 ℃恒温烤箱中烘烤24 h,称取干重。按照以下公式计算脑组织含水量,从而反映脑组织水肿程度:脑组织含水量(%)=(湿重-干重)/湿质量×100%。
3.5EB示踪染色将2 mg EB溶于100 mL二甲基甲酰胺中配制成母液,然后用二甲基甲酰胺将母液0.02 g/L EB稀释成不同浓度(0.4、0.8、1.6、3.2、6.4 mg/L),使用分光光度计(620 nm)测定吸光度()值,并绘制EB含量与值之间的标准曲线,得出标准曲线方程。参考陈朝晖等[12]的方法,在处死前1 h,用含2% EB的生理盐水进行静脉注射。将大鼠麻醉处死,断头取脑,去除嗅球和小脑,清除软脑膜,沿矢状缝分离大脑半球,称重后将其按照 1 mL甲酰胺溶液/100 mg脑组织的比例放入甲酰胺溶液中,60 ℃环境中浸泡24 h。取上清溶液用分光光度计(620 nm)进行值检测。并根据标准曲线方程对脑组织EB含量进行定量计算。
3.6Western blot缺血24 h后将大鼠麻醉处死取脑,用配制好的裂解液(RIPA裂解液∶蛋白酶抑制剂∶磷酸酶抑制剂=100∶1∶2)裂解脑组织,离心后取上清,BCA法进行蛋白定量,统一蛋白浓度,添加上样缓冲液后进行蛋白变性。使用SDS-PAGE,将分离好的蛋白质电转至硝酸纤维素(nitrocellulose, NC)膜上。使用5%牛血清白蛋白封闭液将NC膜封闭2 h后,在4 ℃下与以下I抗孵育过夜:ZO-1(1∶2 000)、occludin(1∶1 000)、claudin-5(1∶1 000)、AQP4(1∶1 000)、MMP2(1∶1 000)、MMP9(1∶1 000)。使用TBST洗涤3次后,Ⅱ抗(1∶15 000)室温下孵育2 h,随后TBST洗涤3次。用双色红外激光成像仪拍照,观察保存结果图片。使用ImageJ对蛋白条带的灰度值进行定量分析。
4 统计学处理
采用SPSS 21.0软件进行统计分析。符合正态分布的数据以均数±标准差(mean±SD)来表示。多组数据采用单因素方差分析,多组间的两两比较采用Tukey检验t。以<0.05为有统计学意义。
结果
1 各组大鼠神经功能测定结果
通过mNSS评分检测各组大鼠神经功能缺损程度,结果显示:与sham组相比,I组的mNSS评分显著升高(<0.01);I/R组的mNSS评分相较I组显著降低(<0.05);与I/R组相比,H组的mNSS评分显著降低(<0.05),见图2。

Figure 2.Comparison of modified neurological severity scores of rats in each group. Mean±SD. n=24. **P<0.01 vs sham group; &P<0.05 vs I group; #P<0.05 vs I/R group.
2 各组大鼠脑梗死体积及脑组织含水量测定结果
TTC染色定量分析结果显示,除sham组外其余几组均出现白色梗死区域;与sham组相比,I组的脑梗死体积显著升高(<0.01);I/R组的脑梗死体积相较I组显著升高(<0.05);与I/R组相比,H组的脑梗死体积显著下降(<0.01),见图3A。
使用干湿重量法检测各组大鼠脑组织含水量,结果显示,与sham组相比,I组的脑含水量显著升高(<0.01);I/R组的脑含水量相较I组降低,但无显著差异(>0.05);与I/R组比较,H组的脑组织含水量显著下降(<0.01),见图3B。

Figure 3.Comparison of rats brain infarction volume and brain water content in each group. A: the representative images of the infarct regions stained with TTC and comparison of cerebral infraction volume of rats in each group; C: comparison of brain water content of rats in each group. Mean±SD. n=7. **P<0.01 vs sham group; &P<0.05 vs I group; ##P<0.01 vs I/R group.
MRI结果显示,除sham组外其余几组的T2和DWI序列的影像均出现高信号区域;与sham组相比,I组在T2和DWI序列中的脑梗死体积均显著升高(<0.01);在T2序列中I/R的脑梗死体积相较I组显著升高(0.05),而在DWI序列中升高,但无显著差异(>0.05);与I组和I/R组比较,H组在T2和DWI序列中的脑梗死体积显著下降(<0.01),见图4。
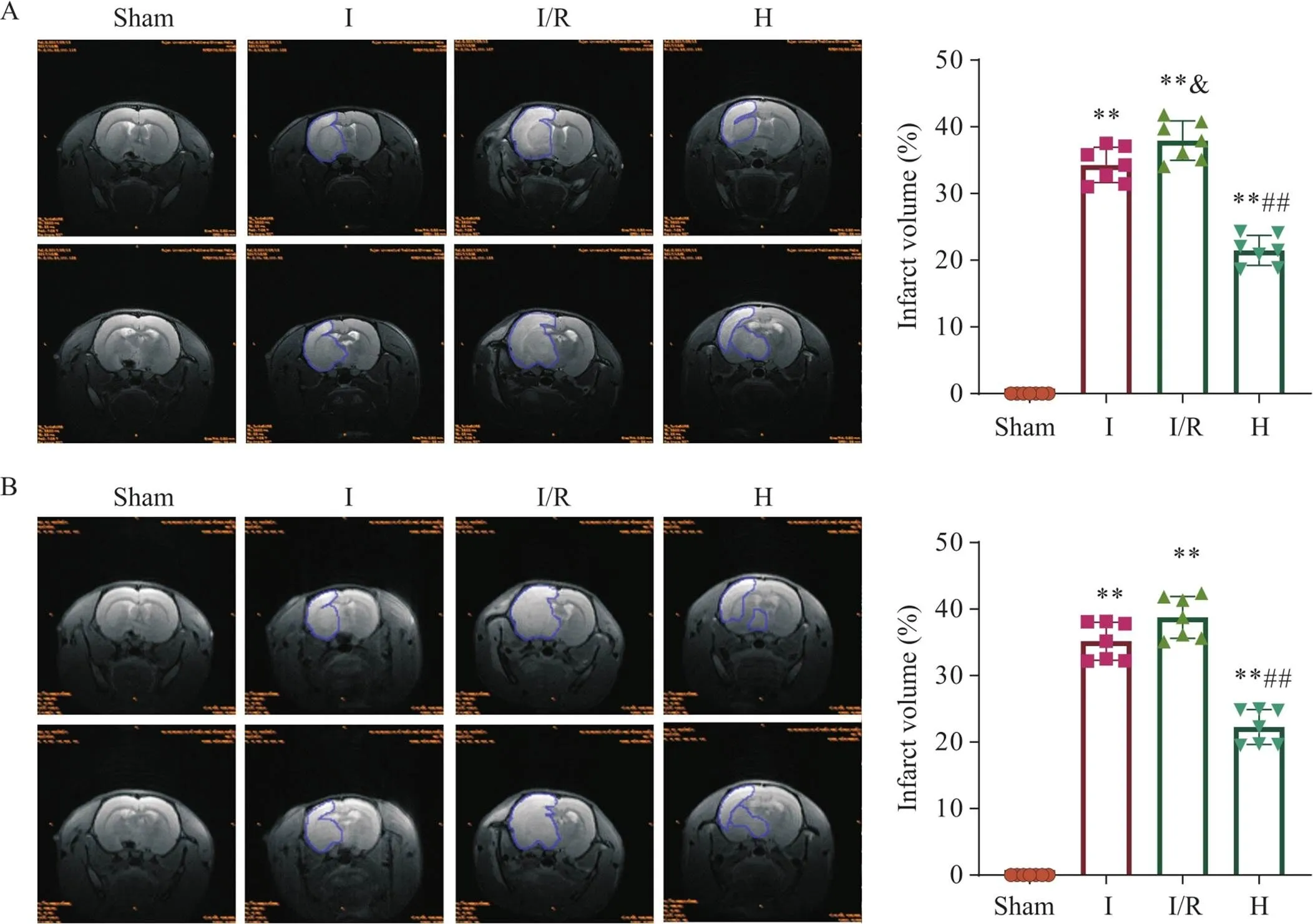
Figure 4.Brain MRI images of rats in each group. A: the representative MRI images (T2) and comparison of cerebral infraction volume of rats in each group; B: the representative MRI images (DWI) and comparison of cerebral infraction volume of rats in each group. The white high-signaling areas represent ischemic infarction in MRI images. Mean±SD. n=7. **P<0.01 vs sham group; ##P<0.01 vs I/R group.
3 各组大鼠血脑屏障通透性及血脑屏障相关结构蛋白表达检测结果
脑组织EB含量定量分析结果显示,与sham组相比,I组的脑组织EB含量显著升高(<0.01);I/R组的脑组织EB含量相较I组显著降低(<0.01);与I/R组相比,H组的EB含量显著降低(<0.01),见图5。
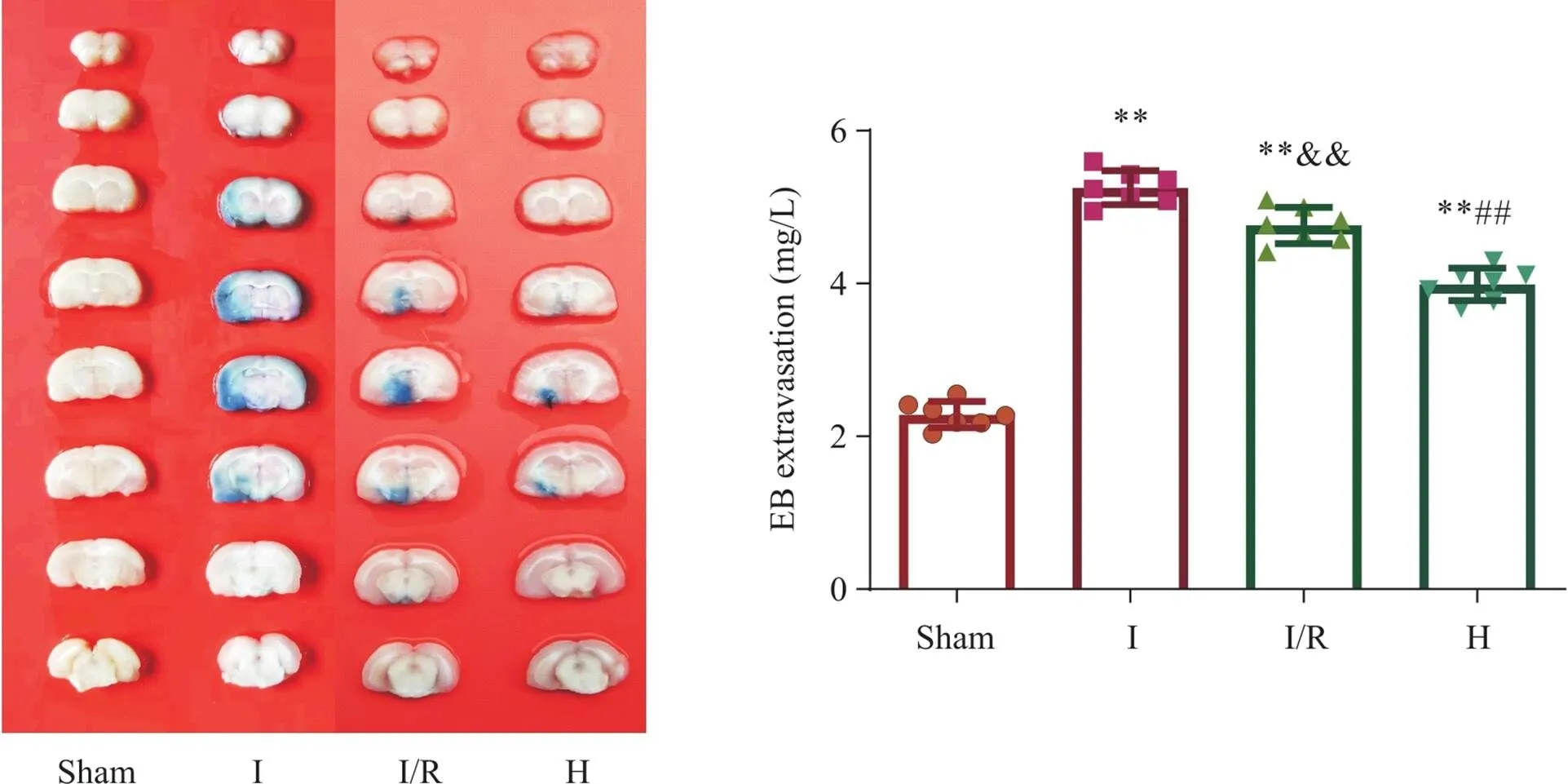
Figure 5.Comparison of BBB permeability of rats in each group. The representative images of the Evans blue extravasation in each group were shown, and comparison of Evans blue content of rats in each group were performed. Mean±SD. n=7. **P<0.01 vs sham group; &&P<0.01 vs I group; ##P<0.01 vs I/R group.
Western blot检测各组脑组织中血脑屏障相关结构蛋白表达水平,结果显示,相较sham组,I组的ZO-1、occludin和claudin-5蛋白表达均显著降低(<0.01),而AQP4蛋白表达显著升高(<0.01);相较I组,I/R组的ZO-1蛋白表达显著升高(<0.05),occludin和claudin-5蛋白表达升高,但无显著差异(>0.05),而AQP4蛋白表达显著下降(<0.05);与I/R组相比,H组的ZO-1、occludin和claudin-5蛋白表达均显著升高(<0.05或<0.01),AQP4蛋白表达呈下降趋势,但无显著差异(0.05),见图6。

Figure 6.The protein expression levels of ZO-1, occludin, claudin-5 and AQP4 in brain tissue of rats in each group were detected by Western blot. Mean±SD. n=3. **P<0.01 vs sham group; &P<0.05 vs I group; #P<0.05, ##P<0.01 vs I/R group.
4 各组大鼠脑组织MMP2和MMP9蛋白表达检测结果
Western blot检测各组脑组织中MMP2和MMP9蛋白的表达水平,结果显示,与sham组相比,I组MMP-2和MMP-9蛋白表达水平均显著升高(<0.01);相较I组,I/R组MMP2蛋白表达显著降低(<0.01),而MMP9蛋白表达降低,但无显著差异(0.05);与I/R组相比,H组MMP2和MMP9蛋白表达均显著降低(<0.05),见图7。

Figure 7.The protein expression levels of MMP2 and MMP9 in brain tissue of rats in each group were detected by Western blot. Mean±SD. n=3. **P<0.01 vs sham group; &&P<0.01 vs I group; #P<0.05 vs I/R group.
讨论
AIS的治疗原则是尽早开通闭塞血管,挽救缺血脑组织;但血管再通后会出现I/R损伤,造成继发性脑损伤。因此,AIS患者亟需可联合再灌注的神经保护方法,减轻I/R损伤。治疗性低温是有效的脑保护策略,而相比于其它低温方式,IAH是一种可高效降低脑局部温度的方式,它的降温速度更快且更具有安全性、有效性[13]。Omileke等[14]和Kurisu等[15]的研究表明,相较于全身低温灌注,大鼠缺血脑组织进行局部低温灌注可有效减小梗死体积、脑水肿程度及改善神经功能。本研究探索了IAH联合再灌注(下文简称联合治疗)对AIS大鼠的保护作用及其机制。实验结果显示,联合治疗可改善AIS大鼠的神经功能,减少脑梗死体积,减轻脑水肿程度,其作用可能与减少MMP2和MMP9蛋白的表达、减少紧密连接蛋白的降解,维持BBB完整性有关。
AIS大鼠在经历再灌注过程中,可触发有害的病理生理过程,即I/R损伤,并抵消再灌注的有益作用。Aronowski等[16]的研究显示,相较于脑局部缺血24h的大鼠,缺血2h再灌注22h的大鼠脑梗死体积增加。本实验结果显示,AIS大鼠血管再通可有效改善AIS大鼠的神经功能,但却无法减少脑梗死体积及脑含水量;因此,单一再灌注可能不是AIS大鼠脑保护的优选方案,仍需寻找联合再灌注的神经保护方案,减轻I/R损伤。
既往IAH相关研究虽然已证明具有脑保护作用,但研究选用的灌注条件多数是根据经验设置[7]。然而,IAH对AIS的脑保护作用效果,取决于降温速度、降温程度和持续时间[2-3, 17]。本课题组的前期使用正交实验设计研究MCAO大鼠的IAH最佳灌注温度、速度和持续时间,结果显示最佳灌注条件为:4 ℃生理盐水,0.33 mL/min,20 min;该灌注条件可使脑局部组织温度可在数分钟内降至35 ℃以下,并维持亚低温状态15 min左右,且对全身核心体温并无显著影响(结果尚未发表)。因此,本研究选用的IAH方法可安全、快速、有效降温。缺血再灌注早期是脑组织发生缺血再灌注损害的关键时期;联合治疗可在再灌注早期快速降低局部脑组织的温度,不仅可以冲刷炎症因子等有害分子,还能有效阻断级联损伤网络的多种机制,如降低细胞代谢、抑制损伤蛋白合成,减少自由基产生等[18]。因此,脑组织局部低温时间虽然短暂,但理论上可能具有很好的脑保护作用。本研究显示较于单一的再灌注,联合治疗可有效改善AIS大鼠的神经功能缺损、脑梗死体积和脑水肿程度。
BBB主要由微血管内皮细胞及细胞连接构成[19],是可阻止物质自由进出脑组织的屏障结构,而I/R损伤可对血脑屏障的完整性进行破坏[20];本实验结果显示,联合治疗相较于单一的再灌注治疗,可有效维持BBB结构完整性。
紧密连接蛋白,如occludin、claudin-5和ZO-1蛋白是血脑屏障功能破坏的敏感指标。Nitta等[21]的研究表明,敲除小鼠的基因,血脑屏障的分子大小选择功能会受到影响;Yan等[22]报道,降低ZO-1蛋白的表达水平可增加内皮细胞的渗透性。实验结果表明,联合治疗可维持血脑屏障的完整性,而其原因可能是由于IAH可有效抑制occludin、claudin-5和 ZO-1蛋白的降解。Li等[23]的相关研究同样证实了治疗性低温对紧连接蛋白的维持作用。此外,有研究表明I/R损伤引起的细胞毒性水肿与AQP4蛋白的表达上调有关[24],敲除基因可减轻脑水肿程度[25]。本研究结果显示,与单纯再灌注治疗相比,联合治疗不能有效抑制AQP4蛋白的表达,因而IAH可能不是通过调节AQP4蛋白减轻脑水肿程度。
MMP2和MMP9蛋白属于基质金属蛋白酶家族,它们在BBB破坏中发挥着重要的作用[26]。Xin等[27]的研究表明,在大鼠脑缺血再灌注模型中抑制MMP2/9蛋白的表达可减少claudin-5和occludin蛋白的降解,从而减少血脑屏障通透性;我们实验表明,联合治疗可有效抑制MMP2和MMP9蛋白的表达,与Hamann等[28]的大鼠脑缺血再灌注的低温研究结论一致,提示联合治疗可能通过抑制MMP9及MMP2蛋白的表达发挥对血脑屏障的保护作用。
综上所述,在大鼠MACO模型中,相较于单一再灌注,IAH联合再灌注治疗可有效减轻AIS大鼠的脑损伤,减轻脑水肿,改善神经功能,减少脑梗死体积,其机制可能与抑制MMP2、MMP9蛋白的表达,减少紧密连接蛋白降解,维持血脑屏障完整性有关。本研究结果可为IAH联合再灌注治疗AIS大鼠的研究提供安全、可行的具体操作方法,对于IAH的临床转化和实践具有一定参考意义。
[1] Chamorro Á, Lo EH, Renú A, et al. The future of neuroprotection in stroke[J]. J Neurol Neurosurg Psychiatry, 2021, 92(2):129-135.
[2] Yenari MA, Han HS. Neuroprotective mechanisms of hypothermia in brain ischaemia[J].Nat Rev Neurosci, 2012, 13(4):267-278.
[3] Cattaneo G, Meckel S. Review of selective brain hypothermia in acute ischemic stroke therapy using an intracarotid, closed-loop cooling catheter[J]. Brain Circ, 2019, 5(4):211-217.
[4] Connolly JE, Boyd RJ, Calvin JW. The protective effect of hypothermia in cerebral ischemia: experimental and clinical application by selective brain cooling in the human[J]. Surgery, 1962, 52:15-24.
[5] Zhang JN, Wood J, Bergeron AL, et al. Effects of low temperature on shear-induced platelet aggregation and activation[J]. J Trauma, 2004, 57(2):216-223.
[6] Ma LL, Song L, Yu XD, et al. The clinical study on the treatment for acute cerebral infarction by intra-arterial thrombolysis combined with mild hypothermia[J]. Eur Rev Med Pharmacol Sci, 2017, 21(8):1999-2006.
[7] Esposito E, Ebner M, Ziemann U, et al. In cold blood: intraarteral cold infusions for selective brain cooling in stroke[J]. J Cereb Blood Flow Metab, 2014, 34(5):743-752.
[8] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[9] Chen J, Sanberg PR, Li Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11):2682-2688.
[10]潘宋斌, 万琳, 邵卫, 等. 黄角颗粒对脑缺血再灌注损伤大鼠JAK2/STAT3信号通路的影响[J]. 中国病理生理杂志, 2018, 34(9):1715-1719.
Pan SB, Wan L, Shao W, et al. Effect of Huangjiao granule on JAK2/STAT3 signaling pathway in rats with cerebral ischemia/reperfusion injury[J]. Chin J Pathophysiol, 2018, 34(9):1715-1719.
[11]乔建新, 刘熙鹏, 刘明, 等. 甲磺酸加贝酯对脑缺血再灌注大鼠血脑屏障保护作用的研究[J]. 中国病理生理杂志, 2020, 36(12):2190-2197.
Qiao JX, Liu XP, Liu M, et al. Protective effect of gabexatemesilate on blood-brain barrier in rats with cerebral ischemia-reperfusion[J]. Chin J Pathophysiol, 2020, 36(12):2190-2197.
[12] 陈朝晖, 洪溪屏, 兰频, 等. TTP减轻大鼠蛛网膜下腔出血后早期脑损伤[J]. 中国病理生理杂志, 2018, 34(2): 287-293.
Chen CH, Hong XP, Lan P, et al. Tristetraprolin attenuates subarachnoid hemorrhage-induced early braininjury in rats[J]. Chin J Pathophysiol, 2018, 34(2):287-293.
[13] Sun H, Tang Y, Guan X, et al. Effects of selective hypothermia on blood-brain barrier integrity and tight junction protein expression levels after intracerebral hemorrhage in rats[J]. Biol Chem, 2013, 394(10):1317-1324.
[14] Omileke D, Azarpeykan S, Bothwell S W, et al. Short-duration hypothermia completed prior to reperfusion prevents intracranial pressure elevation following ischaemic stroke in rats[J]. Sci Rep, 2021, 11(1):22354.
[15] Kurisu K, Abumiya T, Ito M, et al. Transarterial regional hypothermia provides robust neuroprotection in a rat model of permanent middle cerebral artery occlusion with transient collateral hypoperfusion[J]. Brain Res, 2016, 1651: 95-103.
[16] Aronowski J, Strong R, Grotta JC. Reperfusion injury: demonstration of brain damage produced by reperfusion after transient focal ischemia in rats[J]. J Cereb Blood Flow Metab, 1997, 17(10):1048-1056.
[17] Omileke D, Pepperall D, Bothwell S W, et al. Ultra-short duration hypothermia prevents intracranial pressure elevation following ischaemic stroke in rats[J]. Front Neurol, 2021, 12:684353.
[18] Ding Y, Li J, Rafols JA, et al. Prereperfusion saline infusion into ischemic territory reduces inflammatory injury after transient middle cerebral artery occlusion in rats[J]. Stroke, 2002, 33(10):2492-2498.
[19] Zhao Z, Nelson AR, Betsholtz C, et al. Establishment and dysfunction of the blood-brain barrier[J]. Cell, 2015, 163(5):1064-1078.
[20] Khatri R, Mckinney AM, Swenson B, et al. Blood-brain barrier, reperfusion injury, and hemorrhagic transformation in acute ischemic stroke[J]. Neurology, 2012, 79(13 Suppl 1):S52-S57.
[21] Nitta T, Hata M, Gotoh S, et al. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice[J]. J Cell Biol, 2003, 161(3):653-660.
[22] Yan J, Zhang Z, Shi H. HIF-1 is involved in high glucose-induced paracellular permeability of brain endothelial cells[J]. Cell Mol Life Sci, 2012, 69(1):115-128.
[23] Li J, Li C, Yuan W, et al. Mild hypothermia alleviates brain oedema and blood-brain barrier disruption by attenuating tight junction and adherens junction breakdown in a swine model of cardiopulmonary resuscitation[J]. PLoS One, 2017, 12(3):e0174596.
[24] Taya K, Marmarou CR, Okuno K, et al. Effect of secondary insults upon aquaporin-4 water channels following experimental cortical contusion in rats[J]. J Neurotrauma, 2010, 27(1):229-239.
[25] Manley GT, Fujimura M, Ma T, et al. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke[J]. Nat Med, 2000, 6(2):159-163.
[26] Guilfoyle MR, Carpenter KL, Helmy A, et al. Matrix metalloproteinase expression in contusionaltraumatic brain injury: apairedmicrodialysisstudy[J]. J Neurotrauma, 2015, 32(20):1553-1559.
[27] Xin H, Liang W, Mang J, et al. Relationship of gelatinases-tight junction proteins and blood-brain barrier permeability in the early stage of cerebral ischemia and reperfusion[J]. Neural Regen Res, 2012, 7(31):2405-2412.
[28] Hamann GF, Burggraf D, Martens HK, et al. Mild to moderate hypothermia prevents microvascular basal lamina antigen loss in experimental focal cerebral ischemia[J]. Stroke, 2004, 35(3):764-769.
Effects of intra-arterial local brain hypothermia combined with reperfusion on acute ischemic stroke rats
CHEN Yue1, HAO Lei2, LIU Shu-yi1, ZENG Yu-qi3, FAN Yong4, ZHAO Zhen-hua1, CHEN Qi5, LI Yong-kun1△
(1,,,350001,;2,,221006,;3,,350001,;4,,350009,;5,,,,350117,)
To explore the effect of intra-arterial local brain hypothermia combined with reperfusion on acute ischemic stroke (AIS) rats and its mechanisms.The male SD rats were randomly divided into 4 groups: sham operation (sham) group, ischemia (I, permanent middle cerebral artery occlusion) group, middle cerebral arterial ischemia/reperfusion (I/R) group and hypothermia (H, intra-arterial local brain hypothermia combined with reperfusion) group, with 24 rats in each group. After reperfusion, the rats in H group was infused with 6.7 mL of normal saline (4 ℃, 0.33 mL/min) via internal carotid artery for 20 min. Neurological deficits were evaluated by the modified neurological severity score (mNSS) 24 h after ischemia, brain infarction volume was measured by 2,3,5-triphenyltetrazolium chloride (TTC) staining and magnetic resonance imaging, and brain water content was measured by dry and wet weight method. The integrity of the blood-brain barrier was evaluated by detecting the Evans blue (EB) leakage rate. The protein levels of zonula occludens-1 (ZO-1), occludin, claudin-5, aquaporin-4 and matrix metalloproteinase-2/9 (MMP2 and MMP9) were detected by Western blot.Compared with I and I/R groups, the mNSS, cerebral infarct volume, cerebral water content and EB leakage volume in H group were significantly decreased 24 h after ischemia (<0.05). The expression levels of ZO-1, occludin and claudin5 in H group were significantly higher than those in I/R group (<0.05), while the expression levels of MMP2 and MMP9 were significantly lower than those in I/R group (<0.05).Intra-arterial local brain hypothermia combined with reperfusion can protect the brain of AIS rats, which may be related to the inhibition of the expression of MMP2 and MMP9 proteins as well as decreased degradation of tight junction proteins.
Acute ischemic stroke; Intra-arterial local brain hypothermia; Reperfusion injury; Blood-brain barrier; Tight junction proteins; Matrix metalloproteinases
R743.3; R363.2
A
10.3969/j.issn.1000-4718.2022.03.009
1000-4718(2022)03-0448-09
2021-12-09
2022-02-05
[基金项目]国家自然科学基金资助项目(No. 81670455);福建省科技创新联合基金重点项目(No. 2019Y9024);福建省自然科学基金资助项目(No. 2020J011060)
Tel: 13599081830; E-mail: liyongkun721@139.com
(责任编辑:林白霜,罗森)
