miRNA-125a-5p对胰腺癌皮下移植瘤细胞Caspase-8表达的影响*
2022-03-28
(右江民族医学院附属医院消化内科,广西 百色 533000)
胰腺癌恶性程度高,死亡率呈逐年上升趋势,在癌症总死亡率中占比高达8%[1]。寻找胰腺癌诊治的新靶点,将可能为患者的诊治提供新思路。近年研究发现miRNA-125a-5p 通过靶向TP53[2]、CD147[3]、BRMS1[4]、STAT3[5]、BAP1[6]、TAZ[7]等因子,调控肿瘤细胞增殖凋亡及侵袭迁移等过程。目前miRNA与胰腺癌的关系已经成为各学者研究的热点之一。据文献报道,miRNA-125a-5p在胰腺癌外周血、组织及细胞系中高表达[8-9],与胰腺癌关系密切。本研究通过构建miRNA-125a-5p过表达和低表达稳定转染胰腺癌细胞株,并建立胰腺癌皮下移植瘤模型,检测Caspase-8表达情况,分析miRNA-125a-5p与胰腺癌皮下移植瘤细胞凋亡的关系。
1 材料与方法
1.1材料 SPF级BALB/C雄性裸鼠18只,体重18~22 g,4~6周龄,购于浙江维通利华实验动物技术有限公司,生产许可证号:SCXK(浙)2019-0001。胎牛血清购于Gibco公司。人胰腺癌PANC-1细胞购于中国科学院典型培养物保藏委员会细胞库。上海吉凯基因医学科技股份有限公司,构建miRNA-125a-5p过表达及miRNA-125a-5p低表达慢病毒载体,并完成包装、滴度的测定(载体类型:GV慢病毒载体系列,荧光标记:EGFP)。G418(遗传霉素)购于上海吉凯基因医学科技股份有限公司。PCR引物合成(上海生工生物工程有限公司),逆转录试剂盒购于生工生物工程(上海)股份有限公司(B532451),SYBR试剂盒购于上海翊圣生物科技有限公司(11201ES03)。兔单克隆Caspase-8一抗购于Abcam公司。
1.2细胞培养及转染 PANC-1细胞在37 ℃、5%CO2条件下培养,使用10%胎牛血清的DMEM高糖培养基。将PANC-1细胞接种于6孔板,当细胞生长至50%~60%融合度时,将miRNA-125a-5p过表达及低表达慢病毒加入孔板中进行转染,转染12 h更换新鲜培养基,24 h后开始表达红色荧光,72 h荧光表达最强,在荧光显微镜下观察慢病毒转染效率,最后用遗传霉素进行稳定转染细胞株的筛选。
1.3裸鼠皮下移植瘤模型的建立 接种细胞前,在右前肢腋窝靠近背部皮下进行消毒处理,将1×107个细胞溶于0.2 ml生理盐水中,用注射器抽取细胞悬液接种于皮下,分别接种miRNA-125a-5p过表达稳转株细胞、miRNA-125a-5p低表达稳转株细胞及PANC-1细胞。观察成瘤情况,4周后处死裸鼠,取出肿瘤后立即放置液氮中,随后放入-80 ℃保存。
1.4RT-qPCR验证miRNA-125a-5p转染效果及胰腺癌皮下移植瘤Caspase-8表达水平 用Trizol提取组织总RNA后,无酶水溶解,经紫外分光光度计检测浓度和纯度。取适量RNA按照逆转录试剂盒获得cDNA,以β-actin、U6作为内参。miRNA-125a-5p引物序列:上游5′-CGTCCCTGAGACCCTTT-3′,下游5′-CGCTTCACGAATTTGCGTGTCAT-3′。U6引序物列:上游5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游5′-CGCTTCACGAATTTGCGTGTCAT-3′。Caspase-8 引物序列:上游5′-CAATCTCCACAAGTTGCTCA-3′,下游5′-GGGATAGATAATTTAGGAGTGGG-3′。Β-actin 引物序列:上游5′-GTGGACATCCGCAAAGAC-3′,下游5′-ATCAA-CGCAATGTGGGAAA-3′。应用SYBR Green PCR试剂盒进行扩增,反应体系为:cDNA 2 μl,上游引物0.4 μl,下游引物 0.4 μl,SYBR Green PCR Master Mix 10 μl,加ddH2O至20 μl,所有样品均为3个复孔,在PCR扩增仪上完成,记录循环阈值,采用2-△△Ct方法,算出目的基因miRNA-125a-5p、Caspase-8 mRNA的相对表达量。
1.5Western Blot检测Caspase-8蛋白表达 在研磨碗中加入裂解液充分裂解肿瘤组织,提取总蛋白,应用BCA法检测蛋白浓度,并计算上样量;10%凝胶电泳,采用PVDF膜转膜;封闭1h;加入Caspase-8一抗,4 ℃孵育过夜;第2天加入二抗,室温孵育2 h;TBST漂洗3次;显影,保存条带图片。使用Image J软件分析各条带灰度值,计算各蛋白表达量(目的蛋白条带吸光度值/内参照条带吸光度值),实验重复3次取均值。
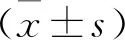
2 结果
2.1慢病毒转染情况 培养PANC-1细胞至融合度为50%左右,开始慢病毒转染,转染条件为MOI=10时,转染24 h后,红色荧光开始表达,72 h红色荧光表达最强,荧光显微镜下拍照,细胞表达较强的红色荧光,细胞生长情况良好,见图1。
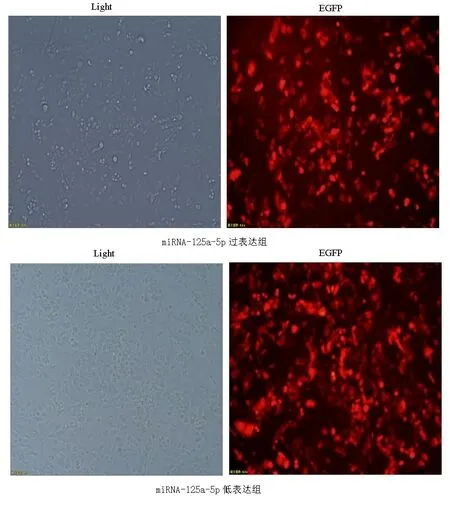
图1 miRNA-125a-5p过表达、低表达慢病毒
2.2miRNA-125a-5p在PANC-1稳定转染细胞株中的表达 与对照组对比,miRNA-125a-5p过表达组miRNA-125a-5p mRNA表达升高(P<0.01),miRNA-125a-5p低表达组miRNA-125a-5p mRNA表达降低(P<0.05),见图2。
2.3胰腺癌皮下移植瘤Caspase-8 mRNA相对表达量 与对照组对比,miRNA-125a-5p过表达组Caspase-8 mRNA表达升高(P<0.01),miRNA-125a-5p低表达组Caspase-8 mRNA表达降低(P<0.01),见图3。
2.4Western Blot 检测Caspase-8在胰腺癌皮下移植瘤中的表达 凋亡相关因子Caspase-8在胰腺癌皮下移植瘤中的表达如图4所示。与对照组对比,miRNA-125a-5p过表达组Caspase-8蛋白表达量升高(P<0.05),miRNA-125a-5p低表达组Caspase-8 蛋白表达量降低(P<0.01),差异均有统计学意义。

与对照组对比,*为P<0.01,△为P<0.05。
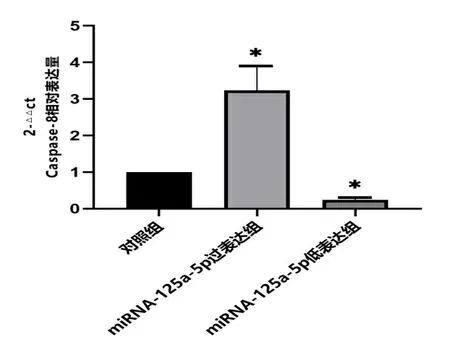
与对照组对比,*为P<0.01。

与对照组比较,△为P<0.05,*为P<0.01。
3 讨论
胰腺癌在临床上以恶性程度高、预后差为主要特点,目前胰腺癌的相关分子机制仍未完全明确。多项研究指出,细胞凋亡在胰腺癌的发生发展中发挥重要作用。
细胞凋亡是一种由基因编码的程序性细胞死亡,也是维持组织稳态的关键,它破坏了细胞增殖和细胞死亡的平衡,被广泛认为与肿瘤的发生发展过程密切相关[10]。Caspases为含有半胱氨酸残基的一类蛋白酶,是凋亡细胞死亡的主要介质,以酶原形式存在胞质中,按照执行功能分为始动因子、效应子及炎症介导因子,凋亡始动因子被凋亡信号激活后引发凋亡系列级联反应。死亡受体途径是细胞凋亡的主要途径之一,死亡受体(肿瘤坏死因子)与其环羧酸配体连接刺激受体聚集,其中死亡结构域蛋白(FADD)与procaspase-8结合,形成死亡诱导信号复合物(DISC),最终引起Caspase-8酶原的激活,完成了细胞凋亡程序的启动[11-13]。因此,Caspase-8作为细胞死亡信号诱导复合体中不可或缺的一员,参与细胞凋亡的主要过程。有研究证实,在胰腺癌中Caspase-8表达水平的改变可以导致效应Caspase-3的激活失调,最终干扰癌细胞凋亡[14];Carmona S等[15]证实,NV669主要通过激活Caspase-8来诱导胰腺癌细胞凋亡;吴茱萸碱可激活Caspase-8,并活化其下游的Caspase-3,从而促进胰腺癌细胞的凋亡[16]。因此,凋亡相关因子Caspase-8 的激活在胰腺癌细胞凋亡中发挥重要作用。本实验研究则是通过检测Caspase-8的表达水平,从而来验证细胞凋亡的情况。
近年研究发现,miRNA-125a-5p通过调控肿瘤细胞的凋亡,在肿瘤中发挥抑癌基因的作用。miRNA-125a-5p在肝癌细胞中表达下降,可能通过靶向TP53促进肝癌细胞凋亡并抑制其增殖,因此,miRNA-125a-5p可能是治疗肝癌的一个新的潜在治疗靶点[17];miRNA-125a-5p也可以通过靶向EGFR-TKI介导肺癌细胞凋亡,增强肺癌细胞对厄洛替尼的敏感性,提高肺癌患者的治疗效果[18];也有文献报道[19],过表达miRNA-125a-5p可以抑制肝癌细胞增殖,诱导细胞凋亡,miRNA-125a-5p可能是治疗肝癌患者的潜在靶点。目前miRNA-125a-5p在胰腺癌中是否起到促进凋亡的作用尚不清楚,为明确miRNA-125a-5p能否调控胰腺癌细胞凋亡,本研究筛选出miRNA-125a-5p过表达及低表达稳转株细胞,在体内实验中构建胰腺癌皮下移植瘤模型,通过检测Caspase-8的表达水平,对细胞凋亡水平进行验证。实验结果提示,Caspase-8在miRNA-125a-5p过表达组中表达量升高,相反的,在miRNA-125a-5p低表达组中表达量降低。
综上所述,我们的研究结果提示,miRNA-125a-5p在胰腺癌皮下移植瘤中促进Caspase-8表达,促进细胞凋亡,发挥抑瘤作用。这表明了miRNA-125a-5p可能是胰腺癌的一个潜在治疗靶点,过表达miRNA-125a-5p促进胰腺癌细胞凋亡,从而提高胰腺癌患者的疗效。但miRNA-125a-5p促进胰腺癌细胞凋亡的具体分子机制有待未来进一步研究探讨。
