基于数据非依赖性采集质谱技术对注射用曲妥珠单抗及其类似药结构的表征及相似性研究*
2022-03-28李克李恒周琴
李克,李恒,周琴
(1.武汉药品医疗器械检验所药物制剂质量研究与控制重点实验室,武汉 430075;2.江汉大学附属湖北省第三人民医院药学部,武汉 430033)
抗体药物发展历史仅有三十多年,近5年来开始进入爆发阶段。仅2020年,美国食品药品管理局(FDA)批准抗体药物12个;中国国家药品监督管理局批准上市抗体药物25个,包括国产品种7个,进口品种18个,获批的国产抗体药物以生物类似药为主[1]。类似药的开发可极大缩短企业研发产品的时间和降低费用,降低相关药品价格,使患者受益。与小分子药物相比,抗体药物的相对分子质量(Mr)大,结构复杂且不均一,开发难度和技术要求较高,因此,生物类似药如何在结构和功能上尽可能与原研药相似,包括确认蛋白质药物一级结构的氨基酸序列、二硫键、翻译后修饰(PTMs)以及不同批次间比较性研究的数据等[3-4],对生物制药行业是一个巨大的挑战。
数据非依赖性采集(data-independent acquisition,DIA)技术是近几年新出现的蛋白组学非标记定量技术。不同于传统的需要选择特定母离子进行碎裂的数据依赖采集(data dependent acquisition,DDA)技术,DIA可采集所有的碎片离子信息,从而具有全景式扫描、数据可回溯等优势[3]。得益于数据分析和质谱采集速度、质量精度和分辨率的显著进步,近几年来DIA技术发展迅速。高质量的DIA定量技术作为蛋白质组定量新技术将会被逐渐推广并应用于抗体药物结构表征的研究中。笔者在本研究应用DIA的液相色谱-串联质谱联用(DIA LC-MS/MS)[5]技术对注射用曲妥珠单抗(赫赛汀)生物类似药进行结构表征,并与原研药进行相似性比较,证明赫赛汀生物类似药与原研药相似,DIA质谱技术可用于抗体药物的结构表征。
1 材料与方法
1.1仪器 ACQUITY UPLC超高效液相色谱系统,Xevo G2 QTof MS串联四极杆飞行时间质谱系统,控制仪器和采集数据的MassLynx 4.1软件,处理数据的UNIFI 1.8软件(包含UNIFI Workstation Large Molecule Option及UNIFI Glycan Library),均为美国Waters公司产品。
1.2试药 赫赛汀(上海罗氏制药有限公司,批号:S20170008),赫赛汀生物类似药(武汉友芝友生物制药有限公司提供)。盐酸胍[西格玛奥德里奇(上海)贸易有限公司,批号:V900385]、碘乙酰胺[西格玛奥德里奇(上海)贸易有限公司,批号:16125-5g]、胰蛋白酶[普洛麦格(北京)生物技术有限公司,批号:V511A]、二硫苏糖醇[伯乐生命医学产品(上海)有限公司,含量>99%,批号:161-0610]、碳酸氢铵(霍尼韦尔国际公司,含量>99%,批号:09830-5009)、甲酸(百灵威科技有限公司,含量98%,批号:942988)、乙腈[默克化工技术(上海)有限公司,含量>99.9%,批号:75-05-8]。 用于流动相及样品制备的去离子水均通过默克密理博Milli-Q水系统制备而得。
1.3抗体完整蛋白的分析
1.3.1样品处理 取抗体溶液(5 mg·mL-1)100 μL,加入超纯水稀释至1 mg·mL-1;进行离心(4000 r·min-1,r=32 mm,1 min),取上清液,加入到内插管,准备进仪器检测。
1.3.2色谱条件(UPLC) 色谱柱为MassPREP在线脱盐小柱;流动相:A:0.1%甲酸水溶液,B:0.1%甲酸乙腈溶液;洗脱程序:流速:0.2 mL·min-1,洗脱梯度(体积比95→30:5→70);柱温:65 ℃;进样量:5 μL。
1.3.3质谱条件 正离子模式,脱溶剂气体温度400 ℃,源温度100 ℃,脱溶剂气流速600 L·h-1,毛细管电压3 kV,锥孔电压40 V,数据采集范围:500~5000 Da。
1.4抗体轻链与重链的分析 取抗体溶液(5 mg·mL-1)20 μL,加入水稀释至100 μL,加二硫苏糖醇(DTT)溶液8 μL,50 ℃金属浴30 min,放冷至室温。加入0.5 mL 10K超滤管中,离心(13 000 r·min-1,r=32 mm,10 min)。取下层液,进行离心(4000 r·min-1,r=32 mm,1 min),取上清液,加入到内插管,准备进仪器检测。
1.4.1色谱条件(UPLC) 色谱柱为MassPREP在线脱盐小柱;流动相:A:0.1%甲酸水溶液,B:0.1%甲酸乙腈溶液;洗脱程序:流速:0.2 mL·min-1,洗脱梯度(体积比95→5:5→95);柱温:65 ℃;进样量:5 μL。
1.4.2质谱条件 正离子模式,脱溶剂气体温度400 ℃,源温度100 ℃,脱溶剂气流速600 L·h-1,毛细管电压3 kV,锥孔电压40 V,数据采集范围:500~5000 Da。
1.5抗体肽图分析
1.5.1样品处理 取抗体溶液100 μL,加入盐酸胍溶液250 μL,加二硫苏糖醇(DTT)溶液8 μL,37 ℃金属浴1 h。取出样品,加碘乙酰胺溶液17 μL,室温避光放置30 min。加入0.5 mL 10K超滤管中,离心(13 000 r·min-1,r=32 mm,10 min)。离心后弃去下层滤液,向上层管加入酶切缓冲溶液(碳酸氢铵25 mM)0.4 mL,再次离心(13 000 r·min-1,r=32 mm,10 min)。重复上步操作,离心时间改为5 min。离心后,将上层管中的浓缩液转移至1.5 mLEP管中。加入活化后的胰蛋白酶溶液(Trypsin酶切位点:K赖氨酸、R精氨酸羧基端)100 μL,涡旋混匀,37℃金属浴孵化过夜(16~18 h)。取出样品,加入10%甲酸溶液10 μL。对酶解后的样品进行离心(4000 r·min-1,1 min),取上清液,加入到内插管,准备进仪器检测。
1.5.2色谱条件(UPLC) 色谱柱为 ACQUITYUPIC BEH 130 C18(150 mm×2.1 mm,17 μm);流动相:A:0.1%甲酸水溶液;B:0.1%甲酸乙腈溶液;洗脱程序:流速:0.3 mL·min-1,洗脱梯度(体积比95→30:5→70);柱温:65 ℃;进样量:5 μL。
1.5.3质谱条件 与“1.3.3”项相同。
①DIA扫描参数及校正设置,通过质谱碰撞池内等频率交替进行低碰撞能量(6 V)和高碰撞能量(20~30 V)切换,分别获得各个肽段母离子一级质谱数据及其二级碎片数据;校正设置:用嵌入式辅助泵持续注射1 g·L-1亮氨酸脑啡肽溶液(溶于50%乙腈水溶液,添加0.1%甲酸),流速0.2 mL·min-1,用于获得Lock-mass参比质量信号,对所测得的质量数进行实时校正。
②UNIFI软件参数的设置,选择胰蛋白酶(Trypsin)完全裂解作为确定抗体药物一级序列的软件参数,肽段漏切(Miss cleavages)设为1,不考虑非特异性酶切对序列覆盖率的贡献。赖氨酸末端缺失(M-128.09)、半胱氨酸脲甲基化(Mr+57.00)、N-去酰胺化(天冬氨酸和异天冬氨酸产物,Mr+0.98),M-氧化(Mr+15.99)和已知的存在于抗体药物中的寡糖选为可变修饰。母离子和碎片离子的质量偏差均设为3/100 000。
2 结果
2.1抗体完整蛋白的分析 赫赛汀单抗包含2条轻链和2条重链,轻链和重链通过二硫键相连接[6]。应用超高效液相色谱串联四极杆飞行时间质谱系统,测定单抗完整蛋白,利用UNIFI软件内嵌入的MaxEnt 1算法对采集到的多价态质谱数据进行去卷积化处理,得到赫赛汀单抗类似药分子的平均Mr。单抗原研药和类似药去卷积化处理后的质谱图(图1)显示,类似药和原研药Mr一致,赫赛汀类似药与原研药相对分子质量的偏差在1Da以内。单抗的的质谱图呈现多个质谱峰,这些质量峰是由重链Fc区不同N-聚糖所致[7-8]。

图1 去卷积化赫赛汀与类似药的质谱图(上原研药、下类似药)Fig.1 Herceptin (red) and biosimilar (blue) mass deconvolution spectrum
2.2抗体亚基轻链、重链的分析结果 单抗还原后解离为2条轻链和2条重链。通过对轻链和重链进行质谱分析和去卷积化处理,可得到轻链和重链的准确Mr[9]。赫赛汀单抗类似药轻链和重链去卷积化处理后的质谱图显示(图2,3),单抗类似药轻链和重链的Mr都与原研药一致。由于重链存在不同的糖基化修饰,图3呈现多个质量峰。
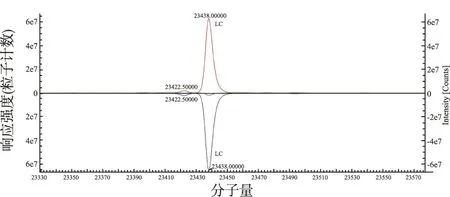
图2 赫赛汀和类似药轻链的去卷积化质谱图(上原研药、下类似药)Fig.2 Herceptin (red) and biosimilar (blue) light chain mass deconvolution spectrum

图3 赫赛汀和类似药重链的去卷积化质谱图(上原研药、下类似药)Fig.3 Herceptin (red) and biosimilar (blue) heavy chain mass deconvolution spectrum
2.3抗体肽图分析结果 应用DIA质谱技术对单胰蛋白酶酶切后检测到的106个肽段进行肽图分析,类似药的氨基酸序列覆盖率可达99%以上。根据碎片离子数据以及通过各个CDR区(complementarity determining region)与参考峰的相对保留时间来标注单抗的CDR肽段(图4)。并将原研药与类似药的CDR肽段,进行比较分析,轻链上3个CDR区序列完全一致,类似药重链上CDR序列虽然被切到2个肽段,但主体一致,且重链上另2个CDR区序列完全一致,表明类似药与原研药的氨基酸序列相同(CDR信息源自IMGT/3Dstructure-DB and IMGT/2Dstructure-DB数据库)。
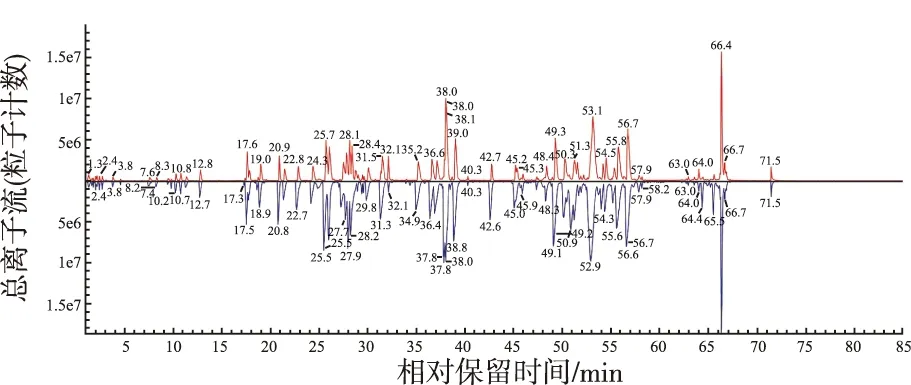
图4 赫赛汀肽图(上原研药、下类似药)Fig.4 Herceptin (red) and biosimilar (blue) peptide map
对表面甲硫氨酸容易氧化的肽段进行位点鉴定(非变性条件下氧化)[10-11],发现该抗体表面存在容易氧化的肽段6个。其中重链上分布5个,轻链上分布1个,且HC-CDR3上1个甲硫氨酸易被氧化;经UNIFI软件处理,通过高能量碎裂得到的“b,y”离子的准确质量,确认了这些肽段的信息[12](图5)。

图5 易氧化肽段的二级碎片(b,y)离子信息Fig.5 Secondary fragment (b, y) ion information of easily oxidized peptides
基于二级质谱数据的肽图分析显示,该单抗的N-聚糖修饰发生在重链的第25个酶切肽段。将利妥原研药和类似药的H:T25肽段质谱图进行比较显示,二者的糖基化修饰一致(图6、图7)。

图6 赫赛汀 H:T25肽段质谱图Fig.6 H:T25 peptide mass spectrum of herceptin

图7 类似药H:T25肽段质谱图Fig.7 H:T25 peptide mass spectrum of biosimilar
3 讨论
笔者在本实验依托DIA质谱技术建立了一套抗体类药物的结构鉴定方法。分别从完整蛋白的层面、抗体轻重链的层面以及肽图的层面,多维度对抗体药物的结构进行了解析;并将赫赛汀类似药与原研药进行比较,根据以上3个不同层面分析结果的相互验证补充,可以对抗体类药物结构进行确认。
完整蛋白的质谱分析有助于确定生物分子是否得到正确表达以及翻译后修饰(PTM)是否正确,可总体呈现该蛋白的非均一性特征。轻、重链的质谱分析可以从亚基水平上确定蛋白的Mr,考察蛋白的非均一性特征。在此项研究中,应用LC/MS获得了抗体类药物的完整蛋白及轻链和重链的Mr,同时确认了糖基化修饰发生在该抗体分子的重链。相对于完整蛋白分析,将类似药亚基的Mr与原研药进行比较,可根据Mr的差别初步判定二者的一级氨基酸序列是否一致;若Mr存在差异,也可判定出差异是位于轻链或者重链。同时鉴于还原后的单抗单条重链仅含1个N-聚糖,糖基化修饰相对简单,可排除由多个不同糖链引起的Mr的差别,从而更直接的反应蛋白本身序列的差异。
肽图分析是分析抗体药物表征工作中非常重要的内容,能获得最全面的理化和结构信息。DIA质谱技术将质谱整个全扫描范围分为若干个可变窗口,根据m/z分布密度计算合理的窗口宽度和数量,高速、循环地对每个窗口中的所有离子进行选择、碎裂、检测,该技术无需指定目标肽段,扫描点数均匀,可以无遗漏地获得样本中所有离子的全部碎片信息,数据利用度大大提高,缺失值更少。在此项研究中,一次液质分析可同时获得高精确的母离子及碎片离子信息,由“低碰撞能”与“高碰撞能”两种扫描交替构成,分别记录母离子及碎片信息,并通过母离子与其碎片离子具有相同色谱行为的特性进行母子离子的关联归属[13-15]。基于质谱检测的肽图分析可以非常方便地对蛋白质PTM 进行详尽且全面的表征。DIA质谱技术获得的碎片离子信息(二级质谱数据)可用于序列分析和PTM 的确定。在此项研究中,基于DIA质谱技术的肽图分析显示,类似药的氨基酸序列覆盖率可达99%以上,同时还获得了PTM 的鉴定结果。根据不同层面分析结果的相互验证补充,可证明赫赛汀单抗类似药与原研药的糖基化修饰十分相似。
DIA质谱技术可用于赫赛汀及其类似药的结构表征和相似性比较研究,为今后其他抗体药物结构表征平台的建立提供了依据。
