基于碳量子点荧光法测定药品中链霉素的含量
2022-03-27冯建海李丽萍李胜英
冯建海,李丽萍,李胜英
(河池学院 化学与生物工程学院,广西 宜州 546300)
碳量子点是一种新型的荧光碳纳米材料,一般情况下粒径小于10 nm,因其较低的制备成本、良好的光学性能、易修饰的表面、良好的生物相容性以及较低的细胞毒性等优点,在生物成像、荧光探针和药物分析等领域得到了广泛的应用[1-6]。目前研究者建立了多种制备碳量子点的方法[7-13],如电弧放电法、电化学法、化学氧化法、超声处理和微波辐射法、激光刻蚀法和水热法。其中水热法被认为是操作较简单又高效的制备方法,具有可控性和调变性。因此本试验选用水热法制备碳量子点。
链霉素是氨基糖苷类抗生素,具有广谱抗菌性,目前已经广泛应用于畜牧兽医农业领域[14-15]。同时链霉素具有耳毒性和肾毒性,因此它在动植物性食品中的残留已经引起了国内外的广泛关注。链霉素的检测方法有液相色谱法[16-17]、酶联免疫吸附分析法[18]和色谱-质谱串联法[19-20],这些仪器分析法准确度高,但是这些检测方法操作较复杂,测定样品前要进行预处理,而同时这些方法耗费相对太高,操作过于繁琐,不能快速进行检测,所以不适于大量样品的快速检测。目前以碳量子点为荧光探针测定链霉素残留的研究较少,但近年来以碳量子点作为荧光探针对药物进行检测与分析的试验结果都充分体现了碳量子点在此领域的应用前景以及荧光分析方法的可靠性。元晓云等[21]基于链霉素使CdTe量子点的荧光发生变化的特性,建立测定链霉素含量的分析方法,并成功用于黄瓜中链霉素残留量的检测。
本试验在相关研究的基础上,以水为溶剂,葡萄糖与半胱氨酸为原料,用水热法制备有良好荧光效果的碳点,利用链霉素与碳量子点的配位结合,改变量子点的荧光强度。根据荧光强度变化与链霉素浓度的关系,建立测定链霉素含量的荧光分析法,并对测定条件进行优化,对提高测定药品,动植物等食品中链霉素含量的结果准确性、可靠性具有较强的实际意义。
1 材料与方法
1.1 材料与试剂
L-半胱氨酸(生化试剂)、葡萄糖(分析纯)、Fe(NO3)3·9H2O(分析纯)、链霉素(生化试剂):天津市光复精细化工研究所;NaH2PO4·2H2O(分析纯)、Na2HPO4·12H2O(分析纯):西陇科学股份有限公司;Mg(NO3)2·6H2O(分析纯):天津市化学试剂三厂;淀粉(药典级):九鼎化学科技有限公司;糊精(分析纯):上海麦克林生化科技有限公司;链霉素(标准品):阿达玛斯试剂有限公司。
1.2 仪器与设备
荧光分光光度计(LS-45/55):铂金埃尔默科技有限公司;紫外可见分光光度计(Agilent8453):安捷伦科技有限公司;超声波清洗机(KQ-2200B):巩义市予华仪器有限责任公司;干燥箱(DZF-6050):上海齐欣科学仪器有限公司;超纯水机(DISCV-I-18):成都艾柯水处理设备有限公司;三用紫外分析仪(ZF-1):杭州齐威仪器有限公司;低速离心机(KA-1000C):上海安亭科学仪器;电子天平(FA1004B):上海越平科学仪器有限公司。
1.3 试验方法
1.3.1 碳量子点的制备与筛选
将0.5 g葡萄糖和一定量L-半胱氨酸溶于20 mL蒸馏水中,30℃超声(1 800 W)10 min,溶解分散后转至反应釜在烘箱中180℃反应12 h,反应完后溶液冷却,用0.22 μm的过滤头过滤,除去大颗粒物,沉淀离心后,取出上清液,放入透析袋透析24 h,透析期间不断换蒸馏水。透析后碳点溶液通过分子荧光光谱测定碳量子点溶液的荧光强度。
改变 L-半胱氨酸添加量(0、0.1、0.2、0.3 g)研究其对碳量子点溶液荧光强度的影响。
1.3.2 激发波长的选择
在25℃下,将碳量子点溶液倒入四面透光石英比色皿中,改变激发波长(360 nm~500 nm),激发狭缝宽度和发射狭缝宽度均为10 nm,测定量子点的荧光强度,确定最优激发波长。
1.3.3 碳点用量的选择
移取一定量的碳量子点(0.5、1.0、1.5 mL)溶液至5 mL容量瓶中,再加入1 mL 1×10-6mol/L的链霉素标准溶液,用超纯水定容至刻度,摇匀,静置25 min后,测定其荧光强度,使稀释后的碳点溶液荧光强度在仪器量程(≤1 000)的三分之二左右。
1.3.4 溶剂pH值及反应时间
配制NaH2PO4-Na2HPO4缓冲溶液,配制不同pH值的缓冲液,取1 mL碳量子点和1 mL 1×10-6mol/L的链霉素,用缓冲溶液定容到5 mL容量瓶中,摇匀,测定用不同pH值缓冲溶液定容条件下的荧光强度(F),同时配制空白对比溶液(即其他条件一样,只是不加入链霉素)测其荧光强度(F0),以 ΔF(ΔF=F/F0)和反应时间绘制曲线,选出荧光强度较稳定的pH值并确定最佳反应时间。
1.3.5 标准曲线的绘制
分别移取1mL的碳量子点至5mL容量瓶中,再分别加入1mL不同浓度的链霉素标准溶液(1×10-5mol/L~1×10-8mol/L),用最佳 pH 值的 NaH2PO4-Na2HPO4缓冲溶液定容至刻度线。另取一个5 mL容量瓶,不加链霉素溶液,只加1 mL碳量子点,定容至刻度作为空白溶液,在25℃,选用最优激发波长,测定反应体系的荧光强度(F)与空白溶液荧光强度(F0),以 ΔF(ΔF=F/F0)和链霉素反应浓度绘制标准曲线。
1.3.6 共存物的影响
取1 mL碳量子点、1 mL链霉素(1×10-6moL/L)置于5 mL容量瓶中,然后对应容量瓶中分别加入1 mL Zn2+、Mg2+、Fe3+、淀粉和糊精溶液(药品辅料),浓度均为1×10-4moL/L,用最佳pH值的NaH2PO4-Na2HPO4缓冲溶液定容至刻度,摇匀。另取2个5 mL的容量瓶,一个只加入1 mL碳量子点(空白),另一个加入1 mL碳量子点和1 mL 链霉素(1×10-6moL/L),不加共存物,用同样的NaH2PO4-Na2HPO4缓冲溶液定容至刻度,摇匀。在25℃下,测定各溶液的荧光强度(F)与空白液荧光强度(F0),考察共存物对链霉素浓度测定的影响。
1.3.7 样品中链霉素的测定
链霉素药品试样的制备:链霉素药品研碎,称取一定量样品溶解于水中,超声15 min后定容于100 mL容量瓶中,并根据当前浓度逐渐稀释到指定浓度。
采用测定一系列链霉素标准溶液相同的条件,测定样品的荧光强度,根据标准曲线计算样品链霉素的含量,同时在样品中加入一定体积的链霉素标准液,同步测定体系的荧光强度,并计算样品加标回收率以及相对标准偏差。根据下式计算加标回收率和相对标准偏差。
加标回收率/%=[(加标试样测定值-试样测定值)/加标量]×100

式中:RSD为相对标准偏差;S为标准偏差;Xi为测量值;为所测数据的算术平均值;n为测量次数。
1.4 数据处理
采用EXCEL 2010软件进行数据整理和计算,通过Origin 8.5绘图。
2 结果与分析
2.1 制备碳量子点的原料优选及波长的选择
图1为不同原料量制备的碳点在最佳激发波长时的荧光光谱图,图2为用0.5 g葡萄糖和0.2 g L-半胱氨酸混合制备碳点的荧光光谱图。

图1 不同原料制备的碳点在最佳激发波长下的荧光光谱图Fig.1 Fluorescence spectra of carbon dots prepared from different raw materials at optimum excitation wavelength
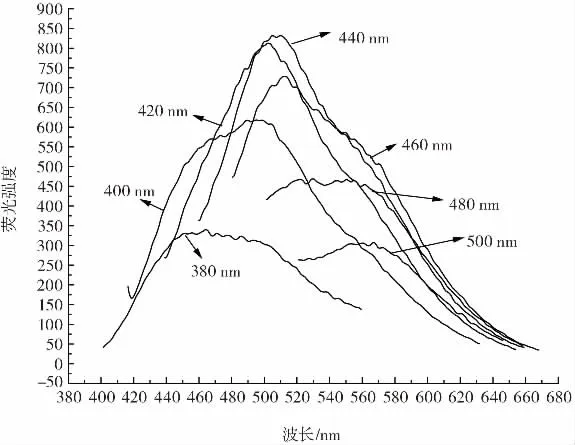
图2 0.5 g葡萄糖和0.2 g L-半胱氨酸用量下制备碳点的荧光光谱图Fig.2 Fluorescence spectra of carbon dots prepared with 0.5 g glucose and 0.2 g L-cysteine
加入不同量的原料制备不同的碳量子点,研究制备条件对碳量子点荧光强度的影响。由图1可知,随着半胱氨酸用量的增加,最佳发射波长逐渐红移,但荧光强度先增强后减弱。由图2可知,随着激发波长从380 nm增加到500 nm,荧光碳点溶液的发射波长荧光强度先升高后降低,峰的位置也随之红移,这是由于不同能级通过不同官能团形成的不同“表面态”和溶液中不同粒径碳点共存有关,符合文献[22]报道的碳量子点具备激发独立性的特点。由图1和图2可知,0.5 g葡萄糖和0.2 g L-半胱氨酸用量下混合制备碳点的最佳激发波长偏长波方向,且其在最佳激发波长440 nm下具有最高的发射荧光强度,因此本试验采用0.5 g葡萄糖和0.2 g L-半胱氨酸用量下制备碳量子点并选用其最优激发波长440 nm测定溶液荧光强度。
2.2 碳量子点的形貌及光谱特性
碳量子点紫外-可见吸收光谱图见图3。

图3 碳量子点紫外-可见吸收光谱图Fig.3 Ultraviolet-visible absorption spectra of carbon quantum dots
所制备碳量子点在白炽光条件下碳量子点的颜色为淡黄棕色,在黑暗中用365 nm紫外光照射时,碳量子点有荧光效果,颜色为淡蓝色。如图3所示,在250 nm~270 nm波长之间有一个吸收峰,说明形成的碳量子点存在共轭结构[23],这是归于碳量子点sp2区域的 π-π*跃迁[23-24]。
2.3 碳量子点用量的选择
图4为碳量子点用量对荧光强度的影响。
由图4所知,加入碳点量为0.5 mL时,荧光强度较低;加入碳点量为1 mL时,荧光强度较适中;加入碳点1.5 mL时,荧光强度较强,考虑到链霉素或其他因素对碳量子点溶液造成的荧光猝灭或增强现象及仪器的检测强度范围(≤1 000),所以在定容至5 mL容量瓶的情况下,加入1 mL的碳量子点较适宜。
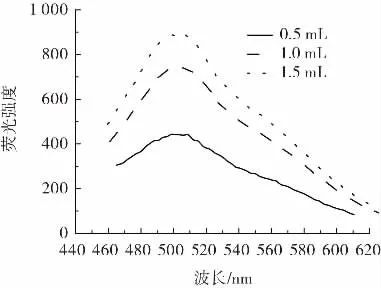
图4 碳量子点用量对荧光强度的影响Fig.4 Effect of the amount of carbon quantum dots on fluorescence intensity
2.4 pH值与反应时间的选择
探讨NaH2PO4-Na2HPO4缓冲溶液配制的3个pH 值(6.9、7.1、7.4)下,加入链霉素后碳点荧光强度的稳定性,结果如图5所示。

图5 pH值及反应时间对荧光体系的影响Fig.5 Effect of pH value and reaction time on fluorescence system
链霉素是弱碱性有机物,在偏中性环境中较稳定。从图5可知,pH值为6.9、7.1、7.4时,溶液在15 min的时间内可以达到稳定状态,并持续较长时间。缓冲溶液pH值为6.9和7.1时,碳点溶液都有稍强的荧光增强或明显的猝灭效果,而缓冲液pH值为7.4时,荧光强度无明显荧光增强或猝灭现象而且稳定,所以确定后续试验在pH7.4的缓冲溶液中进行。
2.5 共存物的影响
试验研究在链霉素浓度为2×10-7moL/L时,考察浓度均为 2×10-5moL/L 的共存物(Zn2+、Mg2+、Fe3+、淀粉、糊精)对体系荧光强度的影响,结果如图6所示。
由图 6 可知,Mg2+、Zn2+、Fe3+、淀粉和糊精对体系荧光强度的影响相对较小,可忽略其存在。
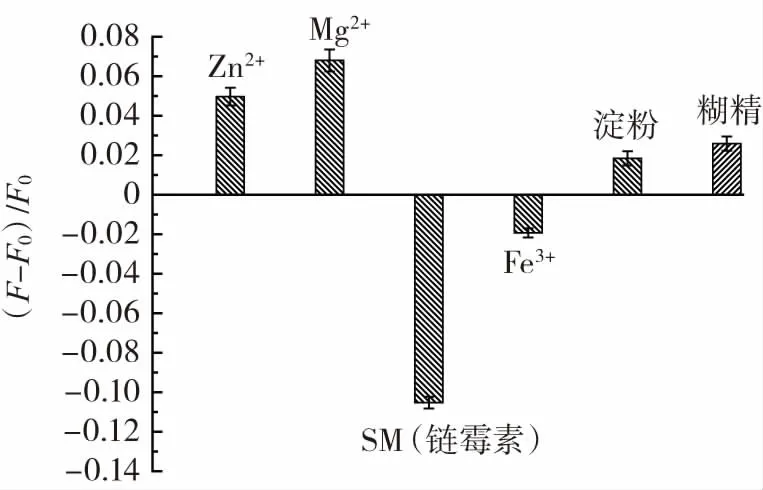
图6 共存物质对链霉素的荧光强度测定干扰图Fig.6 Interference of fluorescence intensity determination of streptomycin by coexisting substances
2.6 线性范围
在定容于5 mL容量瓶中碳量子点的用量为1 mL,缓冲溶液的pH值为7.4,荧光测试激发波长为440 nm检测条件下,研究测定不同浓度的链霉素与碳量子点结合后,体系荧光强度变化的规律。以链霉素浓度为横坐标,相对荧光强度(ΔF=F/F0)为纵坐标做线性曲线,如图7所示。
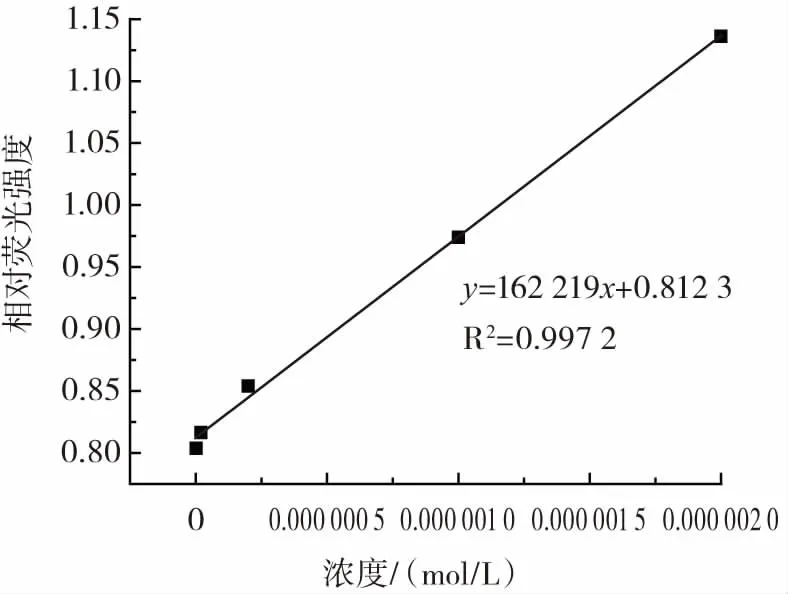
图7 不同浓度的链霉素与体系相对荧光强度变化的标准曲线Fig.7 Standard curve of relative fluorescence intensity of streptomycin with different concentrations
在 2×10-9mol/L~2×10-6mol/L,链霉素浓度与体系荧光强度F/F0呈现出良好的线性关系,其线性回归方程为y=162 219x+0.812 3,相关系数为0.997 2。根据国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry)的规定以空白的3倍标准偏差除以标准曲线的斜率得到了本试验方法的检出限为CL=3S/K=8.62×10-10mol/L。
2.7 样品分析
样品加标回收率检测结果见表1。

表1 样品加标回收率检测结果(n=5)Table 1 Determination results of standard recovery rate(n=5)
将链霉素药品研碎,称取一定量样品溶解于水中,超声15 min后定容于100 mL容量瓶中,并根据当前浓度逐渐稀释到指定浓度,在上述最佳试验条件下,平行测定5次,同时做加标回收试验。回收率在98.30%~101.50%,相对标准偏差较小。所以用碳点法检测链霉素浓度有一定的可行性。
3 结论
以葡萄糖、L-半胱氨酸为原料,采用水热法一步合成荧光碳量子点,并对碳量子点对链霉素的荧光现象的试验条件进行优化,探讨共存离子对链霉素荧光现象的影响,同时研究碳点荧光现象与链霉素的浓度线性响应范围,并做加标回收率试验。试验结果表明:在0.5 g葡萄糖和0.2 g L-半胱氨酸用量下,以此条件制备的碳量子点作为荧光探针,检测链霉素的最佳环境:定容于5 mL容量瓶中碳量子点的用量为1 mL,缓冲溶液的pH值为7.4,激发波长为440 nm下,测得链霉素对荧光碳量子点的荧光强度有较明显的荧光变化效果且较稳定。在此条件下链霉素在浓度2×10-9moL/L~2×10-6moL/L,其浓度与相对荧光强度呈现出良好的线性关系,线性回归方程为y=162 219x+0.812 3,相关系数为0.997 2。加标回收率在98.30%~101.50%,相对标准偏较小。Zn2+、Mg2+、Fe3+、淀粉、糊精这五种共存物质对体系荧光强度的影响较小,说明利用碳点溶液的荧光现象测定一定低浓度范围的链霉素溶液的方法具有较高的可靠性和参考价值。
